名校
解题方法
1 . 周期表中ⅢA族单质及其化合物应用广泛。BF3极易水解,生成HBF4(HBF4在水中完全电离为H+和 )和硼酸(H3BO3)。硼酸是一元弱酸,能溶于水,硼酸和甲醇在浓硫酸存在下生成挥发性的硼酸甲酯[B(OCH3)3],硼酸甲酯主要用作热稳定剂、木材防腐剂等。高温下Al2O3和焦炭在氯气的氛围中获得AlCl3。GaN的结构与晶体硅类似,是第三代半导体研究的热点。铊(TI)位于元素周期表中第6周期,于1861年发现。下列物质性质与用途具有对应关系的是
)和硼酸(H3BO3)。硼酸是一元弱酸,能溶于水,硼酸和甲醇在浓硫酸存在下生成挥发性的硼酸甲酯[B(OCH3)3],硼酸甲酯主要用作热稳定剂、木材防腐剂等。高温下Al2O3和焦炭在氯气的氛围中获得AlCl3。GaN的结构与晶体硅类似,是第三代半导体研究的热点。铊(TI)位于元素周期表中第6周期,于1861年发现。下列物质性质与用途具有对应关系的是
 )和硼酸(H3BO3)。硼酸是一元弱酸,能溶于水,硼酸和甲醇在浓硫酸存在下生成挥发性的硼酸甲酯[B(OCH3)3],硼酸甲酯主要用作热稳定剂、木材防腐剂等。高温下Al2O3和焦炭在氯气的氛围中获得AlCl3。GaN的结构与晶体硅类似,是第三代半导体研究的热点。铊(TI)位于元素周期表中第6周期,于1861年发现。下列物质性质与用途具有对应关系的是
)和硼酸(H3BO3)。硼酸是一元弱酸,能溶于水,硼酸和甲醇在浓硫酸存在下生成挥发性的硼酸甲酯[B(OCH3)3],硼酸甲酯主要用作热稳定剂、木材防腐剂等。高温下Al2O3和焦炭在氯气的氛围中获得AlCl3。GaN的结构与晶体硅类似,是第三代半导体研究的热点。铊(TI)位于元素周期表中第6周期,于1861年发现。下列物质性质与用途具有对应关系的是| A.BF3极易水解,可用作有机反应的催化剂 |
| B.硼酸甲酯具有挥发性,可用作木材防腐剂 |
| C.GaN硬度大,可用作半导体材料 |
| D.Al(OH)3受热分解,可用作阻燃剂 |
您最近半年使用:0次
名校
解题方法
2 . 如图表示某化学反应在使用催化剂(b曲线)和未使用催化剂(a曲线)时,反应进程和能量的对应关系。下列说法一定正确的是
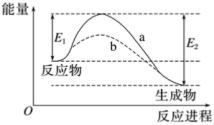

| A.a与b相比,b的活化能更高 |
| B.催化剂的使用,改变了反应的ΔH,因而能大大加快反应速率 |
| C.a与b相比,b中活化分子的百分数更高 |
| D.a与b相比,a的反应速率更快 |
您最近半年使用:0次
2023高三·全国·专题练习
3 . 氨是人类科学技术发展史上的一项重大突破,目前工业上用氢气和氨气直接合成氨。
(1)固氮一直是科学家致力研究的重要课题,有关热力学数据如下:
常温下,大气固氮的倾向___________ 工业固氮(填“大于”或“小于”)。
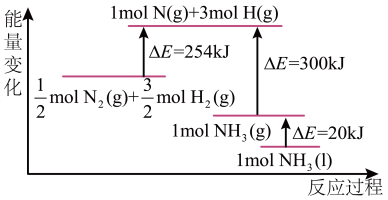
(2)N2(g)与H2(g) 反应的能量变化如图所示,则N2(g)与H2(g)反应制备NH3(l)的热化学方程式为:___________ 。
(3)T ℃时,在2 L恒容密闭容器中加入1.2 mol N2和2 mol H2模拟一定条件下工业固氮[N2(g)+3H2(g) 2NH3(g)],体系中n(NH3)随时间的变化如图所示:
2NH3(g)],体系中n(NH3)随时间的变化如图所示:
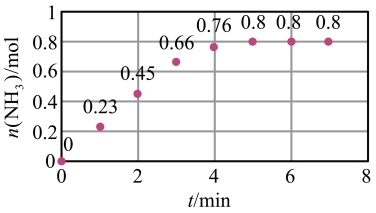
①前2分钟内的平均反应速率v(NH3)=___________ mol·L-1·min-1;
②有关工业固氮的说法正确的是___________ (选填序号)。
A.使用催化剂可提高反应物的转化率
B.循环使用N2、H2可提高NH3的产率
C.温度控制在500 ℃左右有利于反应向正方向进行
D.增大压强有利于加快反应速率,所以压强越大越好
③T ℃时,该反应的平衡常数为___________ ;
(4)研究表明某些过渡金属催化剂可以加速氨气的分解,某温度下,用等质量的不同金属分别催化等浓度的氨气,测得氨气分解的初始速率(单位:mmol/min)与催化剂的对应关系如表所示。
在不同催化剂的催化作用下,氨气分解反应中的活化能最大的催化剂是 ___________ (填化学式)。
(1)固氮一直是科学家致力研究的重要课题,有关热力学数据如下:
| 反应 | 大气固氮 N2(g)+O2(g)  2NO(g) 2NO(g) | 工业固氮 N2(g)+3H2(g)  2NH3(g) 2NH3(g) | ||||
| 温度/℃ | 25 | 2 000 | 25 | 350 | 400 | 450 |
| 平衡常数K | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.504 | 0.152 |
(2)N2(g)与H2(g) 反应的能量变化如图所示,则N2(g)与H2(g)反应制备NH3(l)的热化学方程式为:

(3)T ℃时,在2 L恒容密闭容器中加入1.2 mol N2和2 mol H2模拟一定条件下工业固氮[N2(g)+3H2(g)
 2NH3(g)],体系中n(NH3)随时间的变化如图所示:
2NH3(g)],体系中n(NH3)随时间的变化如图所示:
①前2分钟内的平均反应速率v(NH3)=
②有关工业固氮的说法正确的是
A.使用催化剂可提高反应物的转化率
B.循环使用N2、H2可提高NH3的产率
C.温度控制在500 ℃左右有利于反应向正方向进行
D.增大压强有利于加快反应速率,所以压强越大越好
③T ℃时,该反应的平衡常数为
(4)研究表明某些过渡金属催化剂可以加速氨气的分解,某温度下,用等质量的不同金属分别催化等浓度的氨气,测得氨气分解的初始速率(单位:mmol/min)与催化剂的对应关系如表所示。
| 催化剂 | Fe | Pd | Ru | Rh | Pt | Ni |
| 初始速率 | 0.5 | 1.8 | 7.9 | 4.0 | 2.2 | 3.0 |
您最近半年使用:0次
名校
4 . 下列实验操作及现象正确,且与解释或结论存在对应关系是
| 选项 | 实验操作及现象 | 解释或结论 |
| A | 向双氧水中滴加酸性 溶液,迅速有气泡生成 溶液,迅速有气泡生成 |  对 对 分解具有催化作用 分解具有催化作用 |
| B | 向 溶液中滴入足量氯水和 溶液中滴入足量氯水和 ,振荡、静置、分层;再向上层溶液中加入KSCN溶液,下层溶液呈紫红色,上层溶液变为血红色。 ,振荡、静置、分层;再向上层溶液中加入KSCN溶液,下层溶液呈紫红色,上层溶液变为血红色。 | 证明还原性: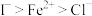 |
| C | 向硫酸酸化的食盐溶液中加入KI溶液和几滴淀粉溶液,溶液未变蓝色 | 该食盐不是含碘盐 |
| D | 向 溶液中滴入稀盐酸,出现白色凝胶 溶液中滴入稀盐酸,出现白色凝胶 | 非金属性: |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2023-05-30更新
|
75次组卷
|
2卷引用:山东省滨州市部分学校2022-2023学年高一下学期5月联考化学试题
名校
解题方法
5 . 图像可以直观地体现出化学变化中各种变化关系,加深对化学知识的理解。下列图像能够正确表示对应关系的是
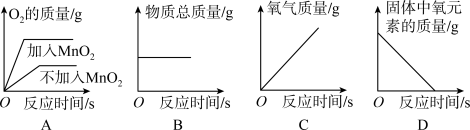

| A.用两份等质量的氯酸钾制取氧气 | B.木炭在盛有氧气的密闭容器中燃烧 |
| C.一定质量的过氧化氢溶液和二氧化锰制取氧气 | D.加热一定质量的高锰酸钾 |
您最近半年使用:0次
名校
解题方法
6 . H2O2是一种常见试剂,在实验室、工业生产上有广泛用途。H2O2不稳定、易分解,Fe3+、Cu2+等对其分解起催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组同学分别设计了如下图甲、乙两种实验装置。
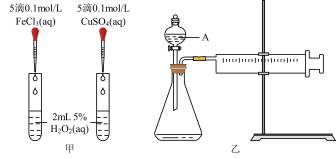
(1)若利用图甲装置,可通过观察___________ 现象,从而定性比较得出结论。
(2)有同学提出将0.1 FeCl3,改为
FeCl3,改为___________ 更为合理,其理由是___________ 。
(3)若利用乙实验可进行定量比较分析,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略,实验中还需要用到的实验仪器为___________ 。
(4)请简述如何用“微热法”检查装置乙的气密性良好:组装好实验装置,关闭分液漏斗活塞,___________ 。
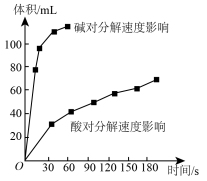
(5)如下图为某小组研究的酸、碱对H2O2分解的影响。该小组提出可以用BaO2固体与H2SO4溶液反应制H2O2,反应的化学方程式为___________ ,支持这一方案的理由是___________ 。
(6)使用催化剂Mn2+催化H2O2分解的反应中,Mn2+改变了___________ (填字母序号)
A.活化分子的浓度 B.反应限度 C.反应焓变
D.反应路径 E.反应活化能 F.活化分子百分数

(1)若利用图甲装置,可通过观察
(2)有同学提出将0.1
 FeCl3,改为
FeCl3,改为(3)若利用乙实验可进行定量比较分析,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略,实验中还需要用到的实验仪器为
(4)请简述如何用“微热法”检查装置乙的气密性良好:组装好实验装置,关闭分液漏斗活塞,
(5)如下图为某小组研究的酸、碱对H2O2分解的影响。该小组提出可以用BaO2固体与H2SO4溶液反应制H2O2,反应的化学方程式为

(6)使用催化剂Mn2+催化H2O2分解的反应中,Mn2+改变了
A.活化分子的浓度 B.反应限度 C.反应焓变
D.反应路径 E.反应活化能 F.活化分子百分数
您最近半年使用:0次
7 . 氨的用途十分广泛,是制造硝酸和氮肥的重要原料。
(1)工业合成氨中,合成塔中每产生2 molNH3,放出92.2kJ热量。

1 mol N-H键断裂吸收的能量约等于___________ kJ
(2)一定条件下,在恒温恒容的密闭容器中充入等物质的量N2和H2发生反应生成NH3,下列状态能说明反应达到平衡的是___________(填标号)。
(3)已知合成氨反应的速率方程为:ν=kcα(N2)cβ(H2)c-1(NH3),在合成氨过程中,需要不断分离出氨,可能的原因为___________ 。
(4)以氨为原料生产尿素的方程式为2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g)。
CO(NH2)2(l)+H2O(g)。
①为进一步提高NH3的平衡转化率,下列措施能达到目的的是___________ (填标号)。
A.增大CO2的浓度 B.增大压强 C.及时转移生成的尿素 D.使用更高效的催化剂
②尿素的合成分两步进行:
a.2NH3(g)+CO2(g) NH2COONH4(1) ΔH= ‒117 kJ/mol
NH2COONH4(1) ΔH= ‒117 kJ/mol
b.NH2COONH4(1) CO(NH2)2(1)+H2O(g) ΔH= +15 kJ/mol,第一步反应速率快,可判断活化能较大的是
CO(NH2)2(1)+H2O(g) ΔH= +15 kJ/mol,第一步反应速率快,可判断活化能较大的是___________ (填“第一步”或“第二步”)。
③某实验小组为了模拟工业上合成尿素,在恒温恒容的真空密闭容器中充入一定量的CO2和NH3发生反应:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g),反应过程中混合气体中NH3的体积分数如下图所示。
CO(NH2)2(l)+H2O(g),反应过程中混合气体中NH3的体积分数如下图所示。
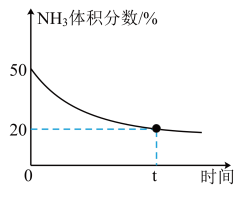
实验测得体系平衡时的压强为10MPa,计算该反应的平衡常数Kp=___________ MPa-2(已知:分压=总压×体积分数)。
(1)工业合成氨中,合成塔中每产生2 molNH3,放出92.2kJ热量。

1 mol N-H键断裂吸收的能量约等于
(2)一定条件下,在恒温恒容的密闭容器中充入等物质的量N2和H2发生反应生成NH3,下列状态能说明反应达到平衡的是___________(填标号)。
| A.容器内压强不变 | B.N2的体积分数不变 |
| C.气体的密度不再改变 | D.V正(N2)=3V逆(H2) |
(4)以氨为原料生产尿素的方程式为2NH3(g)+CO2(g)
 CO(NH2)2(l)+H2O(g)。
CO(NH2)2(l)+H2O(g)。①为进一步提高NH3的平衡转化率,下列措施能达到目的的是
A.增大CO2的浓度 B.增大压强 C.及时转移生成的尿素 D.使用更高效的催化剂
②尿素的合成分两步进行:
a.2NH3(g)+CO2(g)
 NH2COONH4(1) ΔH= ‒117 kJ/mol
NH2COONH4(1) ΔH= ‒117 kJ/molb.NH2COONH4(1)
 CO(NH2)2(1)+H2O(g) ΔH= +15 kJ/mol,第一步反应速率快,可判断活化能较大的是
CO(NH2)2(1)+H2O(g) ΔH= +15 kJ/mol,第一步反应速率快,可判断活化能较大的是③某实验小组为了模拟工业上合成尿素,在恒温恒容的真空密闭容器中充入一定量的CO2和NH3发生反应:2NH3(g)+CO2(g)
 CO(NH2)2(l)+H2O(g),反应过程中混合气体中NH3的体积分数如下图所示。
CO(NH2)2(l)+H2O(g),反应过程中混合气体中NH3的体积分数如下图所示。
实验测得体系平衡时的压强为10MPa,计算该反应的平衡常数Kp=
您最近半年使用:0次
8 .  是一种常见试剂,在实验室、工业生产上有广泛用途。
是一种常见试剂,在实验室、工业生产上有广泛用途。
I. 不稳定、易分解,
不稳定、易分解,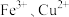 等对其分解起催化作用,为比较
等对其分解起催化作用,为比较 和
和 对
对 分解的催化效果,某化学研究小组同学分别设计了如图甲、乙两种实验装置。
分解的催化效果,某化学研究小组同学分别设计了如图甲、乙两种实验装置。
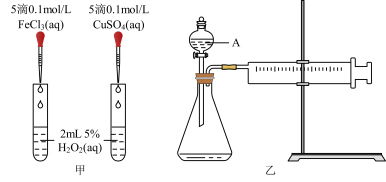
(1)若利用图甲装置,可通过观察___________ 现象,从而定性比较得出结论。
(2)有同学提出将 改为
改为___________  更为合理,其理由是
更为合理,其理由是___________ 。
(3)若利用乙实验可进行定量分析,实验时均以生成 气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是
气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是___________ 。
(4)如图为某小组研究的酸、碱对 分解的影响。该小组提出可以用
分解的影响。该小组提出可以用 固体与
固体与 溶液反应制
溶液反应制 ,反应的化学方程式为
,反应的化学方程式为___________ ,支持这一方案的理由是___________ 。
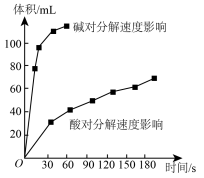
Ⅱ.实验室用 快速制氧气,其分解速率受多种因素影响。实验测得
快速制氧气,其分解速率受多种因素影响。实验测得 时不同条件下
时不同条件下 浓度随时间的变化如甲、乙、丙、丁四图所示:
浓度随时间的变化如甲、乙、丙、丁四图所示:
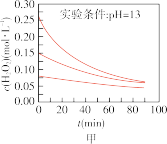

(5)下列说法正确的是:___________(填字母序号)
(6)催化剂 在反应中,改变了
在反应中,改变了___________ (填字母序号)
A.反应速率 B.反应限度 C.反应焓变 D.反应路径 E.反应活化能 F.活化分子百分数
 是一种常见试剂,在实验室、工业生产上有广泛用途。
是一种常见试剂,在实验室、工业生产上有广泛用途。I.
 不稳定、易分解,
不稳定、易分解,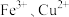 等对其分解起催化作用,为比较
等对其分解起催化作用,为比较 和
和 对
对 分解的催化效果,某化学研究小组同学分别设计了如图甲、乙两种实验装置。
分解的催化效果,某化学研究小组同学分别设计了如图甲、乙两种实验装置。
(1)若利用图甲装置,可通过观察
(2)有同学提出将
 改为
改为 更为合理,其理由是
更为合理,其理由是(3)若利用乙实验可进行定量分析,实验时均以生成
 气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是
气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是(4)如图为某小组研究的酸、碱对
 分解的影响。该小组提出可以用
分解的影响。该小组提出可以用 固体与
固体与 溶液反应制
溶液反应制 ,反应的化学方程式为
,反应的化学方程式为
Ⅱ.实验室用
 快速制氧气,其分解速率受多种因素影响。实验测得
快速制氧气,其分解速率受多种因素影响。实验测得 时不同条件下
时不同条件下 浓度随时间的变化如甲、乙、丙、丁四图所示:
浓度随时间的变化如甲、乙、丙、丁四图所示:



(5)下列说法正确的是:___________(填字母序号)
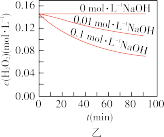
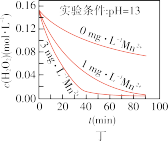
A.图甲表明,其他条件相同时, 浓度越小,其分解越慢 浓度越小,其分解越慢 |
B.图乙表明,其他条件相同时,溶液碱性越弱, 分解越快 分解越快 |
C.图丙表明,少量 存在时,溶液碱性越强, 存在时,溶液碱性越强, 分解越快 分解越快 |
D.图丁表明,碱性溶液中, 浓度越大,对 浓度越大,对 分解速率的影响越大 分解速率的影响越大 |
 在反应中,改变了
在反应中,改变了A.反应速率 B.反应限度 C.反应焓变 D.反应路径 E.反应活化能 F.活化分子百分数
您最近半年使用:0次
名校
9 . 氨气在工农业生产中有着重要的用途,研究合成氨反应具有重要意义。
(1)直接常压电化学合成氨以纳米 作催化剂,
作催化剂, 和
和 为原料制备
为原料制备 。其工作原理如图-1所示:
。其工作原理如图-1所示:
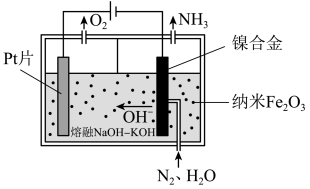
图-1
①阴极的电极反应式为___________ 。
②电解过程中,由于发生副反应,使得阴极制得的 中混有少量气体单质,则理论上阳极和阴极生成气体的物质的量之比的范围是
中混有少量气体单质,则理论上阳极和阴极生成气体的物质的量之比的范围是___________ 。
(2)一定条件下,哈伯-博施合成氨反应历程中的能量变化如图-2所示。合成氨反应的热化学方程式为___________ 。生成 的历程中,速率最慢的反应的化学方程式为
的历程中,速率最慢的反应的化学方程式为___________ 。
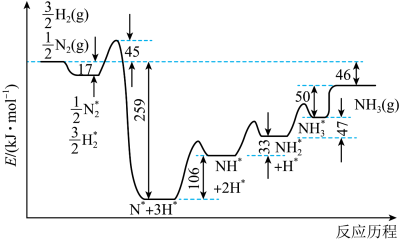
图-2
(3) 催化释氢可提供哈伯-博施合成氨反应所需的
催化释氢可提供哈伯-博施合成氨反应所需的 。在催化剂作用下,
。在催化剂作用下, 与水反应生成
与水反应生成 ,可能的反应机理如图-3所示。
,可能的反应机理如图-3所示。
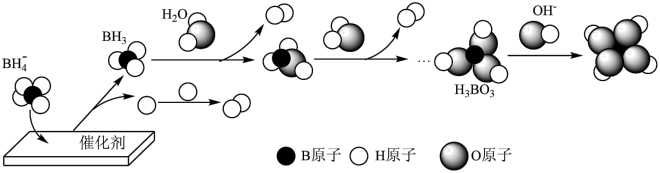
图-3
①其他条件不变时,以 代替
代替 催化释氢,所得气体的分子式为
催化释氢,所得气体的分子式为___________ 。
②已知: 为一元弱酸,
为一元弱酸, 水溶液呈酸性的原因是
水溶液呈酸性的原因是___________ (用离子方程式表示)。
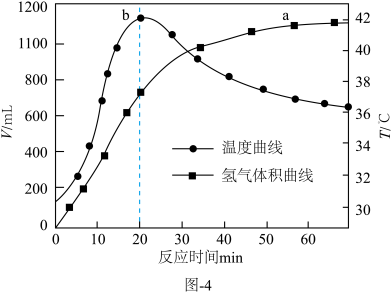
③在催化剂的作用下, 与水反应。释氢体积及温度随反应时间的变化如图-4所示。
与水反应。释氢体积及温度随反应时间的变化如图-4所示。 内,温度随时间快速升高的原因是
内,温度随时间快速升高的原因是___________ 。 后,氢气体积在增加,面温度却下降的原因是
后,氢气体积在增加,面温度却下降的原因是___________ 。
(1)直接常压电化学合成氨以纳米
 作催化剂,
作催化剂, 和
和 为原料制备
为原料制备 。其工作原理如图-1所示:
。其工作原理如图-1所示:
图-1
①阴极的电极反应式为
②电解过程中,由于发生副反应,使得阴极制得的
 中混有少量气体单质,则理论上阳极和阴极生成气体的物质的量之比的范围是
中混有少量气体单质,则理论上阳极和阴极生成气体的物质的量之比的范围是(2)一定条件下,哈伯-博施合成氨反应历程中的能量变化如图-2所示。合成氨反应的热化学方程式为
 的历程中,速率最慢的反应的化学方程式为
的历程中,速率最慢的反应的化学方程式为
图-2
(3)
 催化释氢可提供哈伯-博施合成氨反应所需的
催化释氢可提供哈伯-博施合成氨反应所需的 。在催化剂作用下,
。在催化剂作用下, 与水反应生成
与水反应生成 ,可能的反应机理如图-3所示。
,可能的反应机理如图-3所示。
图-3
①其他条件不变时,以
 代替
代替 催化释氢,所得气体的分子式为
催化释氢,所得气体的分子式为②已知:
 为一元弱酸,
为一元弱酸, 水溶液呈酸性的原因是
水溶液呈酸性的原因是③在催化剂的作用下,
 与水反应。释氢体积及温度随反应时间的变化如图-4所示。
与水反应。释氢体积及温度随反应时间的变化如图-4所示。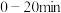 内,温度随时间快速升高的原因是
内,温度随时间快速升高的原因是 后,氢气体积在增加,面温度却下降的原因是
后,氢气体积在增加,面温度却下降的原因是
您最近半年使用:0次
22-23高三上·湖南长沙·阶段练习
名校
10 . 云南大学钱德云课题组最近合成一种用途广泛的手性N—烷基吲哚分子。反应历程如图所示:


已知:图示中 、
、 、R等表示烃基或氢原子且均不相同。下列叙述错误的是
、R等表示烃基或氢原子且均不相同。下列叙述错误的是


已知:图示中
 、
、 、R等表示烃基或氢原子且均不相同。下列叙述错误的是
、R等表示烃基或氢原子且均不相同。下列叙述错误的是| A.物质A是总反应的催化剂 |
| B.物质3分子含手性碳原子 |
| C.上述总反应为取代反应 |
| D.上述转化中Ni形成的共价键数目发生了变化 |
您最近半年使用:0次



