名校
解题方法
1 . 在如图所示的恒温、恒压密闭容器中加入 2mol X 和 2mol Y,发生如下反应并达到平衡(X、Y 状态未知):2X(?)+Y(?)  a Z(g)。起始时容器的体积为 V L,达到平衡时 X、Y、Z 的物质的量之比为 1:3:2,且容器的体积仍然为 V L。
a Z(g)。起始时容器的体积为 V L,达到平衡时 X、Y、Z 的物质的量之比为 1:3:2,且容器的体积仍然为 V L。

(1)a =___________ ;
(2)平衡时 Y 的转化率=___________ ;
(3)X 的状态为___________ ,Y 的状态为___________ (填“气态”或“非气态”);
(4)下列叙述中,不能说明上述反应达到限度的是___________ (填编号)。
a.气体密度不变 b.单位时间内消耗 2mol X,同时生成 amol Z
c.Y 的转化率不再变化 d.Z 的浓度不再变化
e.气体的质量不随时间的变化而变化
(5)若上述反应在恒温恒容下达到平衡后,在相同条件下,充入0.5mol Y,再次平衡时,Y的转化率___________ (填减小,不变,或增大)
 a Z(g)。起始时容器的体积为 V L,达到平衡时 X、Y、Z 的物质的量之比为 1:3:2,且容器的体积仍然为 V L。
a Z(g)。起始时容器的体积为 V L,达到平衡时 X、Y、Z 的物质的量之比为 1:3:2,且容器的体积仍然为 V L。 
(1)a =
(2)平衡时 Y 的转化率=
(3)X 的状态为
(4)下列叙述中,不能说明上述反应达到限度的是
a.气体密度不变 b.单位时间内消耗 2mol X,同时生成 amol Z
c.Y 的转化率不再变化 d.Z 的浓度不再变化
e.气体的质量不随时间的变化而变化
(5)若上述反应在恒温恒容下达到平衡后,在相同条件下,充入0.5mol Y,再次平衡时,Y的转化率
您最近一年使用:0次
名校
2 . 运用化学反应原理分析解答以下问题:
(1)弱酸在水溶液中存在电离平衡,部分0.1 mol·L-1弱酸的电离平衡常数如下表:
①当弱酸的浓度一定时,降低温度,K值___________ (填“变大”“变小”或“不变”)。
②下列离子方程式和有关说法错误的是___________ 。
a.少量的CO2通入次氯酸钠溶液中:2ClO-+H2O+CO2=2HClO+
b.少量的SO2通入碳酸钠溶液中:SO2+H2O+2 =2
=2 +
+
c.相同温度时,等物质的量浓度的三种弱酸与足量NaOH溶液完全中和消耗NaOH的体积为V(H2CO3)>V(H2SO3)>V(HClO)
(2)工业废水中常含有一定量的 和
和 ,它们对人类及生态系统会产生很大损害,必须进行处理后方可排放。
,它们对人类及生态系统会产生很大损害,必须进行处理后方可排放。
在废水中存在平衡:2 (黄色)+2H+
(黄色)+2H+
 (橙色)+H2O。若改变条件使上述平衡向逆反应方向移动,则下列说法正确的是
(橙色)+H2O。若改变条件使上述平衡向逆反应方向移动,则下列说法正确的是___________ 。
a.平衡常数K值可以不改变
b.达到新平衡 的消耗速率等于
的消耗速率等于 的消耗速率
的消耗速率
c.达到新平衡后,溶液pH一定增大
d.再达平衡前逆反应速率一定大于正反应速率
(3)已知:①2CH3OH(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
②CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
③CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
某温度下三个反应的平衡常数的值依次为K1、K2、K3,则该温度下反应3CO(g)+3H2(g) CH3OCH3(g)+CO2(g)的化学平衡常数K=
CH3OCH3(g)+CO2(g)的化学平衡常数K=___________ (用含K1、K2、K3的代数式表示)。
(1)弱酸在水溶液中存在电离平衡,部分0.1 mol·L-1弱酸的电离平衡常数如下表:
| 弱酸 | 电离平衡常数(25 ℃) |
| HClO | K=2.98×10-8 |
| H2CO3 | K1=4.3×10-7 K2=5.6×10-11 |
| H2SO3 | K1=1.54×10-2 K2=1.02×10-7 |
②下列离子方程式和有关说法错误的是
a.少量的CO2通入次氯酸钠溶液中:2ClO-+H2O+CO2=2HClO+

b.少量的SO2通入碳酸钠溶液中:SO2+H2O+2
 =2
=2 +
+
c.相同温度时,等物质的量浓度的三种弱酸与足量NaOH溶液完全中和消耗NaOH的体积为V(H2CO3)>V(H2SO3)>V(HClO)
(2)工业废水中常含有一定量的
 和
和 ,它们对人类及生态系统会产生很大损害,必须进行处理后方可排放。
,它们对人类及生态系统会产生很大损害,必须进行处理后方可排放。在废水中存在平衡:2
 (黄色)+2H+
(黄色)+2H+
 (橙色)+H2O。若改变条件使上述平衡向逆反应方向移动,则下列说法正确的是
(橙色)+H2O。若改变条件使上述平衡向逆反应方向移动,则下列说法正确的是a.平衡常数K值可以不改变
b.达到新平衡
 的消耗速率等于
的消耗速率等于 的消耗速率
的消耗速率c.达到新平衡后,溶液pH一定增大
d.再达平衡前逆反应速率一定大于正反应速率
(3)已知:①2CH3OH(g)
 CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g) ②CO(g)+2H2(g)
 CH3OH(g)
CH3OH(g)③CO(g)+H2O(g)
 CO2(g)+H2(g)
CO2(g)+H2(g)某温度下三个反应的平衡常数的值依次为K1、K2、K3,则该温度下反应3CO(g)+3H2(g)
 CH3OCH3(g)+CO2(g)的化学平衡常数K=
CH3OCH3(g)+CO2(g)的化学平衡常数K=
您最近一年使用:0次
2023-09-05更新
|
377次组卷
|
2卷引用:辽宁省大连市第八中学2021-2022学年高二上学期10月月考化学试题
3 .  、
、 等大气污染物的妥善处理对保护环境具有重要意义。
等大气污染物的妥善处理对保护环境具有重要意义。
(1)某日8时,大连市空气质量监测数据如下:
主要污染物中会使雨水 小于5.6的是
小于5.6的是___________ 。
(2)汽车中的三元催化器能使尾气中的 和
和 发生反应转化为无污染的气体,主要反应的化学方程式为
发生反应转化为无污染的气体,主要反应的化学方程式为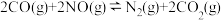 。
。
①下图为相同时间内不同温度下汽车尾气中 的转化率的变化情况。该反应最佳的催化剂与温度为
的转化率的变化情况。该反应最佳的催化剂与温度为___________ 。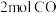 和
和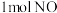 ,下列选项中不能说明该反应已经达到平衡状态的是
,下列选项中不能说明该反应已经达到平衡状态的是___________ 。
A. 和
和 的物质的量之比不变 B.混合气体的密度保持不变
的物质的量之比不变 B.混合气体的密度保持不变
C.混合气体的压强保持不变 D.
(3)为研究如何增大 和
和 催化反应的速率,某课题组进行了以下实验探究。
催化反应的速率,某课题组进行了以下实验探究。
①第I组实验中,达到平衡时 的浓度为
的浓度为___________ 。
②由曲线I、Ⅱ可知,增大催化剂比表面积,该化学反应速率将___________ (“增大”、“减小”或“无影响”)。
③由实验I和Ⅲ可得出的结论是___________ 。
(4)柴油发动机在工作中会产生更多的 ,需要加尿素去除。其工作原理:尿素水溶液热解产生的
,需要加尿素去除。其工作原理:尿素水溶液热解产生的 与尾气中的
与尾气中的 在
在 和催化剂的条件下发生反应生成无污染气体,写出
和催化剂的条件下发生反应生成无污染气体,写出 还原
还原 的化学方程式
的化学方程式___________ 。
 、
、 等大气污染物的妥善处理对保护环境具有重要意义。
等大气污染物的妥善处理对保护环境具有重要意义。(1)某日8时,大连市空气质量监测数据如下:
| 主要污染物 | 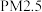 | 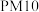 |  |  |  |  |
数值(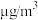 ) ) | 107 | 57 | 5 | 9 | 46 | 6 |
 小于5.6的是
小于5.6的是(2)汽车中的三元催化器能使尾气中的
 和
和 发生反应转化为无污染的气体,主要反应的化学方程式为
发生反应转化为无污染的气体,主要反应的化学方程式为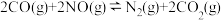 。
。①下图为相同时间内不同温度下汽车尾气中
 的转化率的变化情况。该反应最佳的催化剂与温度为
的转化率的变化情况。该反应最佳的催化剂与温度为
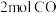 和
和 ,下列选项中不能说明该反应已经达到平衡状态的是
,下列选项中不能说明该反应已经达到平衡状态的是A.
 和
和 的物质的量之比不变 B.混合气体的密度保持不变
的物质的量之比不变 B.混合气体的密度保持不变C.混合气体的压强保持不变 D.

(3)为研究如何增大
 和
和 催化反应的速率,某课题组进行了以下实验探究。
催化反应的速率,某课题组进行了以下实验探究。| 编号 |  |  |  | 催化剂的比表面积 |
| I | 280 |  |  | 80.0 |
| II | 280 |  |  | 120.0 |
| III | 360 |  |  | 80.0 |

①第I组实验中,达到平衡时
 的浓度为
的浓度为②由曲线I、Ⅱ可知,增大催化剂比表面积,该化学反应速率将
③由实验I和Ⅲ可得出的结论是
(4)柴油发动机在工作中会产生更多的
 ,需要加尿素去除。其工作原理:尿素水溶液热解产生的
,需要加尿素去除。其工作原理:尿素水溶液热解产生的 与尾气中的
与尾气中的 在
在 和催化剂的条件下发生反应生成无污染气体,写出
和催化剂的条件下发生反应生成无污染气体,写出 还原
还原 的化学方程式
的化学方程式
您最近一年使用:0次
名校
解题方法
4 . 图表蕴含大量的信息,是分析解决化学问题的重要工具。
I.结合下图回答问题
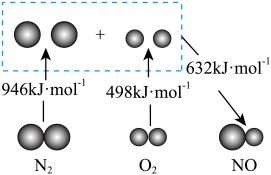
(1)图中三种分子最稳定的是___________ (填化学式)。
(2)若反应生成 气体
气体___________ (选“吸收”或“放出”)___________ kJ热量。
Ⅱ.某温度时,在一个 的密闭容器中,A、B、C三种气体的浓度随时间的变化曲线如下图所示。根据图中数据,回答下列问题:
的密闭容器中,A、B、C三种气体的浓度随时间的变化曲线如下图所示。根据图中数据,回答下列问题:

(3)该反应的化学方程式为___________ ;
(4)从开始至 ,B的平均反应速率为
,B的平均反应速率为___________ ;平衡时,C的物质的量为___________ ;
Ⅲ.已知:“零级反应”是指反应速率与反应物浓度无关的化学反应。某温度下,在 恒容密闭容器中
恒容密闭容器中 发生反应
发生反应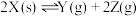 ,有关数据如下表:
,有关数据如下表:
(5)下列说法正确的是___________ 。
① 时,Z的浓度可能等于
时,Z的浓度可能等于
② 时,可逆反应可能建立平衡状态
时,可逆反应可能建立平衡状态
③ 时,无论反应是否为零级反应,Y的体积分数一定约为
时,无论反应是否为零级反应,Y的体积分数一定约为
④ 时,无论反应是否为零级反应,可逆反应都不可能建立平衡状态
时,无论反应是否为零级反应,可逆反应都不可能建立平衡状态
⑤ 时,X的物质的量为
时,X的物质的量为
⑥ 时,可逆反应可能刚刚建立平衡状态
时,可逆反应可能刚刚建立平衡状态
I.结合下图回答问题

(1)图中三种分子最稳定的是
(2)若反应生成
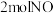 气体
气体Ⅱ.某温度时,在一个
 的密闭容器中,A、B、C三种气体的浓度随时间的变化曲线如下图所示。根据图中数据,回答下列问题:
的密闭容器中,A、B、C三种气体的浓度随时间的变化曲线如下图所示。根据图中数据,回答下列问题:
(3)该反应的化学方程式为
(4)从开始至
 ,B的平均反应速率为
,B的平均反应速率为Ⅲ.已知:“零级反应”是指反应速率与反应物浓度无关的化学反应。某温度下,在
 恒容密闭容器中
恒容密闭容器中 发生反应
发生反应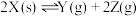 ,有关数据如下表:
,有关数据如下表:时间段 | 产物Z的平均生成速率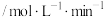 |
| 0~2 | 0.20 |
| 0~4 | 0.15 |
| 0~6 | 0.10 |
①
 时,Z的浓度可能等于
时,Z的浓度可能等于
②
 时,可逆反应可能建立平衡状态
时,可逆反应可能建立平衡状态③
 时,无论反应是否为零级反应,Y的体积分数一定约为
时,无论反应是否为零级反应,Y的体积分数一定约为
④
 时,无论反应是否为零级反应,可逆反应都不可能建立平衡状态
时,无论反应是否为零级反应,可逆反应都不可能建立平衡状态⑤
 时,X的物质的量为
时,X的物质的量为
⑥
 时,可逆反应可能刚刚建立平衡状态
时,可逆反应可能刚刚建立平衡状态
您最近一年使用:0次
2023-07-13更新
|
251次组卷
|
4卷引用:辽宁省五校(大连二十四中、东北育才等)2022-2023学年高一下学期期末考试化学试题
解题方法
5 . 一定温度下,向容积为2L的恒容密闭容器中通入两种气体发生反应:
 ,反应过程中各气体的物质的量的变化如图所示,请分析图中数据,回答下列问题:
,反应过程中各气体的物质的量的变化如图所示,请分析图中数据,回答下列问题:

(1)反应至6min时,
_______  。
。
(2)反应开始至2min,Z的平均反应速率为_______ ,此时反应_______ (填“已”或“未”)达到化学平衡,正反应速率_______ (填“>”、“<”或“=”)逆反应速率。
(3)该反应达到平衡状态的标志是_______(填标号)。
(4)若改变下列条件,推测该反应的速率发生的变化:
①升高温度,化学反应速率_______ (填“增大”、“减小”或“不变”,下同);
②向容器中充入1
 ,化学反应速率
,化学反应速率_______ ;
③其他条件不变,再通入1
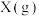 ,化学反应速率
,化学反应速率_______ 。

 ,反应过程中各气体的物质的量的变化如图所示,请分析图中数据,回答下列问题:
,反应过程中各气体的物质的量的变化如图所示,请分析图中数据,回答下列问题:
(1)反应至6min时,

 。
。(2)反应开始至2min,Z的平均反应速率为
(3)该反应达到平衡状态的标志是_______(填标号)。
| A.Y在混合气体中的体积分数保持不变 | B.混合气体的密度保持不变 |
| C.容器内气体的压强保持不变 | D.生成2 Z的同时消耗1 Z的同时消耗1 X X |
①升高温度,化学反应速率
②向容器中充入1

 ,化学反应速率
,化学反应速率③其他条件不变,再通入1

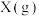 ,化学反应速率
,化学反应速率
您最近一年使用:0次
6 . I.利用催化氧化反应将 转化为
转化为 是工业上生产硫酸的关键步骤,发生反应,
是工业上生产硫酸的关键步骤,发生反应, 。请回答下列问题:
。请回答下列问题:
(1)某次实验中,在容积为 的恒温密闭容器中通入
的恒温密闭容器中通入 和
和 ,反应过程中部分物质的物质的量随反应时间的变化如图所示。
,反应过程中部分物质的物质的量随反应时间的变化如图所示。

① 时,
时,
_______ (填“>”、“>”或“=”) 。
。
②用 的浓度变化表示
的浓度变化表示 内反应的平均速率是
内反应的平均速率是_______ 。
③反应达到平衡时, 的体积分数为20%,则
的体积分数为20%,则
_______  。
。
(2)下列情况能够说明该反应达到化学平衡状态的是_______(填字母)。
II.某种燃料电池的工作原理示意图如图所示,a、b均为惰性电极。

(3)①使用时,空气从_______ (填“A”或“B”)口通入。
②假设使用的“燃料”是甲醇 ,a极的电极反应式为
,a极的电极反应式为_______ 。
 转化为
转化为 是工业上生产硫酸的关键步骤,发生反应,
是工业上生产硫酸的关键步骤,发生反应, 。请回答下列问题:
。请回答下列问题:(1)某次实验中,在容积为
 的恒温密闭容器中通入
的恒温密闭容器中通入 和
和 ,反应过程中部分物质的物质的量随反应时间的变化如图所示。
,反应过程中部分物质的物质的量随反应时间的变化如图所示。
①
 时,
时,
 。
。②用
 的浓度变化表示
的浓度变化表示 内反应的平均速率是
内反应的平均速率是③反应达到平衡时,
 的体积分数为20%,则
的体积分数为20%,则
 。
。(2)下列情况能够说明该反应达到化学平衡状态的是_______(填字母)。
A. |
| B.恒温恒容时,混合气体的密度不再随时间变化 |
C. 的物质的量不再变化 的物质的量不再变化 |
D.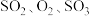 三者的浓度之比为2∶1∶2 三者的浓度之比为2∶1∶2 |
II.某种燃料电池的工作原理示意图如图所示,a、b均为惰性电极。

(3)①使用时,空气从
②假设使用的“燃料”是甲醇
 ,a极的电极反应式为
,a极的电极反应式为
您最近一年使用:0次
名校
7 . 甲烷水蒸气催化重整是制高纯氢的方法之一
(1)反应器中初始反应的生成物为H2和CO2,其物质的量之比为4:1,甲烷和水蒸气反应的方程式是___________ 。
(2)该反应认为是可逆反应。某温度时,在容积为2L的密闭容器中发生这一反应。其中,H2O(g)和CO2的物质的量随时间变化的曲线如右图所示。分析图中数据,回答下列问题。___________
②4min时,正反应速率___________ 逆反应速率(填“>”“<或“=”)
(3)已知反应器中还存在如下反应:
i.CH4(g)+H2O(g)=CO(g)+3H2(g) △H1
ii.CO(g)+H2O(g)=CO2(g)+H2(g) △H2
iii.CH4(g)=C(s)+2H2(g) △H3
……
iii为积炭反应,利用△H1和△H2计算△H3时,还需要利用___________ 反应的△H.
(4)对于反应C(s)+CO2(g) 2CO(g),一定温度下,足量的碳与一定量CO2发生上述反应,下列可判断反应已达到平衡状态的是
2CO(g),一定温度下,足量的碳与一定量CO2发生上述反应,下列可判断反应已达到平衡状态的是___________ 。
a.v正(CO2)=2v逆(CO)
b.CO2与CO的体积分数之比保持不变
c.恒容条件下,混合气体的平均密度不变
d.恒压条件下,混合气体的平均密度不变
(5)利用太阳能实现室温下甲烷重整制氢,电解质为稀硫酸。如图所示。___________ 极(填“正”或“负”)。
②写出负极的电极反应式___________ 。
(1)反应器中初始反应的生成物为H2和CO2,其物质的量之比为4:1,甲烷和水蒸气反应的方程式是
(2)该反应认为是可逆反应。某温度时,在容积为2L的密闭容器中发生这一反应。其中,H2O(g)和CO2的物质的量随时间变化的曲线如右图所示。分析图中数据,回答下列问题。
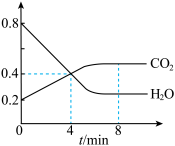
②4min时,正反应速率
(3)已知反应器中还存在如下反应:
i.CH4(g)+H2O(g)=CO(g)+3H2(g) △H1
ii.CO(g)+H2O(g)=CO2(g)+H2(g) △H2
iii.CH4(g)=C(s)+2H2(g) △H3
……
iii为积炭反应,利用△H1和△H2计算△H3时,还需要利用
(4)对于反应C(s)+CO2(g)
 2CO(g),一定温度下,足量的碳与一定量CO2发生上述反应,下列可判断反应已达到平衡状态的是
2CO(g),一定温度下,足量的碳与一定量CO2发生上述反应,下列可判断反应已达到平衡状态的是a.v正(CO2)=2v逆(CO)
b.CO2与CO的体积分数之比保持不变
c.恒容条件下,混合气体的平均密度不变
d.恒压条件下,混合气体的平均密度不变
(5)利用太阳能实现室温下甲烷重整制氢,电解质为稀硫酸。如图所示。
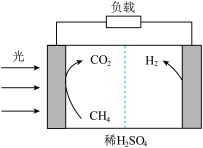
②写出负极的电极反应式
您最近一年使用:0次
名校
解题方法
8 . 速率与限度是认识和研究化学反应的两个重要方向,在化学研究和工业生产中都需要关注化学反应速率和限度。
(1)如图所示为工业合成氨的流程图。下列有关生产条件的调控作用分析正确的是______(填字母)。

(2)某学生为了探究锌与盐酸反应过程中的速率变化,在 某浓度的稀盐酸中加入足量的锌粉,充分反应,用排水集气法收集反应放出的氢气,实验记录如下(氢气体积是累计值):
某浓度的稀盐酸中加入足量的锌粉,充分反应,用排水集气法收集反应放出的氢气,实验记录如下(氢气体积是累计值):
①上述实验过程中,反应速率最大的时间段是______ (填字母),
A.0-1min B.1-2min C.2-3min D.3-4min E.4-5min
该时间段反应速率最大的主要原因是______ 。
②该盐酸的物质的量浓度为______ (保留到小数点后两位)
(3)将 纯净的氨基甲酸铵
纯净的氨基甲酸铵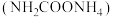 置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡: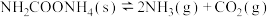 ,此时测得容器内混合气体的体积为
,此时测得容器内混合气体的体积为 (已换算成标准状况下)
(已换算成标准状况下)
①达到平衡时氨基甲酸铵的转化率为______ 。
②下列说法中,不能判断该反应已经达到化学平衡状态的是______ (填字母)
A.混合气体的密度保持不变
B.密闭容器中体总压强保持不变
C. 的体积分数保持不变
的体积分数保持不变
D.混合气体的平均相对分子质量保持不变
E. 的质量分数保持不变
的质量分数保持不变
(1)如图所示为工业合成氨的流程图。下列有关生产条件的调控作用分析正确的是______(填字母)。

| A.步骤②,为加快反应速率,压强越大越好 |
| B.步骤③,选择高效催化剂是合成氨反应的重要条件 |
| C.步骤④,将氨气液化分离出去可以提高反应速率 |
D.步骤⑤, 和 和 的再循环有利于提高原料的利用率,节约生产成本 的再循环有利于提高原料的利用率,节约生产成本 |
 某浓度的稀盐酸中加入足量的锌粉,充分反应,用排水集气法收集反应放出的氢气,实验记录如下(氢气体积是累计值):
某浓度的稀盐酸中加入足量的锌粉,充分反应,用排水集气法收集反应放出的氢气,实验记录如下(氢气体积是累计值):时间(min) | 1 | 2 | 3 | 4 | 5 | 6 |
氢气体积(mL)(标准状况) | 50 | 120 | 232 | 290 | 310 | 310 |
A.0-1min B.1-2min C.2-3min D.3-4min E.4-5min
该时间段反应速率最大的主要原因是
②该盐酸的物质的量浓度为
(3)将
 纯净的氨基甲酸铵
纯净的氨基甲酸铵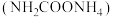 置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡: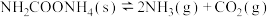 ,此时测得容器内混合气体的体积为
,此时测得容器内混合气体的体积为 (已换算成标准状况下)
(已换算成标准状况下)①达到平衡时氨基甲酸铵的转化率为
②下列说法中,不能判断该反应已经达到化学平衡状态的是
A.混合气体的密度保持不变
B.密闭容器中体总压强保持不变
C.
 的体积分数保持不变
的体积分数保持不变D.混合气体的平均相对分子质量保持不变
E.
 的质量分数保持不变
的质量分数保持不变
您最近一年使用:0次
名校
9 . I.SO2在工农业生产中有着重要的应用,请回答下列问题:
(1)工业上用软锰矿(主要成分为MnO2)制备Mn(H2PO4)2•2H2O。常用稀硫酸酸浸软锰矿,同时通入SO2,此时发生反应的离子方程式为_____ ,SO2作_____ (填“氧化剂”或“还原剂”)。
Ⅱ.一定温度下,向容积为2L的恒容密闭容器中通入2molSO2和1molO2,在一定条件下发生反应2SO2(g)+O2(g) 2SO3(g)。O2的物质的量随时间变化的实验数据如表所示:
2SO3(g)。O2的物质的量随时间变化的实验数据如表所示:
(2)下列说法能够判断上述反应达到化学平衡状态的是_____ (填标号)。
(3)上述反应体系的正反应速率和逆反应速率相等的时间段是_____ (填“0~4”、“4~8”、“8~12”“12~18”或“18~25”)min。
(4)0~8min内,用SO3表示该反应的平均速率为_____ mol•L-1•min-1,12min时,SO2的转化率为_____ 。
(5)若起始时容器内压强为p0MPa,则平衡时,容器内压强约为_____ (用含p0的代数式表示,保留2位有效数字)MPa。
(1)工业上用软锰矿(主要成分为MnO2)制备Mn(H2PO4)2•2H2O。常用稀硫酸酸浸软锰矿,同时通入SO2,此时发生反应的离子方程式为
Ⅱ.一定温度下,向容积为2L的恒容密闭容器中通入2molSO2和1molO2,在一定条件下发生反应2SO2(g)+O2(g)
 2SO3(g)。O2的物质的量随时间变化的实验数据如表所示:
2SO3(g)。O2的物质的量随时间变化的实验数据如表所示:| 时间/min | 4 | 8 | 12 | 18 | 25 |
| n(O2)/mol | 0.70 | 0.50 | 0.40 | 0.32 | 0.32 |
| A.v(SO2)=2v(O2) | B.容器内气体的平均摩尔质量不再发生变化 |
| C.SO2和O2的浓度之比为2:1 | D.SO3的百分含量不再发生变化 |
(4)0~8min内,用SO3表示该反应的平均速率为
(5)若起始时容器内压强为p0MPa,则平衡时,容器内压强约为
您最近一年使用:0次
2023-05-03更新
|
283次组卷
|
3卷引用:辽宁省部分学校联考2022-2023学年高一下学期4月月考化学试题
名校
解题方法
10 . 研究化学反应的快慢和限度具有十分重要的意义,回答下列问题:
(1)在固定体积的容器中进行反应:2SO2(g)+O2(g)⇌2SO3(g),该反应为放热反应。下列一定能加快该反应速率的措施是_______。
(2)常温下,实验室用100mL6.0 mol·L-1硫酸跟足量锌粉反应制取氢气。
①为降低反应进行的速率,又不影响生成氢气的量,可向反应物中加入_______ 。(填序号)。
A.CH3COONa固体 B.KNO3固体 C.K2SO4溶液 D.KHSO4溶液
②向溶液中滴加少量硫酸铜溶液,反应速率加快,原因是_______ 。
(3)一定温度下,在体积为aL的固定密闭容器中,有色气体N与无色气体M的物质的量随时间变化曲线如图所示。从反应开始到t1,平均反应速率v(N)=_______ 。该反应的化学方程式可表示为_______ 。(用M、N表示化学式)

下列说法中能够判定该反应处于平衡状态的是_______ 。(填序号)。
A.速率v(M)正=2v(N)逆 B.气体的总质量不再变化
C.气体的颜色不再变化 D.M的体积分数不变
(1)在固定体积的容器中进行反应:2SO2(g)+O2(g)⇌2SO3(g),该反应为放热反应。下列一定能加快该反应速率的措施是_______。
| A.降温 | B.充入氮气 | C.充入O2 | D.加入催化剂V2O5 |
①为降低反应进行的速率,又不影响生成氢气的量,可向反应物中加入
A.CH3COONa固体 B.KNO3固体 C.K2SO4溶液 D.KHSO4溶液
②向溶液中滴加少量硫酸铜溶液,反应速率加快,原因是
(3)一定温度下,在体积为aL的固定密闭容器中,有色气体N与无色气体M的物质的量随时间变化曲线如图所示。从反应开始到t1,平均反应速率v(N)=

下列说法中能够判定该反应处于平衡状态的是
A.速率v(M)正=2v(N)逆 B.气体的总质量不再变化
C.气体的颜色不再变化 D.M的体积分数不变
您最近一年使用:0次
2023-01-29更新
|
760次组卷
|
4卷引用:辽宁省实验中学2020-2021学年高一下学期期中考试化学试题



