2011·上海虹口·二模
1 . 利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。已知:SO2(g)+ O2(g)
O2(g) SO3(g)
SO3(g) +98kJ/mol
+98kJ/mol
(1)某温度下该反应的平衡常数K= ,若在此温度下,向100L的恒容密闭容器中,充入3.0molSO2(g)、16.0molO2(g)和3.0molSO3(g),则反应开始时v(正)
,若在此温度下,向100L的恒容密闭容器中,充入3.0molSO2(g)、16.0molO2(g)和3.0molSO3(g),则反应开始时v(正)__ v(逆)(填“<”、“>”或“=”)。
(2)一定温度下,向一带活塞的体积为20L的密闭容器中充入0.4molSO2和0.2molO2,达到平衡后体积变为16L,则平衡后SO2转化的百分率为__ 。
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是__ (填字母)。
A.保持温度和容器体积不变,充入0.2molO2
B.保持温度和容器内压强不变,充入0.4molSO3
C.降低温度
D.移动活塞压缩气体
(4)若以如图所示装置,用电化学原理生产硫酸,为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为__ 。

 O2(g)
O2(g) SO3(g)
SO3(g) +98kJ/mol
+98kJ/mol(1)某温度下该反应的平衡常数K=
 ,若在此温度下,向100L的恒容密闭容器中,充入3.0molSO2(g)、16.0molO2(g)和3.0molSO3(g),则反应开始时v(正)
,若在此温度下,向100L的恒容密闭容器中,充入3.0molSO2(g)、16.0molO2(g)和3.0molSO3(g),则反应开始时v(正)(2)一定温度下,向一带活塞的体积为20L的密闭容器中充入0.4molSO2和0.2molO2,达到平衡后体积变为16L,则平衡后SO2转化的百分率为
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是
A.保持温度和容器体积不变,充入0.2molO2
B.保持温度和容器内压强不变,充入0.4molSO3
C.降低温度
D.移动活塞压缩气体
(4)若以如图所示装置,用电化学原理生产硫酸,为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为

您最近一年使用:0次
名校
解题方法
2 . 研究 CO、CO2的回收利用既可变废为宝,又可减少碳的排放。回答下列问题:
(1)T1 K 时,将 1mol 二甲醚引入一个抽空的 50L 恒容容器中,发生分解反应:CH3OCH3(g) CH4(g)+H2(g)+CO(g) ,在不同时间测定容器内的总压,所得数据见下表:
CH4(g)+H2(g)+CO(g) ,在不同时间测定容器内的总压,所得数据见下表:
由表中数据计算:0~5.0 min 内的平均反应速率 v(CH3OCH3)=__________ ,该温度下平衡常数 K=_______________ 。
(2)在 T2 K、1.0×104 kPa 下,等物质的量的 CO 与 CH4混合气体发生如下反应:CO(g)+CH4(g) CH3CHO(g),反应速率 v正 −v逆=k正p(CO)•p (CH4)-k逆p(CH3CHO),k正、k逆分别为正、逆向反应速率常数,P为气体的分压(气体分压P=气体总压 P总×体积分数)。用气体分压表示的平衡常数 Kp=4.5×10-5(kPa)-1,则 CO 转化率为 20%时,
CH3CHO(g),反应速率 v正 −v逆=k正p(CO)•p (CH4)-k逆p(CH3CHO),k正、k逆分别为正、逆向反应速率常数,P为气体的分压(气体分压P=气体总压 P总×体积分数)。用气体分压表示的平衡常数 Kp=4.5×10-5(kPa)-1,则 CO 转化率为 20%时,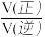 =
=____________ 。
(1)T1 K 时,将 1mol 二甲醚引入一个抽空的 50L 恒容容器中,发生分解反应:CH3OCH3(g)
 CH4(g)+H2(g)+CO(g) ,在不同时间测定容器内的总压,所得数据见下表:
CH4(g)+H2(g)+CO(g) ,在不同时间测定容器内的总压,所得数据见下表:| 反应时间t/min | 0 | 5.0 | 13.0 | 26.0 | 52.0 | ∞ |
| 气体总夺p总/kPa | 50.0 | 55.0 | 65.0 | 83.2 | 103.8 | 125.0 |
(2)在 T2 K、1.0×104 kPa 下,等物质的量的 CO 与 CH4混合气体发生如下反应:CO(g)+CH4(g)
 CH3CHO(g),反应速率 v正 −v逆=k正p(CO)•p (CH4)-k逆p(CH3CHO),k正、k逆分别为正、逆向反应速率常数,P为气体的分压(气体分压P=气体总压 P总×体积分数)。用气体分压表示的平衡常数 Kp=4.5×10-5(kPa)-1,则 CO 转化率为 20%时,
CH3CHO(g),反应速率 v正 −v逆=k正p(CO)•p (CH4)-k逆p(CH3CHO),k正、k逆分别为正、逆向反应速率常数,P为气体的分压(气体分压P=气体总压 P总×体积分数)。用气体分压表示的平衡常数 Kp=4.5×10-5(kPa)-1,则 CO 转化率为 20%时,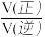 =
=
您最近一年使用:0次
3 . 含氮化合物在化学工业中有着重要的应用,回答下列问题:
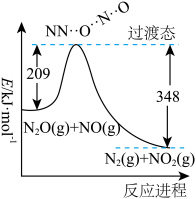
(1)由N2O和NO反应生成N2和NO2的能量变化(表示生成1molN2的能量变化)如图所示,该反应的热化学方程式为______________________ 。
(2)一定条件下,硝酸铵加热分解得到的产物只有N2O和H2O。250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的平衡常数表达式为K=___________ ;若有1mol硝酸铵完全分解,则转移电子的数目为___________ (设NA为阿伏伽德罗常数的值)。
(3)硝基苯甲酸乙酯在碱性条件下发生反应:O2NC6H4COOC2H5+OH- O2NC6H4COO-+C2H5OH。两种反应物的初始浓度均为0.80mol·L-1,T℃时测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示。
O2NC6H4COO-+C2H5OH。两种反应物的初始浓度均为0.80mol·L-1,T℃时测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示。
①该反应在60~90s与90~120s内的平均反应速率分别约为___________ ,___________ ;比较两者大小可得出的结论是______________________ 。
②计算T℃时该反应的平衡常数为______________________ 。
③为提高O2NC6H4COOC2H5的平衡转化率,除可适当控制反应温度外,还可以采取的措施为______________________ (写出一条即可)。
(1)由N2O和NO反应生成N2和NO2的能量变化(表示生成1molN2的能量变化)如图所示,该反应的热化学方程式为

(2)一定条件下,硝酸铵加热分解得到的产物只有N2O和H2O。250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的平衡常数表达式为K=
(3)硝基苯甲酸乙酯在碱性条件下发生反应:O2NC6H4COOC2H5+OH-
 O2NC6H4COO-+C2H5OH。两种反应物的初始浓度均为0.80mol·L-1,T℃时测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示。
O2NC6H4COO-+C2H5OH。两种反应物的初始浓度均为0.80mol·L-1,T℃时测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示。| t/s | 0 | 60 | 90 | 120 | 160 | 260 | 300 | 360 | 400 |
| a/% | 0 | 33.0 | 41.8 | 48.8 | 58.0 | 69.0 | 70.4 | 71.0 | 71.0 |
②计算T℃时该反应的平衡常数为
③为提高O2NC6H4COOC2H5的平衡转化率,除可适当控制反应温度外,还可以采取的措施为
您最近一年使用:0次
解题方法
4 . 在2L密闭容器内,800℃时反应:2NO(g)+O2(g) 2NO2(g),体系中n(NO2)随时间的变化如表:
2NO2(g),体系中n(NO2)随时间的变化如表:
(1)写出该反应的平衡常数表达式:K=____________ 。已知:K(350℃)300℃),则该反应是________ (填吸或放)热反应。
(2)下图中表示NO的变化的曲线是_________ (填字母)用O2表示从0~2 s内该反应的平均速率v=_________ 。

(3)能说明该反应已达到平衡状态的是______________ (填字母)
A.c(NO2)=2c(O2) B.容器内压强保持不变
C.v逆 (NO)=2v正(O2) D.容器内密度保持不变
 2NO2(g),体系中n(NO2)随时间的变化如表:
2NO2(g),体系中n(NO2)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO2)(mol) | 0.00 | 0.010 | 0.012 | 0.013 | 0.013 | 0.013 |
(1)写出该反应的平衡常数表达式:K=
(2)下图中表示NO的变化的曲线是

(3)能说明该反应已达到平衡状态的是
A.c(NO2)=2c(O2) B.容器内压强保持不变
C.v逆 (NO)=2v正(O2) D.容器内密度保持不变
您最近一年使用:0次
2011·江苏泰州·一模
5 . 在一容积为2 L的密闭容器中加入2 molA和3 molB,保持温度为30℃,在催化剂存在的条件下进行下列反应: ,达到平衡后生成1.2 mol C,此时,平衡混合气中C的体积分数为ω;若将温度升高到70℃后,其他条件均不变,当反应重新达到平衡时,C的物质的量为2.1 mol。
,达到平衡后生成1.2 mol C,此时,平衡混合气中C的体积分数为ω;若将温度升高到70℃后,其他条件均不变,当反应重新达到平衡时,C的物质的量为2.1 mol。
请回答下列问题,
(1)该反应的平衡常数K随温度升高而__________ (填“增大”、“减少”或“不变”),该反应的焓变△H______ 0(填“>”、“<”或“=”)。
(2)30℃时,平衡混合气中C的体积分数ω=_____________ ,A物质的转化率与B物质的转化率之比为______ 。
(3)30℃时,若在同一容器中加入3 molA、4 molB和____ molC,则平衡混合气中C的体积分数仍为ω,此时平衡时体系中A的物质的量浓度为_________ mol·L-1。
 ,达到平衡后生成1.2 mol C,此时,平衡混合气中C的体积分数为ω;若将温度升高到70℃后,其他条件均不变,当反应重新达到平衡时,C的物质的量为2.1 mol。
,达到平衡后生成1.2 mol C,此时,平衡混合气中C的体积分数为ω;若将温度升高到70℃后,其他条件均不变,当反应重新达到平衡时,C的物质的量为2.1 mol。请回答下列问题,
(1)该反应的平衡常数K随温度升高而
(2)30℃时,平衡混合气中C的体积分数ω=
(3)30℃时,若在同一容器中加入3 molA、4 molB和
您最近一年使用:0次



