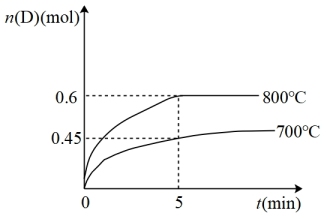
1 . 在容积为10L的密闭容器中,进行如下反应:A(g)+2B(g) C(g)+D(g),最初加入1.0mol A和2.2mol B,在不同温度下,D的物质的量n(D)和时间t的关系如图。
C(g)+D(g),最初加入1.0mol A和2.2mol B,在不同温度下,D的物质的量n(D)和时间t的关系如图。
试回答下列问题:
(1)800℃时,0~5min内,以B表示的平均反应速率为_______ 。
(2)能判断反应达到化学平衡状态的依据是_______(填字母)。
(3)若最初加入1.0mol A和2.2mol B,利用图中数据计算800℃时的平衡常数K=_______ ,该反应为_______ 反应(填“吸热”或“放热”)。
(4)已知 2CH3OH(g) CH3OCH3(g)+H2O(g),在不同温度下的平衡常数:400℃,K=32;500℃,K=44。已知在密闭容器中,测得某时刻各组分的浓度如下:
CH3OCH3(g)+H2O(g),在不同温度下的平衡常数:400℃,K=32;500℃,K=44。已知在密闭容器中,测得某时刻各组分的浓度如下:
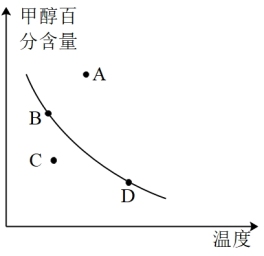
①判断该反应的∆H_______ 0(填“>”、“<”或“=”)。若此时系统温度400℃,比较正、逆反应速率的大小:υ正_______ υ逆(填“>”、“<”或“=”)。
②平衡时,若以甲醇百分含量为纵坐标,以温度为横坐标,此时反应点在图象的位置是图中_______ 点,比较图中B、D两点所对应的正反应速率B_______ D(填“>”、“<”或“=”)。
 C(g)+D(g),最初加入1.0mol A和2.2mol B,在不同温度下,D的物质的量n(D)和时间t的关系如图。
C(g)+D(g),最初加入1.0mol A和2.2mol B,在不同温度下,D的物质的量n(D)和时间t的关系如图。
试回答下列问题:
(1)800℃时,0~5min内,以B表示的平均反应速率为
(2)能判断反应达到化学平衡状态的依据是_______(填字母)。
| A.容器中压强不变 | B.混合气体中c(A)不变 |
| C.v正(B)=2v逆(D) | D.c(A)=c(C) |
(4)已知 2CH3OH(g)
 CH3OCH3(g)+H2O(g),在不同温度下的平衡常数:400℃,K=32;500℃,K=44。已知在密闭容器中,测得某时刻各组分的浓度如下:
CH3OCH3(g)+H2O(g),在不同温度下的平衡常数:400℃,K=32;500℃,K=44。已知在密闭容器中,测得某时刻各组分的浓度如下:| 物质 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
| 浓度/(mol·L-1) | 0.54 | 0 68 68 | 0.68 |
②平衡时,若以甲醇百分含量为纵坐标,以温度为横坐标,此时反应点在图象的位置是图中
您最近一年使用:0次
名校
2 . 在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图所示:
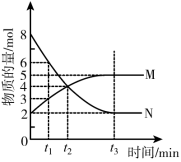
(1)该反应的化学方程式为___________ 。
(2)t2时刻,正逆反应速率大小关系为V正___________ V逆(填“>”、“=”、“<”)
(3)若t2=2min,计算反应开始至t2时刻,M的平均化学反应速率为:___________ 。
(4)t3时刻化学反应达到平衡时反应物的转化率为___________ 。
(5)如果升高温度则V逆___________ (填增大、减小或不变)。

(1)该反应的化学方程式为
(2)t2时刻,正逆反应速率大小关系为V正
(3)若t2=2min,计算反应开始至t2时刻,M的平均化学反应速率为:
(4)t3时刻化学反应达到平衡时反应物的转化率为
(5)如果升高温度则V逆
您最近一年使用:0次
解题方法
3 . 为了更好地利用化学反应中物质和能量的变化,在化学研究和工业生产中还需要关注化学反应的快慢和限度。能量、速率与限度是认识和研究化学反应的重要因素。
Ⅰ.某温度下,在2 L的恒容密闭容器中,A、B、C(均为气体)三种物质的物质的量随时间的变化曲线如图所示。

(1)该反应的化学方程式为___________ 。
(2)能说明此时反应已达到了平衡状态的是___________ (填标号)。
a.A、B、C三种物质的浓度保持不变
b.气体A的消耗速率等于气体C的生成速率
c.混合气体的密度不变
d.总压强不变
Ⅱ.某温度下,向2.0 L的恒容密闭容器中充入2.0 molN2和2.0 molH2,发生反应,一段时间后反应达到平衡状态,实验数据如下表所示:
(3)0~50 s内的平均反应速率v(N2)=___________  。
。
(4)键能指在标准状况下,将1 mol气态分子AB(g)解离为气态原子A(g)、B(g)所需的能量,用符号E表示,单位为 ,已知N≡N键的键能为946 kJ/mol,H-H键的键能为436 kJ/mol,N-H键的键能为391 kJ/mol。则生成1 mol NH3的过程中
,已知N≡N键的键能为946 kJ/mol,H-H键的键能为436 kJ/mol,N-H键的键能为391 kJ/mol。则生成1 mol NH3的过程中___________ (填“吸收”或“放出”)的能量为___________  。
。
(5)为加快反应速率,可采取的措施是___________ (填标号)。
a.升高温度 b.增大容器体积 c.恒容时充入He d.加入合适催化剂
Ⅰ.某温度下,在2 L的恒容密闭容器中,A、B、C(均为气体)三种物质的物质的量随时间的变化曲线如图所示。

(1)该反应的化学方程式为
(2)能说明此时反应已达到了平衡状态的是
a.A、B、C三种物质的浓度保持不变
b.气体A的消耗速率等于气体C的生成速率
c.混合气体的密度不变
d.总压强不变
Ⅱ.某温度下,向2.0 L的恒容密闭容器中充入2.0 molN2和2.0 molH2,发生反应,一段时间后反应达到平衡状态,实验数据如下表所示:
 | 0 | 50 | 150 | 250 | 350 |
| n(NH3)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
 。
。(4)键能指在标准状况下,将1 mol气态分子AB(g)解离为气态原子A(g)、B(g)所需的能量,用符号E表示,单位为
 ,已知N≡N键的键能为946 kJ/mol,H-H键的键能为436 kJ/mol,N-H键的键能为391 kJ/mol。则生成1 mol NH3的过程中
,已知N≡N键的键能为946 kJ/mol,H-H键的键能为436 kJ/mol,N-H键的键能为391 kJ/mol。则生成1 mol NH3的过程中 。
。(5)为加快反应速率,可采取的措施是
a.升高温度 b.增大容器体积 c.恒容时充入He d.加入合适催化剂
您最近一年使用:0次
4 . (1)反应Fe(s)+CO2(g)⇌FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g)⇌FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度时K1、K2的值如下表:
①反应CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH,平衡常数为K,则ΔH=_______ (用ΔH1和ΔH2表示),K=_______ (用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)⇌CO(g)+H2O(g)是_______ 反应(填“吸热”或“放热”)。
②能判断CO2(g)+H2(g)⇌CO(g)+H2O(g)达到化学平衡状态的依据是_______ (填字母)。
A.容器中压强不变 B.混合气体中c(CO)不变 C.v正(H2)=v逆(H2O) D.c(CO)=c(CO2)
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应:Fe(s)+CO2(g)⇌ FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。
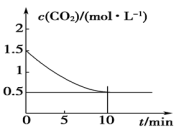
①该条件下反应的平衡常数为___ ;若铁粉足量,CO2的起始浓度为2.0mol·L-1,10分钟达到平衡,则平衡时CO2的浓度为____ mol·L-1,v(CO)为____ 。
②下列措施中能使平衡时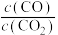 增大的是
增大的是___ (填字母)。
A.升高温度 B.增大压强 C.充入一定量的CO2 D.再加入一定量铁粉
700℃ | 900℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
①反应CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH,平衡常数为K,则ΔH=
②能判断CO2(g)+H2(g)⇌CO(g)+H2O(g)达到化学平衡状态的依据是
A.容器中压强不变 B.混合气体中c(CO)不变 C.v正(H2)=v逆(H2O) D.c(CO)=c(CO2)
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应:Fe(s)+CO2(g)⇌ FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。

①该条件下反应的平衡常数为
②下列措施中能使平衡时
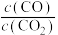 增大的是
增大的是A.升高温度 B.增大压强 C.充入一定量的CO2 D.再加入一定量铁粉
您最近一年使用:0次
名校
解题方法
5 . 某温度时,在2 L的密闭容器中,X、Y、Z(均为气体)的物质的量随时间的变化曲线如图所示。请回答下列问题:

(1)由图中所给数据进行分析,该反应的化学方程式为_______ 。
(2)下列措施能加快反应速率的是_______ (填序号,下同)。
A.恒压时充入He B.恒容时充入He C.恒容时充入X
D.及时分离出Z E.升高温度 F.选择高效的催化剂
(3)能说明该反应已达到平衡状态的是_______ (填字母)。
A.v(X)=v(Y) B.2v正(Y)=v逆(Z) C.容器内压强保持不变
D.容器内混合气体的密度保持不变 E.X、Y、Z的浓度相等
(4)反应从开始至2 min,用X的浓度变化表示的平均反应速率v(X)=_______ 。
(5)将5 mol X与3 mol Y的混合气体通入2 L的密闭容器中并发生上述反应,反应到某时刻各物质的物质的量恰好满足:n(X)=n(Y)=n(Z),则原混合气体X的转化率=_______ 。

(1)由图中所给数据进行分析,该反应的化学方程式为
(2)下列措施能加快反应速率的是
A.恒压时充入He B.恒容时充入He C.恒容时充入X
D.及时分离出Z E.升高温度 F.选择高效的催化剂
(3)能说明该反应已达到平衡状态的是
A.v(X)=v(Y) B.2v正(Y)=v逆(Z) C.容器内压强保持不变
D.容器内混合气体的密度保持不变 E.X、Y、Z的浓度相等
(4)反应从开始至2 min,用X的浓度变化表示的平均反应速率v(X)=
(5)将5 mol X与3 mol Y的混合气体通入2 L的密闭容器中并发生上述反应,反应到某时刻各物质的物质的量恰好满足:n(X)=n(Y)=n(Z),则原混合气体X的转化率=
您最近一年使用:0次
2021-06-19更新
|
1057次组卷
|
6卷引用:黑龙江省哈尔滨宾县第一中学2020-2021学年高一下学期第一次月考化学试题
解题方法
6 . 化学反应速率和限度与生产、生活密切相关。
(1)用纯净的锌粒与稀盐酸反应制取氢气气体,请回答:
①实验过程如图所示,分析判断___________ 段化学反应速率最快。
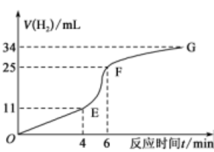
②将锌粒投入盛有稀盐酸的烧杯中,刚开始时产生H2的速率逐渐加快,其原因是___________ 。
(2)某温度时,在2 L恒容容器中X、Y、Z三种物质随时间的变化关系曲线如图所示。
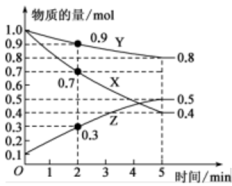
①由图中的数据分析,该反应的化学方程式为:___________ 。
②反应开始至2 min时,Z的平均反应速率为___________ 。
③5 min后Z的生成速率___________ (填“大于”“小于”或“等于”)10 min后Z的生成速率。
(1)用纯净的锌粒与稀盐酸反应制取氢气气体,请回答:
①实验过程如图所示,分析判断

②将锌粒投入盛有稀盐酸的烧杯中,刚开始时产生H2的速率逐渐加快,其原因是
(2)某温度时,在2 L恒容容器中X、Y、Z三种物质随时间的变化关系曲线如图所示。

①由图中的数据分析,该反应的化学方程式为:
②反应开始至2 min时,Z的平均反应速率为
③5 min后Z的生成速率
您最近一年使用:0次
7 . 一定温度下,在10 L密闭容器中加入5 mol SO2和3 mol O2,发生反应:2SO2(g)+O2(g)⇌2SO3(g),10 min时,反应达到平衡状态,此时容器中还含有3 mol SO2。
(1)反应起始时, SO2的浓度为___ ,O2的浓度为___ ,反应生成了___ mol SO3,v(SO2)=___ 。
(2)平衡时SO3的浓度是__ ,SO2的转化率是___ 。
(3)平衡时容器内气体的总物质的量为__ mol。
(4)物质的浓度不再改变标志着该反应已达平衡,下列还可以说明该反应已达平衡的是______ (填序号)。
①体系内压强不再改变
②容器内气体的密度不再改变
③混合气体的平均相对分子质量不再改变
④v正(SO3)=2v逆(O2)
⑤n(SO3)∶n(O2)∶n(SO2)=2∶1∶2
(1)反应起始时, SO2的浓度为
(2)平衡时SO3的浓度是
(3)平衡时容器内气体的总物质的量为
(4)物质的浓度不再改变标志着该反应已达平衡,下列还可以说明该反应已达平衡的是
①体系内压强不再改变
②容器内气体的密度不再改变
③混合气体的平均相对分子质量不再改变
④v正(SO3)=2v逆(O2)
⑤n(SO3)∶n(O2)∶n(SO2)=2∶1∶2
您最近一年使用:0次
8 . 将一定量的二氧化硫和含0.7mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应2SO2+O2 2SO3。反应达到平衡后,将容器中的混合气体通过过量氢氧化钠溶液,气体体积减小了21.28L;再将剩余气体通过一种碱性溶液吸收氧气,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留三位有效数字)请回答下列问题:
2SO3。反应达到平衡后,将容器中的混合气体通过过量氢氧化钠溶液,气体体积减小了21.28L;再将剩余气体通过一种碱性溶液吸收氧气,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留三位有效数字)请回答下列问题:
(1)判断该反应达到平衡状态的标志是______ (填字母)。
a.二氧化硫和三氧化硫浓度相等
b.三氧化硫百分含量保持不变
c.容器中气体的压强不变
d.三氧化硫的生成速率与二氧化硫的消耗速率相等
e.容器中混合气体的密度保持不变
(2)该反应达到平衡时,消耗二氧化硫的物质的量占原二氧化硫的物质的量的百分比为_______ 。
(3)若将平衡混合气体的5%通入过量的氯化钡溶液中,生成沉淀的质量是_______ 。
 2SO3。反应达到平衡后,将容器中的混合气体通过过量氢氧化钠溶液,气体体积减小了21.28L;再将剩余气体通过一种碱性溶液吸收氧气,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留三位有效数字)请回答下列问题:
2SO3。反应达到平衡后,将容器中的混合气体通过过量氢氧化钠溶液,气体体积减小了21.28L;再将剩余气体通过一种碱性溶液吸收氧气,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留三位有效数字)请回答下列问题:(1)判断该反应达到平衡状态的标志是
a.二氧化硫和三氧化硫浓度相等
b.三氧化硫百分含量保持不变
c.容器中气体的压强不变
d.三氧化硫的生成速率与二氧化硫的消耗速率相等
e.容器中混合气体的密度保持不变
(2)该反应达到平衡时,消耗二氧化硫的物质的量占原二氧化硫的物质的量的百分比为
(3)若将平衡混合气体的5%通入过量的氯化钡溶液中,生成沉淀的质量是
您最近一年使用:0次
2021-03-03更新
|
486次组卷
|
10卷引用:第五章 化工生产中的重要非金属元素(培优提升卷)-2020-2021学年高一化学必修第二册章末集训必刷卷(新教材人教版)
(已下线)第五章 化工生产中的重要非金属元素(培优提升卷)-2020-2021学年高一化学必修第二册章末集训必刷卷(新教材人教版)河北省张家口市宣化第一中学2020-2021学年高一下学期期中考试化学试题【全国百强校】黑龙江省大庆实验中学2017-2018学年高一下学期期末考试化学试题人教版高中化学必修2第二章《化学反应与能量》测试卷3人教版高中化学必修二第二单元《化学反应与能量》测试卷2019-2020人教版高中化学必修2第二章《化学反应与能量》测试卷人教版本必修二高中化学第二章《化学反应与能量》测试卷苏教版高中化学必修2专题二《化学反应与能量转化》测试卷2019-2020学年鲁科版高中化学必修2第二章《化学键 化学反应与能量》测试卷湖北省武汉市外国语学校2019-2020学年高一下学期期中考试化学试题
解题方法
9 . 一定条件下,用 CO2和 H2反应生产燃料甲醇的热化学方程式为 CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) △H,图1表示该反应过程中能量(单位为kJ·mol-1)的变化。回答下列问题:
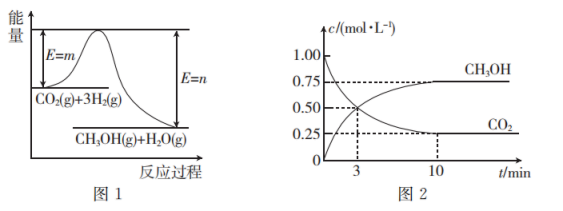
(1)该反应的 △H______ 0(填“>”或“<”),原因是______ 。
(2)在恒温恒容密闭容器中,下列能说明该反应已经达到平衡状态的是______ (填标号)。
A.v( H2)=3v(CO2)
B.容器内气体压强保持不变
C.v逆(CO2)= v正(CH3OH)
D.容器内气体密度保持不变
(3)在体积为1L的恒温(温度为 T℃)恒容密闭容器中,充入1 mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间的变化如图 2 所示。从反应开始到平衡,用氢气的浓度变化表示的平均反应速率v(H2)=______ 平衡时容器内气体压强与起始时容器内气体压强之比为______ ,T℃时该反应的平衡常数K=______ L²·mol-2(保留 2 位小数)。

(1)该反应的 △H
(2)在恒温恒容密闭容器中,下列能说明该反应已经达到平衡状态的是
A.v( H2)=3v(CO2)
B.容器内气体压强保持不变
C.v逆(CO2)= v正(CH3OH)
D.容器内气体密度保持不变
(3)在体积为1L的恒温(温度为 T℃)恒容密闭容器中,充入1 mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间的变化如图 2 所示。从反应开始到平衡,用氢气的浓度变化表示的平均反应速率v(H2)=
您最近一年使用:0次
10 . 某温度下在4 L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。

(1)该反应的化学方程式是___ 。
(2)该反应达到平衡状态的标志是___ (填代号)。
A.Y的体积分数在混合气体中保持不变
B.X、Y的反应速率比为3∶1
C.容器内气体压强保持不变
D.容器内气体的总质量保持不变
(3)达到平衡时Y的转化率为___ 。

(1)该反应的化学方程式是
(2)该反应达到平衡状态的标志是
A.Y的体积分数在混合气体中保持不变
B.X、Y的反应速率比为3∶1
C.容器内气体压强保持不变
D.容器内气体的总质量保持不变
(3)达到平衡时Y的转化率为
您最近一年使用:0次



