解题方法
1 . 苯甲酸乙酯可用于配制香水、香精和人造精油,也大量用于食品中,实验室制备苯甲酸乙酯的原理为: .分水器可以储存冷凝管冷凝的液体,当液面达到支管口时上层液体可回流到反应器中,通过下端活塞可以将密度较大的下层液体排放出去。
.分水器可以储存冷凝管冷凝的液体,当液面达到支管口时上层液体可回流到反应器中,通过下端活塞可以将密度较大的下层液体排放出去。
 .“环己烷—乙醇—水”会形成共沸物(沸点
.“环己烷—乙醇—水”会形成共沸物(沸点 ),一些有机物的物理性质如表所示:
),一些有机物的物理性质如表所示:
实验装置如图所示(加热及夹持装置已省略),实验步骤如下:
②控制温度在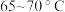 加热回流2h,期间不时打开旋塞放出分水器中液体;
加热回流2h,期间不时打开旋塞放出分水器中液体;
③反应结束后,将X内反应液依次用水、饱和 溶液、水洗涤。用分液漏斗分离出有机层,水层经碳酸氢钠处理后用适量乙醚萃取分液,然后合并至有机层;
溶液、水洗涤。用分液漏斗分离出有机层,水层经碳酸氢钠处理后用适量乙醚萃取分液,然后合并至有机层;
④向③中所得有机层中加入氯化钙,蒸馏,接收 的馏分,得到产品12.00mL。
的馏分,得到产品12.00mL。
请回答下列问题:
(1)仪器X的名称为___________ 。
(2)冷凝管的进水口为___________ (填“a”或“b”)。
(3)“加热回流”时,装置宜采用的加热方法是___________ ,判断反应完成的实验现象为___________ 。
(4)使用分水器能提高酯的产率,原因是___________ (用平衡移动的原理解释)。
(5)若步骤③加入的饱和 溶液不足,在之后蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是
溶液不足,在之后蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是___________ 。
(6)本实验得到的苯甲酸乙酯的产率为___________ (结果保留3位有效数字)。
 +C2H5OH
+C2H5OH
 +H2O
+H2O
 .分水器可以储存冷凝管冷凝的液体,当液面达到支管口时上层液体可回流到反应器中,通过下端活塞可以将密度较大的下层液体排放出去。
.分水器可以储存冷凝管冷凝的液体,当液面达到支管口时上层液体可回流到反应器中,通过下端活塞可以将密度较大的下层液体排放出去。 .“环己烷—乙醇—水”会形成共沸物(沸点
.“环己烷—乙醇—水”会形成共沸物(沸点 ),一些有机物的物理性质如表所示:
),一些有机物的物理性质如表所示:| 物质 | 颜色、状态 | 沸点( ) ) | 密度( ) ) | 溶解性 |
| 苯甲酸 | 无色晶体 | 249( 升华) 升华) | 1.27 | 微溶于水,易溶于乙醇、乙醚等有机溶剂 |
| 苯甲酸乙酯 | 无色液体 | 212.6 | 1.05 | 微溶于热水,与乙醇、乙醚混溶 |
| 乙醇 | 无色液体 | 78.3 | 0.79 | 与水互溶 |
| 环己烷 | 无色液体 | 80.8 | 0.73 | 不溶于水 |

②控制温度在
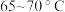 加热回流2h,期间不时打开旋塞放出分水器中液体;
加热回流2h,期间不时打开旋塞放出分水器中液体;③反应结束后,将X内反应液依次用水、饱和
 溶液、水洗涤。用分液漏斗分离出有机层,水层经碳酸氢钠处理后用适量乙醚萃取分液,然后合并至有机层;
溶液、水洗涤。用分液漏斗分离出有机层,水层经碳酸氢钠处理后用适量乙醚萃取分液,然后合并至有机层;④向③中所得有机层中加入氯化钙,蒸馏,接收
 的馏分,得到产品12.00mL。
的馏分,得到产品12.00mL。请回答下列问题:
(1)仪器X的名称为
(2)冷凝管的进水口为
(3)“加热回流”时,装置宜采用的加热方法是
(4)使用分水器能提高酯的产率,原因是
(5)若步骤③加入的饱和
 溶液不足,在之后蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是
溶液不足,在之后蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是(6)本实验得到的苯甲酸乙酯的产率为
您最近一年使用:0次
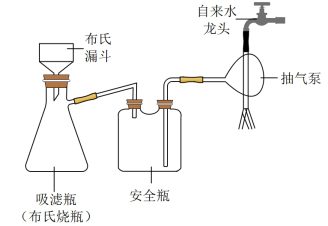
2 . 碘化亚铜(CuI)是重要的有机催化剂。某学习小组用如图装置制备CuI,并设计实验探究其性质。已知:碘化亚铜(CuI)是白色固体,难溶于水,易与KI形成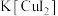 ,实验装置如图所示。
,实验装置如图所示。
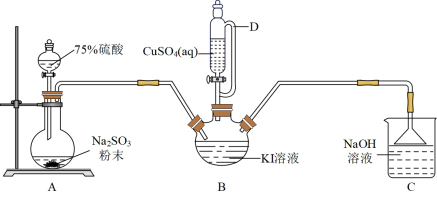
(1)仪器D的名称是___________ 。
(2)实验完毕后,用如图所示装置分离CuI的突出优点是___________ 。
(3)装置B中发生反应的离子方程式是___________ 。
(4)小组同学设计下表方案对CuI的性质进行探究:
①在实验I中“加水,又生成白色沉淀”的原理是___________ 。
②根据实验Ⅱ,CuI与NaOH溶液反应的化学方程式是___________ 。
(5)测定CuI样品纯度:取agCuI样品与适量NaOH溶液充分反应后,过滤;在滤液中加入足量的酸化的双氧水,滴几滴淀粉溶液,用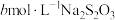 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液体积为VmL[已知:滴定反应为
溶液体积为VmL[已知:滴定反应为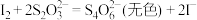 ]。该样品纯度为
]。该样品纯度为___________ (用含a、b、V的代数式表示)。如果其他操作均正确,仅滴定前盛标准液的滴定管用蒸馏水洗净后没有用标准液润洗,测得结果___________ (填“偏高”“偏低”或“无影响”)。
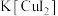 ,实验装置如图所示。
,实验装置如图所示。
(1)仪器D的名称是
(2)实验完毕后,用如图所示装置分离CuI的突出优点是

(3)装置B中发生反应的离子方程式是
(4)小组同学设计下表方案对CuI的性质进行探究:
| 实验 | 实验操作及现象 |
| I | 取少量CuI放入试管中,加入KI溶液,白色固体溶解得到无色溶液;加水,又生成白色沉淀 |
| Ⅱ | 取少量CuI放入试管中,加入NaOH溶液,振荡,产生砖红色沉淀。过滤,向所得上层清液中滴加淀粉溶液,无明显变化;将砖红色沉淀溶于稀硫酸,产生红色固体和蓝色溶液 |
②根据实验Ⅱ,CuI与NaOH溶液反应的化学方程式是
(5)测定CuI样品纯度:取agCuI样品与适量NaOH溶液充分反应后,过滤;在滤液中加入足量的酸化的双氧水,滴几滴淀粉溶液,用
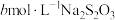 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液体积为VmL[已知:滴定反应为
溶液体积为VmL[已知:滴定反应为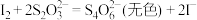 ]。该样品纯度为
]。该样品纯度为
您最近一年使用:0次
名校
3 . 某化学兴趣小组用氧化铜制备配位化合物[Cu(NH3)x]SO4·H2O(亮蓝色),并测定该配合物的配位数。
制备[Cu(NH3)x]SO4·H2O的过程:
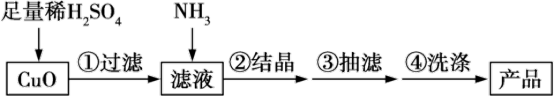
已知:2CuSO4+2NH3·H2O=(NH4)2SO4+Cu2(OH)2SO4↓(蓝色)
Cu2(OH)2SO4+2xNH3 2[Cu(NH3)x]2++SO
2[Cu(NH3)x]2++SO +2OH−
+2OH−
回答下列问题:
(1)为加快氧化铜的溶解速率,可采用的方法是___________ (回答两种)。
(2)所用的氨气可采用下列装置中的___________ (填字母)制备,相应的制备原理为___________ (写化学方程式)。
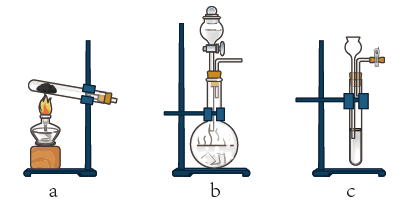
(3)当出现___________ 现象时,停止通入氨气。
(4)在步骤②中,倒入95%酒精,静置一段时间,出现大量蓝色晶体,在步骤④中,加入浓氨水洗涤沉淀的目的是___________ 。
制备[Cu(NH3)x]SO4·H2O的过程:

已知:2CuSO4+2NH3·H2O=(NH4)2SO4+Cu2(OH)2SO4↓(蓝色)
Cu2(OH)2SO4+2xNH3
 2[Cu(NH3)x]2++SO
2[Cu(NH3)x]2++SO +2OH−
+2OH−回答下列问题:
(1)为加快氧化铜的溶解速率,可采用的方法是
(2)所用的氨气可采用下列装置中的

(3)当出现
(4)在步骤②中,倒入95%酒精,静置一段时间,出现大量蓝色晶体,在步骤④中,加入浓氨水洗涤沉淀的目的是
您最近一年使用:0次
解题方法
4 . 下列实验目的、实验操作及现象、结论均正确的是
| 选项 | 实验目的 | 实验操作及现象 | 结论 |
| A | 判断强酸和弱酸 |  溶液显碱性, 溶液显碱性, 溶液显酸性 溶液显酸性 | 可以确定 是弱酸,无法判断 是弱酸,无法判断 是否为弱酸 是否为弱酸 |
| B | 判断反应物的浓度对平衡的影响 | 向 溶液中加入 溶液中加入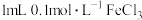 溶液,达到平衡,再加入 溶液,达到平衡,再加入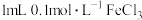 溶液,溶液红色加深 溶液,溶液红色加深 | 说明增大反应物浓度,化学平衡正向移动 |
| C | 验证 的氧化性 的氧化性 | 向黄绿色的氯水中加入 溶液,溶液黄绿色褪去 溶液,溶液黄绿色褪去 |  有强氧化性 有强氧化性 |
| D | 验证菠菜中含有铁元素 | 将新鲜菠菜剪碎、研磨、溶解、过滤,向滤液中加入几滴KSCN溶液,溶液不变红 | 说明菠菜中不含铁元素 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
5 . 下列实验目的、实验操作及现象、结论都正确的是
| 选项 | 实验目的 | 实验操作及现象 | 结论 |
| A | 判断强酸和弱酸 | NaHCO3溶液显碱性,NaHSO3溶液显酸性 | 可以确定H2CO3是弱酸,无法判断H2SO3是否为弱酸 |
| B | 改变反应物的浓度对平衡的影响 | 向5mL0.1mol/L,KSCN溶液中加入1mL0.1mol/LFeCl3溶液,达到平衡,然后再加入1mL0.1mol/LFeCl3,溶液红色加深 | 说明增加反应物浓度,化学平衡正向移动 |
| C | 比较Ksp(AgCl)和Ksp(AgI)的大小 | 取2mL0.1mol/LAgNO3溶液于试管中,加入1mL0.1mol/LNaCl溶液,再加入1mL0.1mol/LKI溶液,产生黄色沉淀 | 说明:Ksp(AgCl)>Ksp(AgI) |
| D | 验证菠菜中含有铁元素 | 将新鲜菠菜剪碎、研磨、溶解、过滤,向滤液中加入几滴KSCN溶液,溶液不变红 | 说明菠菜中不含铁元素 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-03-20更新
|
366次组卷
|
2卷引用:湖南省长沙市雅礼中学2022-2023学年高三下学期月考试卷(七)化学试题
解题方法
6 . 根据实验目的,下列实验及现象、结论都正确的是
选项 | 实验目的 | 实验及现象 | 结论 |
A | 比较 和 和 的水解常数 的水解常数 | 分别测浓度均为0.1  的 的 和 和 溶液的pH,后者大于前者 溶液的pH,后者大于前者 |  |
B | 探究氢离子浓度对 、 、 相互转化的影响 相互转化的影响 | 向 溶液中缓慢滴加硫酸,黄色变为橙红色 溶液中缓慢滴加硫酸,黄色变为橙红色 | 增大氢离子浓度,转化平衡向生成 的方向移动 的方向移动 |
C | 检验乙醇中是否含有水 | 向乙醇中加入一小粒金属钠,产生无色气体 | 乙醇中含有水 |
D | 检验某有机物中是否存在醛基 | 向3 mL 5%的 溶液滴加3~4滴2% 溶液滴加3~4滴2%  溶液,然后滴加0.5 mL 4%某有机物,加热至沸腾,未观察到红色沉淀 溶液,然后滴加0.5 mL 4%某有机物,加热至沸腾,未观察到红色沉淀 | 该溶液不含醛基 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
7 . 氯及其化合物应用广泛。氯的单质Cl2可由MnO2与浓盐酸共热得到,Cl2能氧化Br-,可从海水中提取Br2;氯的氧化物ClO2可用于自来水消毒,ClO2是一种黄绿色气体,易溶于水,与碱反应会生成ClO 与ClO
与ClO ;亚氯酸钠(NaClO2)是一种高效漂白剂和氧化剂。实验室欲由下列装置制取高浓度的HClO溶液,有关实验装置和原理能达到各自实验目的的是
;亚氯酸钠(NaClO2)是一种高效漂白剂和氧化剂。实验室欲由下列装置制取高浓度的HClO溶液,有关实验装置和原理能达到各自实验目的的是
 与ClO
与ClO ;亚氯酸钠(NaClO2)是一种高效漂白剂和氧化剂。实验室欲由下列装置制取高浓度的HClO溶液,有关实验装置和原理能达到各自实验目的的是
;亚氯酸钠(NaClO2)是一种高效漂白剂和氧化剂。实验室欲由下列装置制取高浓度的HClO溶液,有关实验装置和原理能达到各自实验目的的是A.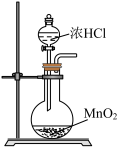 制取氯气 制取氯气 | B. 制取氯水 制取氯水 |
C. 提高HClO浓度 提高HClO浓度 | D. 分离HClO 分离HClO |
您最近一年使用:0次
8 . 下列由氯气制取高浓度 溶液的实验原理和装置能达到实验目的的是
溶液的实验原理和装置能达到实验目的的是

 溶液的实验原理和装置能达到实验目的的是
溶液的实验原理和装置能达到实验目的的是
| A.用装置甲制取氯气 | B.用装置乙制取氯水 |
C.用装置丙提高 浓度 浓度 | D.用装置丁分离出 溶液 溶液 |
您最近一年使用:0次
名校
解题方法
9 . 某化学兴趣小组探究 和
和 的化学性质。
的化学性质。
Ⅰ.实验准备:饱和氯水的制备
(1)图中仪器A的名称为___________ 。___________ 。
(3)实验室最适合用于处理多余氯气的是___________ (填字母)。
A. 溶液 B.
溶液 B. 溶液 C.
溶液 C. 溶液
溶液
Ⅱ.实验探究
①取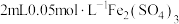 溶液于试管中,滴加3滴
溶液于试管中,滴加3滴 溶液,溶液变红色;
溶液,溶液变红色;
②取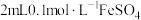 溶液于试管中,先滴加3滴
溶液于试管中,先滴加3滴 溶液,振荡,溶液无现象,再滴加3滴饱和氯水,溶液变黄色。
溶液,振荡,溶液无现象,再滴加3滴饱和氯水,溶液变黄色。
【发现问题】小组成员针对实验②中溶液未变红色,而呈现黄色的现象展开了探究。
【查阅文献】
i. 能将
能将 氧化成
氧化成 ,硫氰
,硫氰 常温下为黄色液体,易挥发,可与水发生反应:
常温下为黄色液体,易挥发,可与水发生反应: ;
;
ii.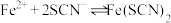 ,
,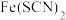 为无色配合物。
为无色配合物。
【提出猜想】猜想一 被氯水氧化成
被氯水氧化成 ,使溶液呈黄色;
,使溶液呈黄色;
猜想二 加入氯水后部分 被氧化为
被氧化为 ,
,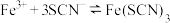 (红色),但由于存在反应:
(红色),但由于存在反应: ,实验②生成的
,实验②生成的 浓度比实验①的小,
浓度比实验①的小, 溶液在浓度较低时呈黄色。
溶液在浓度较低时呈黄色。
【验证猜想】
(4)为验证猜想,小组成员设计了以下实验,请补充表格中的操作及现象
【提出质疑】
(5)甲同学提出,实验④并不能证明猜想一正确,理由是___________ 。
【再次探究】
(6)小组成员进行进一步探究,请完成表格中的实验操作及现象
【得出结论】
(7)由实验结论可以判断:本实验条件下还原性强弱:
___________  (填“强于”“弱于”或“等于”)。
(填“强于”“弱于”或“等于”)。
 和
和 的化学性质。
的化学性质。Ⅰ.实验准备:饱和氯水的制备
(1)图中仪器A的名称为
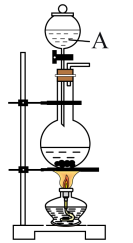
(3)实验室最适合用于处理多余氯气的是
A.
 溶液 B.
溶液 B. 溶液 C.
溶液 C. 溶液
溶液Ⅱ.实验探究
①取
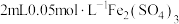 溶液于试管中,滴加3滴
溶液于试管中,滴加3滴 溶液,溶液变红色;
溶液,溶液变红色;②取
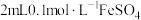 溶液于试管中,先滴加3滴
溶液于试管中,先滴加3滴 溶液,振荡,溶液无现象,再滴加3滴饱和氯水,溶液变黄色。
溶液,振荡,溶液无现象,再滴加3滴饱和氯水,溶液变黄色。【发现问题】小组成员针对实验②中溶液未变红色,而呈现黄色的现象展开了探究。
【查阅文献】
i.
 能将
能将 氧化成
氧化成 ,硫氰
,硫氰 常温下为黄色液体,易挥发,可与水发生反应:
常温下为黄色液体,易挥发,可与水发生反应: ;
;ii.
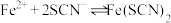 ,
,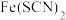 为无色配合物。
为无色配合物。【提出猜想】猜想一
 被氯水氧化成
被氯水氧化成 ,使溶液呈黄色;
,使溶液呈黄色;猜想二 加入氯水后部分
 被氧化为
被氧化为 ,
,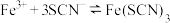 (红色),但由于存在反应:
(红色),但由于存在反应: ,实验②生成的
,实验②生成的 浓度比实验①的小,
浓度比实验①的小, 溶液在浓度较低时呈黄色。
溶液在浓度较低时呈黄色。【验证猜想】
(4)为验证猜想,小组成员设计了以下实验,请补充表格中的操作及现象
| 实验序号 | 实验操作 | 现象 | 实验结论 |
| ③ | 取少量实验①的溶液于试管中, | 猜想二正确 | |
| ④ | 取少量实验②的溶液于试管中,滴加3滴饱和 溶液 溶液 | 溶液变浑浊 | 猜想一也正确 |
【提出质疑】
(5)甲同学提出,实验④并不能证明猜想一正确,理由是
【再次探究】
(6)小组成员进行进一步探究,请完成表格中的实验操作及现象
| 实验序号 | 实验操作 | 现象 |
| ⑤ | 滴加3滴蒸馏水 | 无明显现象 | |
| ⑥ | 无明显现象 | ||
| ⑦ | 滴加3滴饱和氯水 | 溶液变橙红色 | |
| ⑧ | 滴加3滴 溶液 溶液 | ||
| 得出结论 | i.由实验⑥的现象可以判断:猜想一不正确, ii.结合实验⑤⑦⑧的现象可以判断:猜想二正确。 | ||
【得出结论】
(7)由实验结论可以判断:本实验条件下还原性强弱:

 (填“强于”“弱于”或“等于”)。
(填“强于”“弱于”或“等于”)。
您最近一年使用:0次
2024-01-22更新
|
492次组卷
|
3卷引用:广东省深圳市龙岗区2023-2024学年高三上学期1月期末考试化学试题
广东省深圳市龙岗区2023-2024学年高三上学期1月期末考试化学试题(已下线)大题02 化学实验综合题(分类过关)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)广东省东莞市东华高级中学 东华松山湖高级中学 2024届高三下学期第三次模拟考试 化学试题
名校
解题方法
10 . 乙酰苯胺是一种无色有闪光的小叶状固体或白色晶性粉末,是磺胺类药物的原料,可用作止痛剂、退热剂、防腐剂。乙酰苯胺的一种制备原理为:
实验步骤:
【步骤1】如图所示,在圆底烧瓶中加入无水苯胺 、冰醋酸
、冰醋酸 、锌粉
、锌粉 ,安装仪器,加入沸石,调节加热温度,使温度计温度控制在
,安装仪器,加入沸石,调节加热温度,使温度计温度控制在 左右,反应约
左右,反应约 ,当反应基本完成时,停止加热。
,当反应基本完成时,停止加热。 水,搅拌加热至沸腾,使粗品完全溶解。
水,搅拌加热至沸腾,使粗品完全溶解。
【步骤3】稍冷后,加入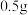 活性炭,并煮沸
活性炭,并煮沸 ,趁热抽滤除去活性炭。
,趁热抽滤除去活性炭。
【步骤4】将滤液倒入烧杯中,自然冷却,析出晶体。抽滤、洗涤、干燥得产品,称其质量。
回答下列问题:
(1)仪器a的名称_____ 。
(2)【步骤1】加热可用_____ (填“水浴”或“油浴”)。
(3)制备过程中加入锌粉的作用为_____ 。
(4)从化学平衡的角度分析,使用刺形分馏柱并控制分馏柱上端的温度在 左右的原因:
左右的原因:_____ 。
(5)乙酰苯胺粗品因含杂质而显色,【步骤3】中加入活性炭吸附有色杂质,加入活性炭需要待沸腾的溶液稍冷却后再加入,其目的是_____ 。
(6)该实验最终得到纯品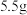 ,则乙酰苯胺的产率为
,则乙酰苯胺的产率为_____ (保留一位小数)。
(7)乙酰苯胺可以在 热溶液中发生水解,写出其反应方程式:
热溶液中发生水解,写出其反应方程式:_____ 。
(8)当制备少量乙酰苯胺时,常用图所示的微型仪器组装成实验装置制备。当观察到_____ 现象时,反应基本结束。
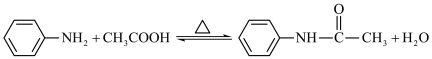
| 名称 | 相对分子质量 | 性状 | 密度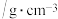 | 沸点/℃ | 溶解度 | 备注 |
| 苯胺 | 93 | 无色油状液体 | 1.02 | 184.4 | 微溶于水,易溶于乙醇、乙醚 | 易被氧化 |
| 乙酸 | 60 | 无色液体 | 1.05 | 118.1 | 易溶于水,易溶于乙醇、乙醚 | |
| 乙酰苯胺 | 135 | 白色晶体 | 1.22 | 304 | 微溶于冷水,溶于热水,易溶于乙醇、乙醚 |
【步骤1】如图所示,在圆底烧瓶中加入无水苯胺
 、冰醋酸
、冰醋酸 、锌粉
、锌粉 ,安装仪器,加入沸石,调节加热温度,使温度计温度控制在
,安装仪器,加入沸石,调节加热温度,使温度计温度控制在 左右,反应约
左右,反应约 ,当反应基本完成时,停止加热。
,当反应基本完成时,停止加热。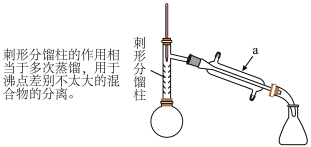
 水,搅拌加热至沸腾,使粗品完全溶解。
水,搅拌加热至沸腾,使粗品完全溶解。【步骤3】稍冷后,加入
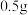 活性炭,并煮沸
活性炭,并煮沸 ,趁热抽滤除去活性炭。
,趁热抽滤除去活性炭。【步骤4】将滤液倒入烧杯中,自然冷却,析出晶体。抽滤、洗涤、干燥得产品,称其质量。
回答下列问题:
(1)仪器a的名称
(2)【步骤1】加热可用
(3)制备过程中加入锌粉的作用为
(4)从化学平衡的角度分析,使用刺形分馏柱并控制分馏柱上端的温度在
 左右的原因:
左右的原因:(5)乙酰苯胺粗品因含杂质而显色,【步骤3】中加入活性炭吸附有色杂质,加入活性炭需要待沸腾的溶液稍冷却后再加入,其目的是
(6)该实验最终得到纯品
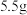 ,则乙酰苯胺的产率为
,则乙酰苯胺的产率为(7)乙酰苯胺可以在
 热溶液中发生水解,写出其反应方程式:
热溶液中发生水解,写出其反应方程式:(8)当制备少量乙酰苯胺时,常用图所示的微型仪器组装成实验装置制备。当观察到

您最近一年使用:0次




