苯甲酸乙酯可用于配制香水、香精和人造精油,也大量用于食品中,实验室制备苯甲酸乙酯的原理为: .分水器可以储存冷凝管冷凝的液体,当液面达到支管口时上层液体可回流到反应器中,通过下端活塞可以将密度较大的下层液体排放出去。
.分水器可以储存冷凝管冷凝的液体,当液面达到支管口时上层液体可回流到反应器中,通过下端活塞可以将密度较大的下层液体排放出去。
 .“环己烷—乙醇—水”会形成共沸物(沸点
.“环己烷—乙醇—水”会形成共沸物(沸点 ),一些有机物的物理性质如表所示:
),一些有机物的物理性质如表所示:
实验装置如图所示(加热及夹持装置已省略),实验步骤如下:
②控制温度在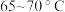 加热回流2h,期间不时打开旋塞放出分水器中液体;
加热回流2h,期间不时打开旋塞放出分水器中液体;
③反应结束后,将X内反应液依次用水、饱和 溶液、水洗涤。用分液漏斗分离出有机层,水层经碳酸氢钠处理后用适量乙醚萃取分液,然后合并至有机层;
溶液、水洗涤。用分液漏斗分离出有机层,水层经碳酸氢钠处理后用适量乙醚萃取分液,然后合并至有机层;
④向③中所得有机层中加入氯化钙,蒸馏,接收 的馏分,得到产品12.00mL。
的馏分,得到产品12.00mL。
请回答下列问题:
(1)仪器X的名称为___________ 。
(2)冷凝管的进水口为___________ (填“a”或“b”)。
(3)“加热回流”时,装置宜采用的加热方法是___________ ,判断反应完成的实验现象为___________ 。
(4)使用分水器能提高酯的产率,原因是___________ (用平衡移动的原理解释)。
(5)若步骤③加入的饱和 溶液不足,在之后蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是
溶液不足,在之后蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是___________ 。
(6)本实验得到的苯甲酸乙酯的产率为___________ (结果保留3位有效数字)。
 +C2H5OH
+C2H5OH
 +H2O
+H2O
 .分水器可以储存冷凝管冷凝的液体,当液面达到支管口时上层液体可回流到反应器中,通过下端活塞可以将密度较大的下层液体排放出去。
.分水器可以储存冷凝管冷凝的液体,当液面达到支管口时上层液体可回流到反应器中,通过下端活塞可以将密度较大的下层液体排放出去。 .“环己烷—乙醇—水”会形成共沸物(沸点
.“环己烷—乙醇—水”会形成共沸物(沸点 ),一些有机物的物理性质如表所示:
),一些有机物的物理性质如表所示:| 物质 | 颜色、状态 | 沸点( ) ) | 密度( ) ) | 溶解性 |
| 苯甲酸 | 无色晶体 | 249( 升华) 升华) | 1.27 | 微溶于水,易溶于乙醇、乙醚等有机溶剂 |
| 苯甲酸乙酯 | 无色液体 | 212.6 | 1.05 | 微溶于热水,与乙醇、乙醚混溶 |
| 乙醇 | 无色液体 | 78.3 | 0.79 | 与水互溶 |
| 环己烷 | 无色液体 | 80.8 | 0.73 | 不溶于水 |

②控制温度在
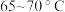 加热回流2h,期间不时打开旋塞放出分水器中液体;
加热回流2h,期间不时打开旋塞放出分水器中液体;③反应结束后,将X内反应液依次用水、饱和
 溶液、水洗涤。用分液漏斗分离出有机层,水层经碳酸氢钠处理后用适量乙醚萃取分液,然后合并至有机层;
溶液、水洗涤。用分液漏斗分离出有机层,水层经碳酸氢钠处理后用适量乙醚萃取分液,然后合并至有机层;④向③中所得有机层中加入氯化钙,蒸馏,接收
 的馏分,得到产品12.00mL。
的馏分,得到产品12.00mL。请回答下列问题:
(1)仪器X的名称为
(2)冷凝管的进水口为
(3)“加热回流”时,装置宜采用的加热方法是
(4)使用分水器能提高酯的产率,原因是
(5)若步骤③加入的饱和
 溶液不足,在之后蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是
溶液不足,在之后蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是(6)本实验得到的苯甲酸乙酯的产率为
更新时间:2024-05-12 17:34:56
|
相似题推荐
【推荐1】工业制硫酸过程中,SO2的催化氧化是主要反应之一。为了研究外界条件对该反应的影响,将0.050mol SO2(g)和0.030mol O2(g)放入容积为1L的密闭容器中,反应:2SO2(g)+O2(g)⇌2SO3(g) ∆H<0,在一定条件下达到平衡,测得c(SO3)=0.040mol/L。
(1)判断该反应达到平衡状态的标志是_______ (填字母)
A.SO2和SO3浓度相等 B.SO2百分含量保持不变
C.容器中气体的压强不变 D.SO3的生成速率与SO2的消耗速率相等
E.容器中混合气体的密度保持不变
(2)当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化率的有_______ (填字母)
A.升高温度 B.降低温度 C.增大压强 D.减小压强 E.加入催化剂 G.移出氧气
(3)计算该条件下反应的平衡常数K=_______ ;SO2的平衡转化率为_______ 。
(4)SO2尾气用饱和Na2SO3溶液吸收可得到更要的化工原料,反应的化学方程式为_______ 。
(1)判断该反应达到平衡状态的标志是
A.SO2和SO3浓度相等 B.SO2百分含量保持不变
C.容器中气体的压强不变 D.SO3的生成速率与SO2的消耗速率相等
E.容器中混合气体的密度保持不变
(2)当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化率的有
A.升高温度 B.降低温度 C.增大压强 D.减小压强 E.加入催化剂 G.移出氧气
(3)计算该条件下反应的平衡常数K=
(4)SO2尾气用饱和Na2SO3溶液吸收可得到更要的化工原料,反应的化学方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
① CO(g)+2H2(g)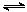 CH3OH(g) △H 1=-90.7 kJ·mol-1
CH3OH(g) △H 1=-90.7 kJ·mol-1
② 2CH3OH(g)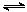 CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1
③ CO(g)+H2O(g)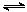 CO2(g)+H2(g) △H 3=-41.2kJ·mol-1
CO2(g)+H2(g) △H 3=-41.2kJ·mol-1
回答下列问题:
(1)则反应3H2(g)+3CO(g)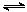 CH3OCH3(g)+CO2(g)的△H=
CH3OCH3(g)+CO2(g)的△H=___ kJ·mol-1。
(2)下列措施中,能提高CH3OCH3产率的有___ 。
A.使用过量的CO B.升高温度 C.增大压强
(3)以下说法能说明反应3H2(g)+3CO(g)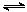 CH3OCH3(g)+CO2(g) 达到平衡状态的有
CH3OCH3(g)+CO2(g) 达到平衡状态的有______ 。
A.H2和CO2的浓度之比为3:1
B.单位时间内断裂3个H-H同时断裂1个C=O
C.恒温恒容条件下,气体的密度保持不变
D.恒温恒压条件下,气体的平均摩尔质量保持不变
E.绝热体系中,体系的温度保持不变
(4)一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应: C(s)+CO2(g)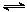 2CO(g).平衡时,体系中气体体积分数与温度的关系如图所示:
2CO(g).平衡时,体系中气体体积分数与温度的关系如图所示:
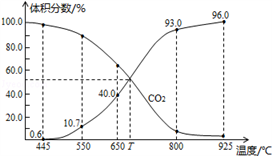
已知:气体分压(P分)=气体总压(P总)×体积分数。
①该反应H_____ 0(填“>”、“<”或“=”),550℃时,平衡后若充入惰性气体,平衡_____ (填“正移”、“逆移“或“不移动" )。
②)650℃时,反应达平衡后CO2的转化率为_____ (保留2位有效数字)。
③T℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=_____ P总.
① CO(g)+2H2(g)
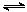 CH3OH(g) △H 1=-90.7 kJ·mol-1
CH3OH(g) △H 1=-90.7 kJ·mol-1② 2CH3OH(g)
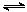 CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1③ CO(g)+H2O(g)
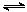 CO2(g)+H2(g) △H 3=-41.2kJ·mol-1
CO2(g)+H2(g) △H 3=-41.2kJ·mol-1回答下列问题:
(1)则反应3H2(g)+3CO(g)
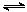 CH3OCH3(g)+CO2(g)的△H=
CH3OCH3(g)+CO2(g)的△H=(2)下列措施中,能提高CH3OCH3产率的有
A.使用过量的CO B.升高温度 C.增大压强
(3)以下说法能说明反应3H2(g)+3CO(g)
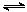 CH3OCH3(g)+CO2(g) 达到平衡状态的有
CH3OCH3(g)+CO2(g) 达到平衡状态的有A.H2和CO2的浓度之比为3:1
B.单位时间内断裂3个H-H同时断裂1个C=O
C.恒温恒容条件下,气体的密度保持不变
D.恒温恒压条件下,气体的平均摩尔质量保持不变
E.绝热体系中,体系的温度保持不变
(4)一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应: C(s)+CO2(g)
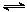 2CO(g).平衡时,体系中气体体积分数与温度的关系如图所示:
2CO(g).平衡时,体系中气体体积分数与温度的关系如图所示:
已知:气体分压(P分)=气体总压(P总)×体积分数。
①该反应H
②)650℃时,反应达平衡后CO2的转化率为
③T℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】氨是化学实验室及化工生产中的重要物质,应用广泛。N2(g)+3H2(g) 2NH3(g) ΔH=-92.2kJ/mol
2NH3(g) ΔH=-92.2kJ/mol
(1)在恒温恒容密闭容器中进行合成氨反应,起始投料时各物质浓度如下表:
①按投料Ⅰ进行反应,测得达到化学平衡状态时H2的转化率为40%,则该温度下合成氨反应的平衡常数表达式为_____________ 。
②按投料Ⅱ进行反应,起始时反应进行的方向为________ (填“正向”或“逆向”)。
③若升高温度,则合成氨反应的化学平衡常数________ (填“变大”、“变小”或“不变”)。
(2)L(L1、L2)、X可分别代表压强或温度。下图表示L一定时,合成氨反应中H2(g)的平衡转化率随X的变化关系。

ⅰ X代表的物理量是______ 。
ⅱ 判断L1、L2的大小关系,并简述理由:______ 。
(3)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下:

① 电极b上发生的是______ 反应(填“氧化”或“还原”)
② 写出电极a的电极反应式:_________ 。
 2NH3(g) ΔH=-92.2kJ/mol
2NH3(g) ΔH=-92.2kJ/mol(1)在恒温恒容密闭容器中进行合成氨反应,起始投料时各物质浓度如下表:
| N2 | H2 | NH3 | |
| 投料Ⅰ | 1.0 mol/L | 3.0 mol /L | 0 |
| 投料Ⅱ | 0.5 mol/L | 1.5 mol/L | 1.0 mol/L |
②按投料Ⅱ进行反应,起始时反应进行的方向为
③若升高温度,则合成氨反应的化学平衡常数
(2)L(L1、L2)、X可分别代表压强或温度。下图表示L一定时,合成氨反应中H2(g)的平衡转化率随X的变化关系。

ⅰ X代表的物理量是
ⅱ 判断L1、L2的大小关系,并简述理由:
(3)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下:

① 电极b上发生的是
② 写出电极a的电极反应式:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】1乙氧基萘是一种无色液体,密度比水的大,不溶于水,易溶于乙醇,熔点为5.5℃,沸点为267℃。1萘酚(性质与苯酚相似)的熔点为96℃,沸点为278℃,微溶于水,易溶于乙醇。乙醇的沸点为78.5℃。1乙氧基萘常用作香料,也可合成其他香料。实验室制备1乙氧基萘的反应原理如下:


(1)将72g1萘酚溶于100mL无水乙醇中,再加入5mL浓硫酸。将混合溶液置于如图所示的圆底烧瓶中加热充分反应。实验中使用过量乙醇的原因是________ 。烧瓶上连接长玻璃管的主要作用是________________ 。
(2)反应结束后将烧瓶中的液体倒入冷水中,经处理得到有机层。为提纯产物有以下四步操作:①蒸馏;②水洗并分液;③用10%的NaOH溶液洗并分液;④用无水氯化钙干燥并过滤。正确的顺序是________ (填序号)。
A.③②④① B.①②③④ C.②①③④
(3)实验测得1乙氧基萘的产量与反应时间、温度的关系如图所示,时间延长、温度升高,1乙氧基萘的产量下降的原因可能是__________ 、____________ 。

(4)某同学推测经提纯的产品可能还含有1萘酚、乙醇、硫酸和水等杂质,设计了如下方案进行检验,请完成表中内容。


(1)将72g1萘酚溶于100mL无水乙醇中,再加入5mL浓硫酸。将混合溶液置于如图所示的圆底烧瓶中加热充分反应。实验中使用过量乙醇的原因是
(2)反应结束后将烧瓶中的液体倒入冷水中,经处理得到有机层。为提纯产物有以下四步操作:①蒸馏;②水洗并分液;③用10%的NaOH溶液洗并分液;④用无水氯化钙干燥并过滤。正确的顺序是
A.③②④① B.①②③④ C.②①③④
(3)实验测得1乙氧基萘的产量与反应时间、温度的关系如图所示,时间延长、温度升高,1乙氧基萘的产量下降的原因可能是

(4)某同学推测经提纯的产品可能还含有1萘酚、乙醇、硫酸和水等杂质,设计了如下方案进行检验,请完成表中内容。
| 实验目的 | 实验操作 | 预期现象和结论 |
| ①用金属钠检验1乙氧基萘是否纯净 | 取少量经提纯的产品于试管A中,加入金属钠 | 若 若 |
| ②检验经提纯的产品是否含有1萘酚 | 若 若 | |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】酯化反应是有机化学中一种重要的反应类型,某化学兴趣小组通过酯化反应,以苯甲酸和甲醇为原料合成苯甲酸甲酯,其原理与实验装置如图(部分夹持装置以及加热装置已省去):
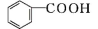 +CH3OH
+CH3OH
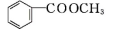 +H2O
+H2O
可能用到的数据如下:
(1)仪器B的名称是_______ 。
(2)实验前仪器B中加入适量的碎瓷片,作用是_______ ,冷水应从仪器C的___ (填“a”或“b”)口进入。
(3)实验开始时,将15 g苯甲酸和过量的甲醇加入仪器B中,通过仪器A加入一定量浓硫酸,浓硫酸的作用为________ ,为了提高酯的产率,可以采取的措施有________ (写两条)。
(4)利用下列步骤提纯产品:①加适量水后分液;②加适量固体Na2CO3分液;③加无水CaCl2干燥;④蒸馏得产品10.9 g。分液过程中,目标产物离开相应仪器的方法是_________________ ,洗涤过程中加入碳酸钠的目的是_________ ,进行蒸馏提纯时,收集____ ℃时的馏分即为苯甲酸甲酯;实验制得的苯甲酸甲酯的质量低于理论产量,可能的原因是________ (填序号)。
a.蒸馏时,从100 ℃开始收集产品
b.苯甲酸实际用量多了
c.制备粗品时苯甲酸甲酯蒸发
(5)本实验的产率是_______ (保留一位小数)。
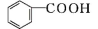 +CH3OH
+CH3OH
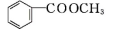 +H2O
+H2O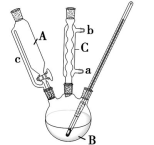
可能用到的数据如下:
| 物质 | 苯甲酸 | 甲醇 | 苯甲酸甲酯 |
| 熔点/℃ | 122.4 | -97 | -12.3 |
| 沸点/℃ | 249 | 64.3 | 199.6 |
| 相对密度/(g·cm-3) | 1.265 9 | 0.792 | 1.088 8 |
| 水溶性 | 微溶 | 互溶 | 不溶 |
(2)实验前仪器B中加入适量的碎瓷片,作用是
(3)实验开始时,将15 g苯甲酸和过量的甲醇加入仪器B中,通过仪器A加入一定量浓硫酸,浓硫酸的作用为
(4)利用下列步骤提纯产品:①加适量水后分液;②加适量固体Na2CO3分液;③加无水CaCl2干燥;④蒸馏得产品10.9 g。分液过程中,目标产物离开相应仪器的方法是
a.蒸馏时,从100 ℃开始收集产品
b.苯甲酸实际用量多了
c.制备粗品时苯甲酸甲酯蒸发
(5)本实验的产率是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】1,2二溴乙烷可作汽油抗爆剂的添加剂,常温下是无色液体,密度是2.18克/厘米3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验中可以用下图所示装置制备1,2二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。请填写下列空白:

(1)烧瓶a中发生的是乙醇的脱水反应,即消去反应,反应温度是170℃,并且该反应要求温度迅速升高到170℃,否则容易产生副反应。请你写出乙醇的这个消去反应方程式:_______ 。
(2)写出制备1,2二溴乙烷的化学方程式:_________________________________ 。
(3)安全瓶b可以以上倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象:_______________________________________ 。
(4)容器c中NaOH溶液的作用是:_________________________________ 。
(5)某学生做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超出许多,如果装置的气密性没有问题,试分析其可能的原因__________ 。
(6)e装置内NaOH溶液的作用是___________________________ 。

(1)烧瓶a中发生的是乙醇的脱水反应,即消去反应,反应温度是170℃,并且该反应要求温度迅速升高到170℃,否则容易产生副反应。请你写出乙醇的这个消去反应方程式:
(2)写出制备1,2二溴乙烷的化学方程式:
(3)安全瓶b可以以上倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象:
(4)容器c中NaOH溶液的作用是:
(5)某学生做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超出许多,如果装置的气密性没有问题,试分析其可能的原因
(6)e装置内NaOH溶液的作用是
您最近一年使用:0次



