1 . 二氧化铈(CeO2)可用作玻璃工业添加剂和有机反应催化剂。以氟碳铈矿(主要含有CeFCO3)为原料制备二氧化铈的一种工艺流程如图:
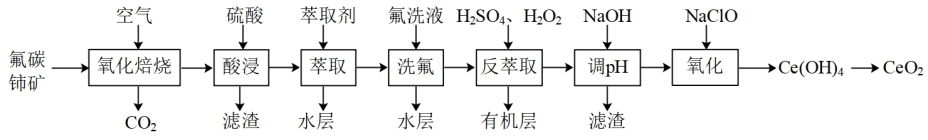
已知:①Ce4+能与F-结合成CeF3+,Al3+也能与F-结合成AlF ;②Ce4+能被萃取剂TBP萃取,而Ce3+不能。回答下列问题:
;②Ce4+能被萃取剂TBP萃取,而Ce3+不能。回答下列问题:
(1)“氧化焙烧”时,为了加快反应速率、提高原料利用率的措施有_______ 。(写一种,合理即可)
(2)“氧化焙烧”后的固体产物中含有CeO2和CeF4,二者物质的量之比为3:1,“酸浸”时发生反应的离子方程式为_______ 。
(3)TBP是一种有机萃取剂,“萃取”时发生反应:CeF3++TBP→CeTBP4++F-,氟洗液中添加Al3+的作用是_______ 。
(4)“反萃取”时加入H2SO4和H2O2的混合液,H2O2的作用为_______ 。
(5)“反萃取”后的水层溶液中c(Ce3+)=1mol·L-1,c(Al3+)=0.01mol·L-1。室温下,“调pH”时,先除去Al3+,若忽略过程中溶液的体积变化,则需加入NaOH调节溶液pH的范围为_______ ,过滤后,再向滤液加入NaOH使Ce3+沉淀完全(已知:室温下,当溶液中的离子浓度c≤1.0×10-5mol·L-1时,可认为该离子沉淀完全。K[Al(OH)3]=1.0×10-32,K[Ce(OH)3]=1.0×10-21)。
(6)“氧化”时发生反应的化学方程式为_______
(7)用10吨含70%CeFCO3的矿石,按上述工艺生产,制得CeO24.48吨,则CeO2的产率为_______ (保留三位有效数字)。

已知:①Ce4+能与F-结合成CeF3+,Al3+也能与F-结合成AlF
 ;②Ce4+能被萃取剂TBP萃取,而Ce3+不能。回答下列问题:
;②Ce4+能被萃取剂TBP萃取,而Ce3+不能。回答下列问题:(1)“氧化焙烧”时,为了加快反应速率、提高原料利用率的措施有
(2)“氧化焙烧”后的固体产物中含有CeO2和CeF4,二者物质的量之比为3:1,“酸浸”时发生反应的离子方程式为
(3)TBP是一种有机萃取剂,“萃取”时发生反应:CeF3++TBP→CeTBP4++F-,氟洗液中添加Al3+的作用是
(4)“反萃取”时加入H2SO4和H2O2的混合液,H2O2的作用为
(5)“反萃取”后的水层溶液中c(Ce3+)=1mol·L-1,c(Al3+)=0.01mol·L-1。室温下,“调pH”时,先除去Al3+,若忽略过程中溶液的体积变化,则需加入NaOH调节溶液pH的范围为
(6)“氧化”时发生反应的化学方程式为
(7)用10吨含70%CeFCO3的矿石,按上述工艺生产,制得CeO24.48吨,则CeO2的产率为
您最近一年使用:0次
真题
名校
2 . 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
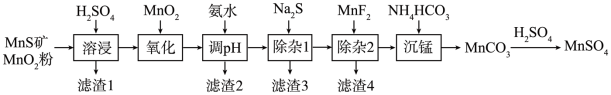
相关金属离子[c0(Mn+)=0.1 mol·L−1]形成氢氧化物沉淀的pH范围如下:
(1)“滤渣1”含有S和__________________________ ;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式____________________________________________________ 。
(2)“氧化”中添加适量的MnO2的作用是将________________________ 。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______ ~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________ 。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_____________________________________________________________________ 。
(6)写出“沉锰”的离子方程式___________________________________________________ 。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y= 时,z=
时,z=___________ 。

相关金属离子[c0(Mn+)=0.1 mol·L−1]形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和
(2)“氧化”中添加适量的MnO2的作用是将
(3)“调pH”除铁和铝,溶液的pH范围应调节为
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是
(6)写出“沉锰”的离子方程式
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=
 时,z=
时,z=
您最近一年使用:0次
2019-06-09更新
|
19501次组卷
|
29卷引用:安徽省阜阳市颍上二中等三校2020届高三上学期入学考试化学试题
安徽省阜阳市颍上二中等三校2020届高三上学期入学考试化学试题2019年全国统一高考化学试题(新课标Ⅲ)河北省张家口市第四中学2018-2019学年高二下学期6月月考理科综合化学试题 河北省辛集中学2020届高三上学期入学考试化学试题甘肃省高台县第一中学2020届高三上学期期中考试化学试题山东省滕州市第一中学2020届高三3月线上模拟考试化学试题(已下线)专题七 工艺流程题(真题汇编)-2020年高考二轮模块化复习之《元素化合物》名师讲案与提分特训河北省承德市围场卉原中学2020届高三模拟自测联考试卷理综化学试卷2020届四川省成都市第七中学高三三月份网络教学质量监测卷化学试题(已下线)专题6.1 无机化工流程题(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升四川省宜宾市叙州区第一中学校2020届高三下学期第四学月考试理综化学试题黑龙江省大庆市第四中学2020届高三下学期4月月考理综化学试题四川省宜宾市叙州区第二中学校2020届高三第一次高考适应性考试理综化学试题河南省信阳市罗山县2021届高三第一次调研(8月联考)化学试题鲁科版(2019)选择性必修1 第3章 物质在水溶液中的行为 第3节 沉淀溶解平衡高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第三章素养检测(已下线)押全国卷理综第27题 工业流程-备战2021年高考化学临考题号押题(课标全国卷)江西省宜春市第九中学2021-2022学年高三上学期10月月考化学试题天津市第二十五中学2021-2022学年高三上学期第一次月考化学试题(已下线)专题11 无机工艺流程题—2022年高考化学二轮复习讲练测(全国版)-讲义(已下线)押全国卷理综第27题 工业流程-备战2022年高考化学临考题号押题(全国卷)(已下线)回归教材重难点08 化学工艺流程分析-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)专题16工艺流程题-五年(2018~2022)高考真题汇编(全国卷)四川省泸州市泸县第五中学2022届高三高考适应性考试理综化学试题(已下线)专题18 工艺流程题(已下线)T26-工业流程题黑龙江省七台河市勃利县高级中学2022-2023学年高三上学期11月期中考试化学试题陕西省西安市周至县第六中学2023-2024学年高三上学期11月期中化学试题河南省济源市高级中学2023-2024学年高三上学期高考模拟检测(10月)理科综合试题-高中化学
2011高二·安徽·竞赛
3 . (12)氨是重要的无机化工原料,也是合成氮肥的主要原料,因此合成氨在国民经济中占有重要地位。
⑴工业合成氨反应的化学方程式为__________________________ 。
⑵恒温下,向一个2L的密闭容器中充入1mol N2和2.6mol H2,20min时,反应达到平衡,容器内c(NH3)为0.08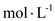 ,则c(H2)=
,则c(H2)=_________ ,20min内,用N2浓度的变化表示的反应速率为_________ 。
⑶某温度下,向一个2L的密闭容器中充入1mol N2和3mol H2,在恒温下反应,以下能说明反应达到平衡状态的是_________
①单位时间内消耗0.1molN2的同时生成0.2molNH3
②单位时间内生成0.3molH2的同时生成0.2molNH3
③n(N2)∶n(H2)∶n(NH3)=1∶3∶2
④c(NH3)=0.08mol/L
⑤容器内压强不变
⑷工业上约有80%的氨用于制造化肥。某化肥厂生产铵态氮肥(NH4)2SO4的反应可表示为:CaSO4+2NH3+CO2+H2O= CaCO3+(NH4)2SO4
①反应前先将CaSO4磨成粉末,加入水中制成悬浊液,则所得分散系中分散质粒子直径______ 10-7m(填“>”或“<”)。
②向CaSO4悬浊液中通入气体时,需先通入足量NH3再通入CO2,原因是____________ 。
⑴工业合成氨反应的化学方程式为
⑵恒温下,向一个2L的密闭容器中充入1mol N2和2.6mol H2,20min时,反应达到平衡,容器内c(NH3)为0.08
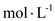 ,则c(H2)=
,则c(H2)=⑶某温度下,向一个2L的密闭容器中充入1mol N2和3mol H2,在恒温下反应,以下能说明反应达到平衡状态的是
①单位时间内消耗0.1molN2的同时生成0.2molNH3
②单位时间内生成0.3molH2的同时生成0.2molNH3
③n(N2)∶n(H2)∶n(NH3)=1∶3∶2
④c(NH3)=0.08mol/L
⑤容器内压强不变
⑷工业上约有80%的氨用于制造化肥。某化肥厂生产铵态氮肥(NH4)2SO4的反应可表示为:CaSO4+2NH3+CO2+H2O= CaCO3+(NH4)2SO4
①反应前先将CaSO4磨成粉末,加入水中制成悬浊液,则所得分散系中分散质粒子直径
②向CaSO4悬浊液中通入气体时,需先通入足量NH3再通入CO2,原因是
您最近一年使用:0次



