名校
1 . 碳达峰是指我国承诺2030年前,二氧化碳的排放不再增长。因此,诸多科学家都在大力研合理利用 和CO以减少碳的排放。
和CO以减少碳的排放。
(1) 可通过以下4种方式转化成有机物,从而有效实现碳循环。
可通过以下4种方式转化成有机物,从而有效实现碳循环。
a.
b.
c.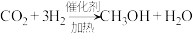
已知: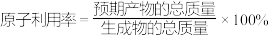
以上反应中,最环保节能的是_______ ,原子利用率最高的是_______ 。(填编号)
(2)我国科学家设计出一条仅11步的工业合成路线,实现了 到淀粉的合成。其第一步是把
到淀粉的合成。其第一步是把 还原为甲醇(
还原为甲醇( ),该方法的化学方程式是:
),该方法的化学方程式是:
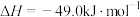 。回答下列问题:
。回答下列问题:
①能说明该反应已达平衡状态的是_______ (填字母)。
A.单位时间内生成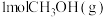 的同时消耗了
的同时消耗了
B.在恒温恒容的容器中,混合气体的平均摩尔质量保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒压的容器中,混合气体的密度不再变化
②该反应正逆反应的活化能大小为:Ea(正)_______ Ea(逆)(填“>”、“=”或“<”)
(3)利用CO高温时与磷石膏(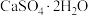 )反应,可减少CO的排放,又可以实现硫酸盐资源的再利用。已知该反应的产物与温度有关。
)反应,可减少CO的排放,又可以实现硫酸盐资源的再利用。已知该反应的产物与温度有关。
①在700℃时,主要的还原产物是一种硫的最低价盐,该物质为_______ (填化学式)。
②在1150℃时,向盛有足量 的真空恒容密闭容器中充入一定量CO,反应体系起始压强为
的真空恒容密闭容器中充入一定量CO,反应体系起始压强为 ,主要发生反应:
,主要发生反应: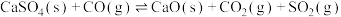 。该反应达到平衡时,
。该反应达到平衡时,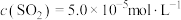 ,CO的转化率为50%,则初始时
,CO的转化率为50%,则初始时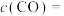
_______ mol/L,该反应的压强平衡常数
_______ MPa(忽略副反应;气体分压=总压×气体物质的量分数)。
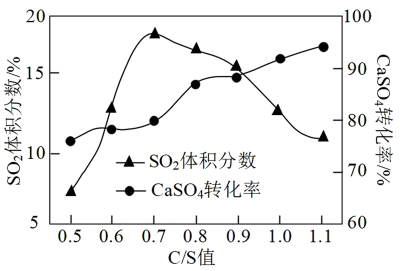
(4)工业上也可用炭粉还原磷石膏,该反应的产物与C/S值(炭粉与 的物质的量之比)有关。向密闭容器中加入几组不同C/S值的炭粉与磷石膏的混合物,1100℃煅烧至无气体产生,结果如图所示。当C/S值为0.5时,反应产物主要为CaO、
的物质的量之比)有关。向密闭容器中加入几组不同C/S值的炭粉与磷石膏的混合物,1100℃煅烧至无气体产生,结果如图所示。当C/S值为0.5时,反应产物主要为CaO、 和
和 ;当C/S值大于0.7时,反应所得气体中
;当C/S值大于0.7时,反应所得气体中 的体积分数下降,可能的原因是
的体积分数下降,可能的原因是_______ 。
 和CO以减少碳的排放。
和CO以减少碳的排放。(1)
 可通过以下4种方式转化成有机物,从而有效实现碳循环。
可通过以下4种方式转化成有机物,从而有效实现碳循环。a.

b.

c.
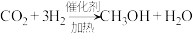
已知:
以上反应中,最环保节能的是
(2)我国科学家设计出一条仅11步的工业合成路线,实现了
 到淀粉的合成。其第一步是把
到淀粉的合成。其第一步是把 还原为甲醇(
还原为甲醇( ),该方法的化学方程式是:
),该方法的化学方程式是:
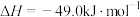 。回答下列问题:
。回答下列问题:①能说明该反应已达平衡状态的是
A.单位时间内生成
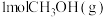 的同时消耗了
的同时消耗了
B.在恒温恒容的容器中,混合气体的平均摩尔质量保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒压的容器中,混合气体的密度不再变化
②该反应正逆反应的活化能大小为:Ea(正)
(3)利用CO高温时与磷石膏(
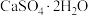 )反应,可减少CO的排放,又可以实现硫酸盐资源的再利用。已知该反应的产物与温度有关。
)反应,可减少CO的排放,又可以实现硫酸盐资源的再利用。已知该反应的产物与温度有关。①在700℃时,主要的还原产物是一种硫的最低价盐,该物质为
②在1150℃时,向盛有足量
 的真空恒容密闭容器中充入一定量CO,反应体系起始压强为
的真空恒容密闭容器中充入一定量CO,反应体系起始压强为 ,主要发生反应:
,主要发生反应: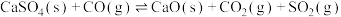 。该反应达到平衡时,
。该反应达到平衡时,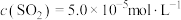 ,CO的转化率为50%,则初始时
,CO的转化率为50%,则初始时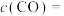

(4)工业上也可用炭粉还原磷石膏,该反应的产物与C/S值(炭粉与
 的物质的量之比)有关。向密闭容器中加入几组不同C/S值的炭粉与磷石膏的混合物,1100℃煅烧至无气体产生,结果如图所示。当C/S值为0.5时,反应产物主要为CaO、
的物质的量之比)有关。向密闭容器中加入几组不同C/S值的炭粉与磷石膏的混合物,1100℃煅烧至无气体产生,结果如图所示。当C/S值为0.5时,反应产物主要为CaO、 和
和 ;当C/S值大于0.7时,反应所得气体中
;当C/S值大于0.7时,反应所得气体中 的体积分数下降,可能的原因是
的体积分数下降,可能的原因是
您最近半年使用:0次
2022-09-21更新
|
141次组卷
|
2卷引用:重庆市璧山来凤中学校2022-2023学年高二上学期9月月考化学试题
名校
解题方法
2 .  常用作有机合成催化剂,现有如下两种方法制备
常用作有机合成催化剂,现有如下两种方法制备 。已知:
。已知: 晶体呈白色,微溶于水,不溶于稀盐酸,露置于潮湿空气中易转化为绿色的
晶体呈白色,微溶于水,不溶于稀盐酸,露置于潮湿空气中易转化为绿色的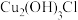 ,且易见光分解。
,且易见光分解。
方法一:利用热分解 (绿色)制备
(绿色)制备 ,并进行相关探究。
,并进行相关探究。
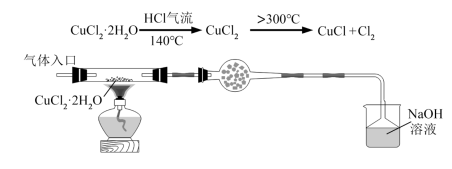
(1)将下列实验操作按先后顺序排列为:a→→→→→→d______
a.检查装置的气密性后加入药品 b.点燃酒精灯加热至 ,反应一段时间
,反应一段时间
c.调整酒精灯温度 ,反应一段时间 d.停止通入
,反应一段时间 d.停止通入
e.停止通入 ,然后通入干燥
,然后通入干燥 f.在“气体入口”处通入干燥
f.在“气体入口”处通入干燥
g.熄灭酒精灯
(2)当观察到___________ 时,反应达到终点,停止加热。
方法二:以 (含少量
(含少量 )粗品为原料制取
)粗品为原料制取 ,设计的合成路线如下:
,设计的合成路线如下:
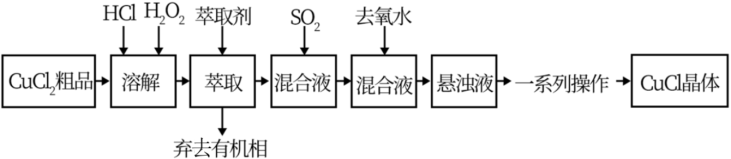
查阅资料可知:①在较高的盐酸浓度下, 能溶解于甲基异丁基甲酮:
能溶解于甲基异丁基甲酮:
② 在溶液中存在:
在溶液中存在: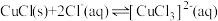 。
。
(3)写出 通入混合液中发生的反应的离子方程式
通入混合液中发生的反应的离子方程式___________ 。
(4)下列叙述正确的是___________(填字母)。

(5)向混合液中加入去氧水的目的是___________ 。
(6)现称取 产品,用硫酸酸化的硫酸铁完全溶解,并稀释成
产品,用硫酸酸化的硫酸铁完全溶解,并稀释成 。每次用移液管移取
。每次用移液管移取 溶液于锥形瓶中,再用
溶液于锥形瓶中,再用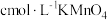 溶液滴定,平均消耗
溶液滴定,平均消耗 。
。
①按该实验方案计算产品的纯度为___________ %。
②有同学认为该实验方案明显不合理,会导致计算的 纯度
纯度___________ (填“偏高”或“偏低”)
 常用作有机合成催化剂,现有如下两种方法制备
常用作有机合成催化剂,现有如下两种方法制备 。已知:
。已知: 晶体呈白色,微溶于水,不溶于稀盐酸,露置于潮湿空气中易转化为绿色的
晶体呈白色,微溶于水,不溶于稀盐酸,露置于潮湿空气中易转化为绿色的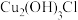 ,且易见光分解。
,且易见光分解。方法一:利用热分解
 (绿色)制备
(绿色)制备 ,并进行相关探究。
,并进行相关探究。
(1)将下列实验操作按先后顺序排列为:a→→→→→→d
a.检查装置的气密性后加入药品 b.点燃酒精灯加热至
 ,反应一段时间
,反应一段时间c.调整酒精灯温度
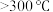 ,反应一段时间 d.停止通入
,反应一段时间 d.停止通入
e.停止通入
 ,然后通入干燥
,然后通入干燥 f.在“气体入口”处通入干燥
f.在“气体入口”处通入干燥
g.熄灭酒精灯
(2)当观察到
方法二:以
 (含少量
(含少量 )粗品为原料制取
)粗品为原料制取 ,设计的合成路线如下:
,设计的合成路线如下:
查阅资料可知:①在较高的盐酸浓度下,
 能溶解于甲基异丁基甲酮:
能溶解于甲基异丁基甲酮:②
 在溶液中存在:
在溶液中存在: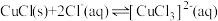 。
。(3)写出
 通入混合液中发生的反应的离子方程式
通入混合液中发生的反应的离子方程式(4)下列叙述正确的是___________(填字母)。

A. 原料中含有的 原料中含有的 经氧化、萃取几乎都在有机相中被除去 经氧化、萃取几乎都在有机相中被除去 |
| B.加入萃取剂后,混合物转移至分液漏斗中,塞上玻璃塞,如图用力振摇 |
| C.上述合成路线中,一系列操作包括:抽滤、洗涤、干燥,且干燥时应注意密封、避光 |
D.该流程中温度越高越有利于将 转化为 转化为 |
(6)现称取
 产品,用硫酸酸化的硫酸铁完全溶解,并稀释成
产品,用硫酸酸化的硫酸铁完全溶解,并稀释成 。每次用移液管移取
。每次用移液管移取 溶液于锥形瓶中,再用
溶液于锥形瓶中,再用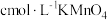 溶液滴定,平均消耗
溶液滴定,平均消耗 。
。①按该实验方案计算产品的纯度为
②有同学认为该实验方案明显不合理,会导致计算的
 纯度
纯度
您最近半年使用:0次
名校
解题方法
3 . 由 键构建
键构建 键是有机化学的热点研究领域。我国科学家利用
键是有机化学的热点研究领域。我国科学家利用 苯基甘氨酸中的
苯基甘氨酸中的 键在
键在 作用下构建
作用下构建 键,实现了喹啉并内酯的高选择性制备。合成路线如图。
键,实现了喹啉并内酯的高选择性制备。合成路线如图。
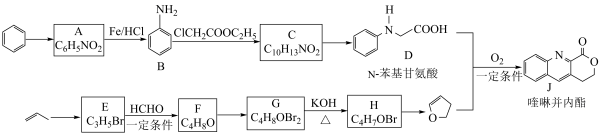
已知:i.
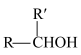
ii.
(1) 的反应类型是
的反应类型是___________ 。
(2)B具有碱性, 转化为
转化为 的反应中,使
的反应中,使 过量可以提高
过量可以提高 的平衡转化率,
的平衡转化率, 的作用是
的作用是___________ (写出一条即可)。
(3)C转化为 的化学方程式为
的化学方程式为___________ 。
(4) 转化为
转化为 的化学方程式为
的化学方程式为___________ ; 生成
生成 的过程中会得到少量的聚合物,写出其中一种的结构简式:
的过程中会得到少量的聚合物,写出其中一种的结构简式:___________ 。
(5)已知:
i.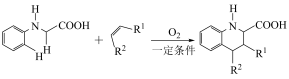
ii.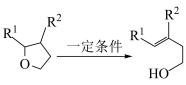
①D和 在
在 作用下得到
作用下得到 的4步反应如图(无机试剂及条件已略去),中间产物1中有两个六元环和一个五元环,中间产物3中有三个六元环。结合已知反应信息,写出结构简式:中间产物1
的4步反应如图(无机试剂及条件已略去),中间产物1中有两个六元环和一个五元环,中间产物3中有三个六元环。结合已知反应信息,写出结构简式:中间产物1___________ ,中间产物3___________ 。
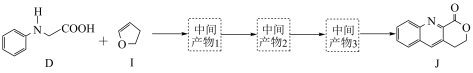
②D和 转化成
转化成 的过程中还生成水,理论上该过程中消耗的
的过程中还生成水,理论上该过程中消耗的 与生成的
与生成的 的物质的量之比为
的物质的量之比为___________ 。
 键构建
键构建 键是有机化学的热点研究领域。我国科学家利用
键是有机化学的热点研究领域。我国科学家利用 苯基甘氨酸中的
苯基甘氨酸中的 键在
键在 作用下构建
作用下构建 键,实现了喹啉并内酯的高选择性制备。合成路线如图。
键,实现了喹啉并内酯的高选择性制备。合成路线如图。
已知:i.

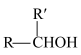
ii.
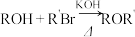
(1)
 的反应类型是
的反应类型是(2)B具有碱性,
 转化为
转化为 的反应中,使
的反应中,使 过量可以提高
过量可以提高 的平衡转化率,
的平衡转化率, 的作用是
的作用是(3)C转化为
 的化学方程式为
的化学方程式为(4)
 转化为
转化为 的化学方程式为
的化学方程式为 生成
生成 的过程中会得到少量的聚合物,写出其中一种的结构简式:
的过程中会得到少量的聚合物,写出其中一种的结构简式:(5)已知:
i.

ii.

①D和
 在
在 作用下得到
作用下得到 的4步反应如图(无机试剂及条件已略去),中间产物1中有两个六元环和一个五元环,中间产物3中有三个六元环。结合已知反应信息,写出结构简式:中间产物1
的4步反应如图(无机试剂及条件已略去),中间产物1中有两个六元环和一个五元环,中间产物3中有三个六元环。结合已知反应信息,写出结构简式:中间产物1
②D和
 转化成
转化成 的过程中还生成水,理论上该过程中消耗的
的过程中还生成水,理论上该过程中消耗的 与生成的
与生成的 的物质的量之比为
的物质的量之比为
您最近半年使用:0次
名校
4 . 硼氢化钠(NaBH4)和氨硼烷(BNH6)是优良的储氢材料,合成路线如图所示,下列叙述错误的是


| A.硼氢化钠中阴离子的VSEPR模型为正四面体形 |
| B.反应①中氧化剂与还原剂物质的量之比为1∶2 |
| C.SiO2是反应①的催化剂 |
| D.将氨硼烷移出体系有利于提高反应②转化率 |
您最近半年使用:0次
名校
解题方法
5 . 聚醋酸乙烯酯难溶于水,可用作白乳胶、塑料薄膜和涂料等,用它可得到聚乙烯醇,聚乙烯醇水溶液可用作医用滴眼液。合成路线如下:
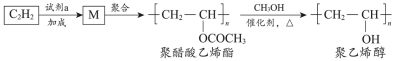
已知: (R’、
(R’、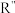 不同的羟基)
不同的羟基)
下列说法不正确 的是

已知:
 (R’、
(R’、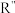 不同的羟基)
不同的羟基)下列说法
| A.试剂a是乙酸 |
| B.通过增加甲醇用量可提高聚乙烯醇的产率 |
| C.由M转化为聚醋酸乙烯酯的过程中发生了缩聚反应 |
| D.由聚醋酸乙烯酯转化为聚乙烯醇过程中还会生成乙酸甲酯 |
您最近半年使用:0次
解题方法
6 . 雾霾含有大量的污染物SO2、NO。工业上变废为宝利用工业尾气获得NH4NO3产品的流程图如下:(Ce为铈元素)

(1)上述流程中循环使用的物质有_____________________ 。
(2)上述合成路线中用到15%~20%的乙醇胺(HOCH2CH2NH2),其水溶液具有弱碱性,显碱性的原因:HOCH2CH2NH2 + H2O
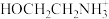 +OH-,写出乙醇胺吸收CO2的化学方程式
+OH-,写出乙醇胺吸收CO2的化学方程式___________ 。
(3)写出吸收池Ⅲ中酸性条件下NO转化为 (或NO转化为
(或NO转化为 )的离子方程式:
)的离子方程式:_____ (任选其一)。
(4)向吸收池Ⅳ得到的 溶液中滴加少量CaCl2溶液,出现浑浊,pH降低,用平衡移动原理解释溶液pH降低的原因:
溶液中滴加少量CaCl2溶液,出现浑浊,pH降低,用平衡移动原理解释溶液pH降低的原因:________________________________________ 。
(5)从氧化池Ⅵ中得到粗产品NH4NO3的实验操作是______________ 、____________ 、过滤、洗涤等。上述流程中每一步均恰好完全反应,若制得NH4NO3质量为0.8kg,电解池V制得2mol/L的 溶液2L,则氧化池Ⅵ中消耗的O2在标准状况下的体积为
溶液2L,则氧化池Ⅵ中消耗的O2在标准状况下的体积为________ L。

(1)上述流程中循环使用的物质有
(2)上述合成路线中用到15%~20%的乙醇胺(HOCH2CH2NH2),其水溶液具有弱碱性,显碱性的原因:HOCH2CH2NH2 + H2O

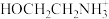 +OH-,写出乙醇胺吸收CO2的化学方程式
+OH-,写出乙醇胺吸收CO2的化学方程式(3)写出吸收池Ⅲ中酸性条件下NO转化为
 (或NO转化为
(或NO转化为 )的离子方程式:
)的离子方程式:(4)向吸收池Ⅳ得到的
 溶液中滴加少量CaCl2溶液,出现浑浊,pH降低,用平衡移动原理解释溶液pH降低的原因:
溶液中滴加少量CaCl2溶液,出现浑浊,pH降低,用平衡移动原理解释溶液pH降低的原因:(5)从氧化池Ⅵ中得到粗产品NH4NO3的实验操作是
 溶液2L,则氧化池Ⅵ中消耗的O2在标准状况下的体积为
溶液2L,则氧化池Ⅵ中消耗的O2在标准状况下的体积为
您最近半年使用:0次
名校
7 . 氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)根据下图提供的信息,写出该反应的热化学方程式
_____________________________________________ ,
下图的曲线中____________ (填“a” 或“b”)表示 加入铁触媒(催化剂)的能量变化曲线。
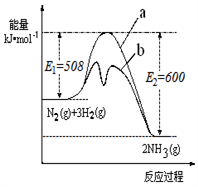
(2)在恒容容器中,下列描述中能说明上述反应已达平衡的是_________________ 。
A.3υ(H2)正=2υ(NH3)逆
B.单位时间内生成n mol N2的同时生成2n molNH3
C.容器内气体的密度不随时间的变化而变化
D.容器内压强不随时间的变化而变化
(3)为了寻找合成NH3的适宜条件,某同学设计了三组实验(如下表),请在下表空格处填入相应的实验条件及数据。
(4)合成氨的原料气氢气制备时其中一步反应: H2O(g)+CO(g) CO2(g)+H2(g),在850 ℃时,其平衡常数K=1。若850 ℃时向体积为1 L的恒容密闭容器中,同时充入1.0 mol CO,3.0 mol H2O,1.0 mol CO2,5.0 mol H2,此时反应向
CO2(g)+H2(g),在850 ℃时,其平衡常数K=1。若850 ℃时向体积为1 L的恒容密闭容器中,同时充入1.0 mol CO,3.0 mol H2O,1.0 mol CO2,5.0 mol H2,此时反应向____________ (填“正反应”或“逆反应”)方向进行,平衡时CO2的物质的量为______________ 。
(1)根据下图提供的信息,写出该反应的热化学方程式
下图的曲线中

(2)在恒容容器中,下列描述中能说明上述反应已达平衡的是
A.3υ(H2)正=2υ(NH3)逆
B.单位时间内生成n mol N2的同时生成2n molNH3
C.容器内气体的密度不随时间的变化而变化
D.容器内压强不随时间的变化而变化
(3)为了寻找合成NH3的适宜条件,某同学设计了三组实验(如下表),请在下表空格处填入相应的实验条件及数据。
实验编号 | T(℃) | n (N2)/n(H2) | P(MPa) |
ⅰ | 450 | 1/3 | 1 |
ⅱ | 1/3 | 10 | |
ⅲ | 480 | 10 |
(4)合成氨的原料气氢气制备时其中一步反应: H2O(g)+CO(g)
 CO2(g)+H2(g),在850 ℃时,其平衡常数K=1。若850 ℃时向体积为1 L的恒容密闭容器中,同时充入1.0 mol CO,3.0 mol H2O,1.0 mol CO2,5.0 mol H2,此时反应向
CO2(g)+H2(g),在850 ℃时,其平衡常数K=1。若850 ℃时向体积为1 L的恒容密闭容器中,同时充入1.0 mol CO,3.0 mol H2O,1.0 mol CO2,5.0 mol H2,此时反应向
您最近半年使用:0次
名校
解题方法
8 . 苯酚是重要的有机化工原料,还可用作溶剂、实验试剂和消毒剂,苯酚的水溶液可以使植物细胞内染色体上蛋白质与DNA分离,便于对DNA进行染色,实验小组同学查阅文献后进行苯酚的制备和相关性质的探究。回答下列问题:
I.苯酚的制备
工业上用异丙苯氧化法合成苯酚,其合成原理如下:
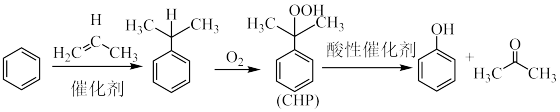
已知:①过氧化氢异丙苯基(CHP)受热易分解。
②相关化合物的物理常数如下表所示:
③苯酚显色反应的原理为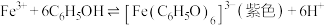 。
。
(1)苯和丙烯在催化下发生烷基化反应生成异丙苯,异丙苯经 氧化生成过氧化氢异丙苯基(CHP),氧化过程中温度不能过高的原因是
氧化生成过氧化氢异丙苯基(CHP),氧化过程中温度不能过高的原因是___________ ,___________ 。
(2)过氧化氢异丙苯基(CHP)在酸性催化剂作用下分解为苯酚和丙酮,再通过蒸馏得到高纯度苯酚。蒸馏时先得到的馏分是___________ 。在蒸馏操作中,下列仪器安装正确的是___________ (填标号)。
A.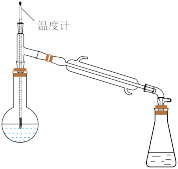 B.
B.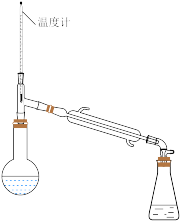 C.
C.  D.
D.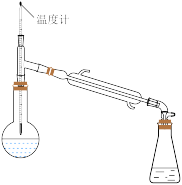
(3)若检验丙酮中是否存在苯酚杂质,可选择的试剂是___________(填标号)。
Ⅱ.探究铁离子与苯酚的显色反应
实验1:

实验2:

【提出猜想】
猜想1: 对铁离子与苯酚的反应有促进作用。
对铁离子与苯酚的反应有促进作用。
猜想2: 对铁离子与苯酚的反应有抑制作用。
对铁离子与苯酚的反应有抑制作用。
(4)若向实验1反应后溶液中继续加入NaCl固体,溶液颜色无变化,由此得出的结论是___________ 。
(5)若向实验1反应后溶液中加入___________ 固体(填化学式),溶液颜色变为浅紫色,说明猜想2成立。
(6)实验小组同学提出猜想3:溶液的pH会影响显色效果。设计如下实验:
①实验ⅱ中红褐色沉淀是___________ (填化学式)。
②实验ⅲ中继续滴加过量盐酸,溶液由紫色变为浅黄色的原因是___________ 。
I.苯酚的制备
工业上用异丙苯氧化法合成苯酚,其合成原理如下:

已知:①过氧化氢异丙苯基(CHP)受热易分解。
②相关化合物的物理常数如下表所示:
| 物质 | 相对分子质量 | 密度/( ) ) | 沸点/℃ |
| 异丙苯 | 120 | 0.8640 | 153 |
| 丙酮 | 58 | 0.7898 | 56.5 |
| 苯酚 | 94 | 1.0722 | 182 |
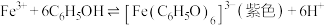 。
。(1)苯和丙烯在催化下发生烷基化反应生成异丙苯,异丙苯经
 氧化生成过氧化氢异丙苯基(CHP),氧化过程中温度不能过高的原因是
氧化生成过氧化氢异丙苯基(CHP),氧化过程中温度不能过高的原因是(2)过氧化氢异丙苯基(CHP)在酸性催化剂作用下分解为苯酚和丙酮,再通过蒸馏得到高纯度苯酚。蒸馏时先得到的馏分是
A.
 B.
B. C.
C.  D.
D.
(3)若检验丙酮中是否存在苯酚杂质,可选择的试剂是___________(填标号)。
| A.酸性高锰酸钾溶液 | B.乙醇 |
| C.石蕊溶液 | D.氢氧化钠溶液 |
Ⅱ.探究铁离子与苯酚的显色反应
实验1:

实验2:

【提出猜想】
猜想1:
 对铁离子与苯酚的反应有促进作用。
对铁离子与苯酚的反应有促进作用。猜想2:
 对铁离子与苯酚的反应有抑制作用。
对铁离子与苯酚的反应有抑制作用。(4)若向实验1反应后溶液中继续加入NaCl固体,溶液颜色无变化,由此得出的结论是
(5)若向实验1反应后溶液中加入
(6)实验小组同学提出猜想3:溶液的pH会影响显色效果。设计如下实验:
| 实验 | 操作 | 现象 |
| ⅰ | 向2mL苯酚溶液(调节pH=5.5)滴加 溶液 溶液 | 溶液显紫色(显色效果最佳) |
| ⅱ | 向2mL苯酚溶液(调节pH=9)滴加 溶液 溶液 | 生成红褐色沉淀 |
| ⅲ | 向实验Ⅱ所得悬浊液中逐滴加入过量 盐酸 盐酸 | 沉淀逐渐溶解,溶液变为紫色;继续滴加过量盐酸,溶液由紫色变为浅黄色 |
②实验ⅲ中继续滴加过量盐酸,溶液由紫色变为浅黄色的原因是
您最近半年使用:0次
9 . 二氧化铈 是一种用途广泛的稀土化合物。以氟碳铈矿(主要含
是一种用途广泛的稀土化合物。以氟碳铈矿(主要含 )为原料制备
)为原料制备 的一种工艺流程如图所示:
的一种工艺流程如图所示: 能与
能与 结合成
结合成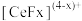 ,也能与
,也能与 结合成
结合成 ;
;
②在硫酸体系中 能被萃取剂
能被萃取剂 萃取,而
萃取,而 不能。
不能。
回答下列问题:
(1)氧化焙烧中氧化的目的是_______ 。
(2)“萃取”时存在反应: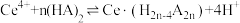 ,如图中D是分配比,表示
,如图中D是分配比,表示 分别在有机层中与水层中存在形式的物质的量浓度之比
分别在有机层中与水层中存在形式的物质的量浓度之比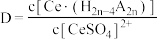 保持其它条件不变,若在起始料液中加入不同量的
保持其它条件不变,若在起始料液中加入不同量的 以改变水层中的
以改变水层中的 ,请解释D随起始料液中
,请解释D随起始料液中 变化的原因:
变化的原因:_______ 。 的作用下
的作用下 转化为
转化为 ,反应的离子方程式为:
,反应的离子方程式为:_______ 。
(4)向水层中加入 溶液来调节溶液的
溶液来调节溶液的 ,
, 应大于
应大于_______ 时, 完全生成
完全生成 沉淀。(已知
沉淀。(已知 )
)
(5)“氧化”步骤中氧化剂与还原剂物质的量之比为_______ 。
(6) 是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧,在尾气消除过程中发生着
是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧,在尾气消除过程中发生着 的循环,请写出
的循环,请写出 消除
消除 尾气(气体产物是空气的某一成分)的化学方程式
尾气(气体产物是空气的某一成分)的化学方程式_______ 。
(7)氧化铈 ,常用作玻璃工业添加剂,在其立方晶胞中掺杂
,常用作玻璃工业添加剂,在其立方晶胞中掺杂 ,
, 占据原来
占据原来 的位置,可以得到更稳定的结构,如图所示,
的位置,可以得到更稳定的结构,如图所示, 晶胞中
晶胞中 与最近
与最近 的核间距为
的核间距为 。(已知:
。(已知: 的空缺率
的空缺率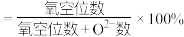 )
) 点原子的分数坐标为
点原子的分数坐标为 ,则
,则 点原子的分数坐标为
点原子的分数坐标为_______ 。
② 晶胞中与
晶胞中与 最近的
最近的 的个数为
的个数为_______ 。
③ 晶体的密度为
晶体的密度为_______ (只需列出表达式)。
④若掺杂 后得到
后得到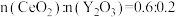 的晶体,则此晶体中
的晶体,则此晶体中 的空缺率为
的空缺率为_______ 。
 是一种用途广泛的稀土化合物。以氟碳铈矿(主要含
是一种用途广泛的稀土化合物。以氟碳铈矿(主要含 )为原料制备
)为原料制备 的一种工艺流程如图所示:
的一种工艺流程如图所示: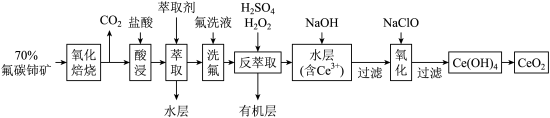
 能与
能与 结合成
结合成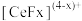 ,也能与
,也能与 结合成
结合成 ;
;②在硫酸体系中
 能被萃取剂
能被萃取剂 萃取,而
萃取,而 不能。
不能。回答下列问题:
(1)氧化焙烧中氧化的目的是
(2)“萃取”时存在反应:
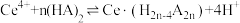 ,如图中D是分配比,表示
,如图中D是分配比,表示 分别在有机层中与水层中存在形式的物质的量浓度之比
分别在有机层中与水层中存在形式的物质的量浓度之比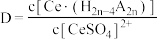 保持其它条件不变,若在起始料液中加入不同量的
保持其它条件不变,若在起始料液中加入不同量的 以改变水层中的
以改变水层中的 ,请解释D随起始料液中
,请解释D随起始料液中 变化的原因:
变化的原因: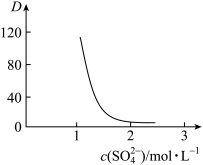
 的作用下
的作用下 转化为
转化为 ,反应的离子方程式为:
,反应的离子方程式为:(4)向水层中加入
 溶液来调节溶液的
溶液来调节溶液的 ,
, 应大于
应大于 完全生成
完全生成 沉淀。(已知
沉淀。(已知 )
)(5)“氧化”步骤中氧化剂与还原剂物质的量之比为
(6)
 是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧,在尾气消除过程中发生着
是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧,在尾气消除过程中发生着 的循环,请写出
的循环,请写出 消除
消除 尾气(气体产物是空气的某一成分)的化学方程式
尾气(气体产物是空气的某一成分)的化学方程式(7)氧化铈
 ,常用作玻璃工业添加剂,在其立方晶胞中掺杂
,常用作玻璃工业添加剂,在其立方晶胞中掺杂 ,
, 占据原来
占据原来 的位置,可以得到更稳定的结构,如图所示,
的位置,可以得到更稳定的结构,如图所示, 晶胞中
晶胞中 与最近
与最近 的核间距为
的核间距为 。(已知:
。(已知: 的空缺率
的空缺率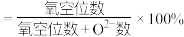 )
)
 点原子的分数坐标为
点原子的分数坐标为 ,则
,则 点原子的分数坐标为
点原子的分数坐标为②
 晶胞中与
晶胞中与 最近的
最近的 的个数为
的个数为③
 晶体的密度为
晶体的密度为④若掺杂
 后得到
后得到 的晶体,则此晶体中
的晶体,则此晶体中 的空缺率为
的空缺率为
您最近半年使用:0次
名校
10 . CO2是一种温室气体,对人类的生存环境产生巨大的影响,将CO2作为原料转化为有用化学品,对实现碳中和及生态环境保护有着重要意义。
Ⅰ.工业上以CO2和NH3为原料合成尿素,在合成塔中存在如下转化:

(1)液相中,合成尿素的热化学方程式为:2NH3(l)+CO2(l) H2O(l)+NH2CONH2(l) ΔH=
H2O(l)+NH2CONH2(l) ΔH=___________ kJ/mol。
Ⅱ.可利用CO2和CH4催化制备合成气(CO、H2),在一定温度下容积为1 L密闭容器中,充入等物质的量CH4和CO2,加入Ni/Al2O3使其发生反应:CH4(g)+CO2(g) 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
(2)制备“合成气”反应历程分两步:
上述反应中C(ads)为吸附性活性炭,反应历程的能量图变化如下图所示:
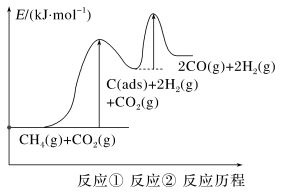
①反应速率快慢比较:反应①___________ 反应②(填“>”“<”或“=”),请依据有效碰撞理论微观探析其原因___________ 。
②一定温度下,反应CH4(g)+CO2(g) 2CO(g)+2H2(g)的平衡常数K=
2CO(g)+2H2(g)的平衡常数K=___________ (用k1、k2、k3、k4表示)。
(3)制备合成气(CO、H2)过程中发生副反应:CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41.0 kJ/mol,在刚性密闭容器中,进料比
CO(g)+H2O(g) ΔH2=+41.0 kJ/mol,在刚性密闭容器中,进料比 分别等于1.0、1.5、2.0,且反应达到平衡状态。反应体系中,
分别等于1.0、1.5、2.0,且反应达到平衡状态。反应体系中, 随温度变化的关系如图所示:
随温度变化的关系如图所示:
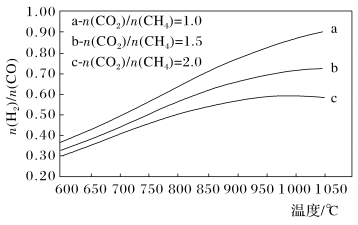
随着进料比 的增加,
的增加, 的值
的值___________ (填“增大”、“不变”或“减小”),其原因是___________ 。
Ⅰ.工业上以CO2和NH3为原料合成尿素,在合成塔中存在如下转化:

(1)液相中,合成尿素的热化学方程式为:2NH3(l)+CO2(l)
 H2O(l)+NH2CONH2(l) ΔH=
H2O(l)+NH2CONH2(l) ΔH=Ⅱ.可利用CO2和CH4催化制备合成气(CO、H2),在一定温度下容积为1 L密闭容器中,充入等物质的量CH4和CO2,加入Ni/Al2O3使其发生反应:CH4(g)+CO2(g)
 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。(2)制备“合成气”反应历程分两步:
| 步骤 | 反应 | 正反应速率方程 | 逆反应速率方程 |
| 反应① | CH4(g) C(ads)+2H2(g) C(ads)+2H2(g) | v正=k1·c(CH4) | v逆=k2·c2(H2) |
| 反应② | C(ads)+CO2(g) 2CO(g) 2CO(g) | v正=k3·c(CO2) | v逆=k4·c2(CO) |

①反应速率快慢比较:反应①
②一定温度下,反应CH4(g)+CO2(g)
 2CO(g)+2H2(g)的平衡常数K=
2CO(g)+2H2(g)的平衡常数K=(3)制备合成气(CO、H2)过程中发生副反应:CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2=+41.0 kJ/mol,在刚性密闭容器中,进料比
CO(g)+H2O(g) ΔH2=+41.0 kJ/mol,在刚性密闭容器中,进料比 分别等于1.0、1.5、2.0,且反应达到平衡状态。反应体系中,
分别等于1.0、1.5、2.0,且反应达到平衡状态。反应体系中, 随温度变化的关系如图所示:
随温度变化的关系如图所示:
随着进料比
 的增加,
的增加, 的值
的值
您最近半年使用:0次



