名校
1 . 硼氢化钠(NaBH4)和氨硼烷(BNH6)是优良的储氢材料,合成路线如图所示,下列叙述错误的是


| A.硼氢化钠中阴离子的VSEPR模型为正四面体形 |
| B.反应①中氧化剂与还原剂物质的量之比为1∶2 |
| C.SiO2是反应①的催化剂 |
| D.将氨硼烷移出体系有利于提高反应②转化率 |
您最近一年使用:0次
2 . 过氧乙酸是具有重要用途的有机合成氧化剂和化工原料,实验室拟合成过氧乙酸并测定其含量。
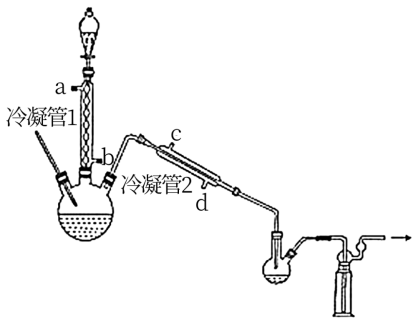
(1)浓缩H2O2
在图示装置(加热装置已省略)中,由分液漏斗向冷凝管1中滴加30% H2O2溶液,最终得到质量分数约68%的H2O2溶液。
①冷凝管1、冷凝管2中进水接口依次为___ 、___ 。(填字母)
②加热温度不宜超过60℃的原因是___ 。
(2)合成过氧乙酸
向带有搅拌装置及温度计的500mL三口烧瓶中先加入16g冰醋酸,在搅拌下滴加90g68%H2O2溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。
(已知:CH3COOH+H2O2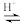
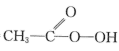 +H2O)
+H2O)
①用浓缩的68%H2O2溶液代替常见的30%H2O2溶液的目的是___ ;浓硫酸的作用是___ 。
②充分搅拌的目的是___ 。
(3)过氧乙酸含量的测定
步骤a:称取5.0g过氧乙酸试样(液体),配制成100mL溶液A。
步骤b:在碘量瓶中加入5.0mLH2SO4溶液、3滴MnSO4溶液、5.0mL溶液A,摇匀,用0.01mol•L-1的KMnO4溶液滴定至溶液呈微红色。
步骤c:向滴定后的溶液中再加1.0gKI(CH3COOOH+2H++2I-=I2+CH3COOH+H2O),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂2.0mL,摇匀,用淀粉溶液作指示剂,用0.05mol•L-1的Na2S2O3标准溶液滴定至蓝色刚好褪去(I2+2S2O =2I-+S4O
=2I-+S4O )。重复步骤b、步骤c三次,测得平均消耗Na2S2O3标准溶液的体积为20.00mL。
)。重复步骤b、步骤c三次,测得平均消耗Na2S2O3标准溶液的体积为20.00mL。
①步骤a中配制溶液A时,需要用到的玻璃仪器除烧杯、100mL容量瓶、玻璃棒和量筒外,还需要____ 。
②设计步骤b的目的是___ 。
③过氧乙酸的质量分数为___ %。

(1)浓缩H2O2
在图示装置(加热装置已省略)中,由分液漏斗向冷凝管1中滴加30% H2O2溶液,最终得到质量分数约68%的H2O2溶液。
①冷凝管1、冷凝管2中进水接口依次为
②加热温度不宜超过60℃的原因是
(2)合成过氧乙酸
向带有搅拌装置及温度计的500mL三口烧瓶中先加入16g冰醋酸,在搅拌下滴加90g68%H2O2溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。
(已知:CH3COOH+H2O2
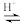
 +H2O)
+H2O)①用浓缩的68%H2O2溶液代替常见的30%H2O2溶液的目的是
②充分搅拌的目的是
(3)过氧乙酸含量的测定
步骤a:称取5.0g过氧乙酸试样(液体),配制成100mL溶液A。
步骤b:在碘量瓶中加入5.0mLH2SO4溶液、3滴MnSO4溶液、5.0mL溶液A,摇匀,用0.01mol•L-1的KMnO4溶液滴定至溶液呈微红色。
步骤c:向滴定后的溶液中再加1.0gKI(CH3COOOH+2H++2I-=I2+CH3COOH+H2O),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂2.0mL,摇匀,用淀粉溶液作指示剂,用0.05mol•L-1的Na2S2O3标准溶液滴定至蓝色刚好褪去(I2+2S2O
 =2I-+S4O
=2I-+S4O )。重复步骤b、步骤c三次,测得平均消耗Na2S2O3标准溶液的体积为20.00mL。
)。重复步骤b、步骤c三次,测得平均消耗Na2S2O3标准溶液的体积为20.00mL。①步骤a中配制溶液A时,需要用到的玻璃仪器除烧杯、100mL容量瓶、玻璃棒和量筒外,还需要
②设计步骤b的目的是
③过氧乙酸的质量分数为
您最近一年使用:0次
3 . 过氧乙酸是具有重要用途的有机合成氧化剂和化工原料,实验室拟合成过氧乙酸并测定其含量。
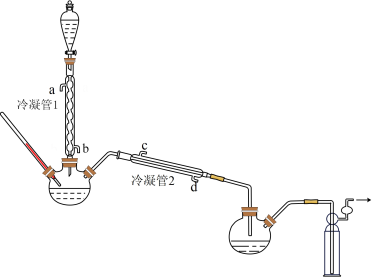
(1)浓缩
在图示装置(加热装置已省略)中,由分液漏斗向冷凝管1中滴加30% 溶液,最终得到质量分数约68%的
溶液,最终得到质量分数约68%的 溶液。
溶液。
①冷凝管1、冷凝管2中进水接口依次为___________ 、___________ (填字母);冷凝效果更好的是___________ (填“冷凝管1”或“冷凝管2”)。
②加热温度不宜超过60℃的原因是___________ 。
(2)合成过氧乙酸
向带有搅拌装置及温度计的500mL三口烧瓶中先加入16g冰醋酸,在搅拌下滴加90g68% 溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。
溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。
(已知: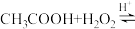

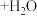 )
)
①用浓缩的68% 溶液代替常见的30%
溶液代替常见的30% 浴液的目的是
浴液的目的是___________ ;浓硫酸的作用是___________ 。
②充分搅拌的目的是___________ 。
(3)过氧乙酸含量的测定
步骤a:称取5.0g过氧乙酸试样(液体),配制成100mL溶液A。
步骤b:在碘量瓶中加入 溶液、3滴
溶液、3滴 溶液、5.0mL溶液A,摇匀,用0.01mol/L的
溶液、5.0mL溶液A,摇匀,用0.01mol/L的 溶液滴定至溶液呈微红色。
溶液滴定至溶液呈微红色。
步骤c:向滴定后的溶液中再加1.0gKI (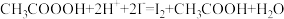 ),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂2.0mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的
),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂2.0mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的 标准溶液滴定至蓝色刚好褪去(
标准溶液滴定至蓝色刚好褪去( )。重复步骤b、步骤c三次,测得平均消耗
)。重复步骤b、步骤c三次,测得平均消耗 标准溶液的体积为20.00mLml。
标准溶液的体积为20.00mLml。
①步骤a中配制溶液A时,需要用到的玻璃仪器除烧杯、100mL容量瓶、玻璃棒和量筒外,还需要___________ 。
②设计步骤b的目的是___________ 。
③过氧乙酸的质量分数为___________ %。

(1)浓缩

在图示装置(加热装置已省略)中,由分液漏斗向冷凝管1中滴加30%
 溶液,最终得到质量分数约68%的
溶液,最终得到质量分数约68%的 溶液。
溶液。①冷凝管1、冷凝管2中进水接口依次为
②加热温度不宜超过60℃的原因是
(2)合成过氧乙酸
向带有搅拌装置及温度计的500mL三口烧瓶中先加入16g冰醋酸,在搅拌下滴加90g68%
 溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。
溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。(已知:
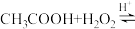

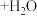 )
)①用浓缩的68%
 溶液代替常见的30%
溶液代替常见的30% 浴液的目的是
浴液的目的是②充分搅拌的目的是
(3)过氧乙酸含量的测定
步骤a:称取5.0g过氧乙酸试样(液体),配制成100mL溶液A。
步骤b:在碘量瓶中加入
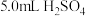 溶液、3滴
溶液、3滴 溶液、5.0mL溶液A,摇匀,用0.01mol/L的
溶液、5.0mL溶液A,摇匀,用0.01mol/L的 溶液滴定至溶液呈微红色。
溶液滴定至溶液呈微红色。步骤c:向滴定后的溶液中再加1.0gKI (
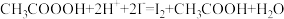 ),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂2.0mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的
),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂2.0mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的 标准溶液滴定至蓝色刚好褪去(
标准溶液滴定至蓝色刚好褪去( )。重复步骤b、步骤c三次,测得平均消耗
)。重复步骤b、步骤c三次,测得平均消耗 标准溶液的体积为20.00mLml。
标准溶液的体积为20.00mLml。①步骤a中配制溶液A时,需要用到的玻璃仪器除烧杯、100mL容量瓶、玻璃棒和量筒外,还需要
②设计步骤b的目的是
③过氧乙酸的质量分数为
您最近一年使用:0次
4 . 抗击“疫情”期间,过氧乙酸是常用的消毒剂之一,实验室拟合成过氧乙酸并测定其含量。
(1)浓缩H2O2
在图示装置(加热装置已省略)中,由分液漏斗向冷凝管1中滴加30%H2O2溶液,最终得到质量分数约68%的H2O2溶液。
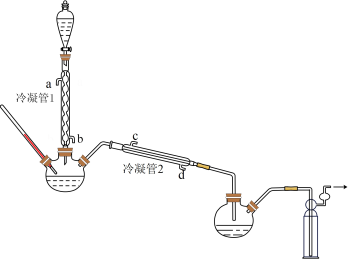
①冷凝管1、冷凝管2中进水接口依次为、___________ (填字母)。
②加热温度不宜超过60℃的原因是___________ 。
(2)合成过氧乙酸
向带有搅拌装置及温度计的500mL三口烧瓶中先加入16g冰醋酸,在搅拌下滴加90g68%H2O2溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。(已知CH3COOH+H2O2= +H2O)
+H2O)
①用浓缩的68%H2O2溶液代替常见的30%H2O2溶液的目的是___________ 。
②充分搅拌的目的是___________ 。
(3)过氧乙酸含量的测定
步骤a:称取5.0g过氧乙酸试样(液体),配制成100mL溶液A。
步骤b:在碘量瓶中加入5.0mL 溶液、3滴
溶液、3滴 溶液、5.0mL溶液A,摇匀,用0.01mol/L的
溶液、5.0mL溶液A,摇匀,用0.01mol/L的 溶液滴定至溶液呈微红色。
溶液滴定至溶液呈微红色。
步骤c:向滴定后的溶液中再加1.0gKI(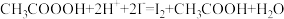 ),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的
),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的 标准溶液滴定至蓝色刚好褪去(
标准溶液滴定至蓝色刚好褪去(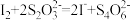 )。重复步骤b,步骤c三次,测得平均消耗
)。重复步骤b,步骤c三次,测得平均消耗 标准溶液的体积为20.00mL。
标准溶液的体积为20.00mL。
①步骤a中配制溶液A时,需要用到的玻璃仪器除烧杯、胶头滴管、玻璃棒和量筒外,还需要______ 。
②设计步骤b的目的是___________ 。
③过氧乙酸的质量分数为___________ %。
(1)浓缩H2O2
在图示装置(加热装置已省略)中,由分液漏斗向冷凝管1中滴加30%H2O2溶液,最终得到质量分数约68%的H2O2溶液。

①冷凝管1、冷凝管2中进水接口依次为、
②加热温度不宜超过60℃的原因是
(2)合成过氧乙酸
向带有搅拌装置及温度计的500mL三口烧瓶中先加入16g冰醋酸,在搅拌下滴加90g68%H2O2溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。(已知CH3COOH+H2O2=
 +H2O)
+H2O)①用浓缩的68%H2O2溶液代替常见的30%H2O2溶液的目的是
②充分搅拌的目的是
(3)过氧乙酸含量的测定
步骤a:称取5.0g过氧乙酸试样(液体),配制成100mL溶液A。
步骤b:在碘量瓶中加入5.0mL
 溶液、3滴
溶液、3滴 溶液、5.0mL溶液A,摇匀,用0.01mol/L的
溶液、5.0mL溶液A,摇匀,用0.01mol/L的 溶液滴定至溶液呈微红色。
溶液滴定至溶液呈微红色。步骤c:向滴定后的溶液中再加1.0gKI(
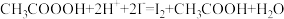 ),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的
),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的 标准溶液滴定至蓝色刚好褪去(
标准溶液滴定至蓝色刚好褪去(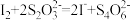 )。重复步骤b,步骤c三次,测得平均消耗
)。重复步骤b,步骤c三次,测得平均消耗 标准溶液的体积为20.00mL。
标准溶液的体积为20.00mL。①步骤a中配制溶液A时,需要用到的玻璃仪器除烧杯、胶头滴管、玻璃棒和量筒外,还需要
②设计步骤b的目的是
③过氧乙酸的质量分数为
您最近一年使用:0次
5 . 过氧乙酸是具有重要用途的有机合成氧化剂和化工原料,实验室拟合成过氧乙酸并测定其含量。
(1)浓缩
在图示装置(加热装置已省略)中,由分液漏斗向冷凝管1中滴加30% 溶液,最终得到质量分数约68%的
溶液,最终得到质量分数约68%的 溶液。
溶液。
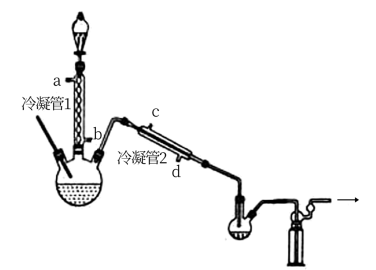
冷凝管1、冷凝管2中进水接口依次为___________ 、___________ (填字母)。
②加热温度不宜超过60℃的原因是___________ 。
(2)合成过氧乙酸
向带有搅拌装置及温度计的500mL三口烧瓶中先加入16g冰醋酸,在搅拌下滴加90g68% 溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。
溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。
(已知:CH3COOH+H2O2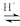
 +H2O)
+H2O)
①用浓缩的68% 溶液代替常见的30%
溶液代替常见的30% 溶液的目的是
溶液的目的是___________ 。
②充分搅拌的目的是___________ 。
(3)过氧乙酸含量的测定
步骤a:称取5.0g过氧乙酸试样(液体),配制成100mL溶液A。
步骤b:在碘量瓶中加入5.0mL 溶液、3滴
溶液、3滴 溶液、5.0mL溶液A,摇匀,用0.01mol/L的
溶液、5.0mL溶液A,摇匀,用0.01mol/L的 溶液滴定至溶液呈微红色。
溶液滴定至溶液呈微红色。
步骤c:向滴定后的溶液中再加1.0gKI(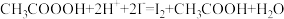 ),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的
),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的 标准溶液滴定至蓝色刚好褪去(
标准溶液滴定至蓝色刚好褪去(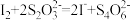 )。重复步骤b,步骤c三次,测得平均消耗
)。重复步骤b,步骤c三次,测得平均消耗 标准溶液的体积为20.00mL。
标准溶液的体积为20.00mL。
①步骤a中配制溶液A时,需要用到的玻璃仪器除烧杯、100mL容量瓶,玻璃棒和量筒外,还需要___________
②设计步骤b的目的是___________
③过氧乙酸的质量分数为___________ %。
(1)浓缩

在图示装置(加热装置已省略)中,由分液漏斗向冷凝管1中滴加30%
 溶液,最终得到质量分数约68%的
溶液,最终得到质量分数约68%的 溶液。
溶液。
冷凝管1、冷凝管2中进水接口依次为
②加热温度不宜超过60℃的原因是
(2)合成过氧乙酸
向带有搅拌装置及温度计的500mL三口烧瓶中先加入16g冰醋酸,在搅拌下滴加90g68%
 溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。
溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。(已知:CH3COOH+H2O2
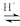
 +H2O)
+H2O)①用浓缩的68%
 溶液代替常见的30%
溶液代替常见的30% 溶液的目的是
溶液的目的是②充分搅拌的目的是
(3)过氧乙酸含量的测定
步骤a:称取5.0g过氧乙酸试样(液体),配制成100mL溶液A。
步骤b:在碘量瓶中加入5.0mL
 溶液、3滴
溶液、3滴 溶液、5.0mL溶液A,摇匀,用0.01mol/L的
溶液、5.0mL溶液A,摇匀,用0.01mol/L的 溶液滴定至溶液呈微红色。
溶液滴定至溶液呈微红色。步骤c:向滴定后的溶液中再加1.0gKI(
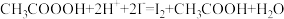 ),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的
),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的 标准溶液滴定至蓝色刚好褪去(
标准溶液滴定至蓝色刚好褪去(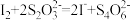 )。重复步骤b,步骤c三次,测得平均消耗
)。重复步骤b,步骤c三次,测得平均消耗 标准溶液的体积为20.00mL。
标准溶液的体积为20.00mL。①步骤a中配制溶液A时,需要用到的玻璃仪器除烧杯、100mL容量瓶,玻璃棒和量筒外,还需要
②设计步骤b的目的是
③过氧乙酸的质量分数为
您最近一年使用:0次
名校
解题方法
6 . SO2随意排放会造成严重的大气污染。下列是某小组同学设计处理烟气(主要含SO2、N2、O2、粉尘)中SO2的方法。
(1)方法一:利用氯碱工业产品处理含SO2的烟气,流程如下:
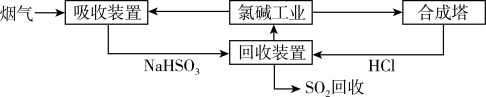
①“吸收装置”中发生反应的离子方程式是___________ 。
②合成塔中每合成1 mol气体放出热量92.3 kJ(25 ℃、101 kPa),反应的热化学方程式是___________ 。
③上述流程中循环利用的物质是___________ 。
(2)方法二:利用FeCl3溶液的氧化性吸收烟气中的SO2。
①该反应的离子方程式是___________ (反应a)。为验证该反应,同学们将SO2通入0.05 mol·L-1 FeCl3溶液中,溶液很快由黄色变为红褐色;将溶液长时间放置后,最终变为浅绿色。
关于红褐色液体,以下是同学们的分析推测与实验。
②利用胶体的___________ (填性质)可以检验步骤ⅰ中是否得到了Fe(OH)3胶体。
③根据反应b,说明步骤ⅱ中液体颜色变化的原因是___________ (用离子方程式及必要的文字说明)。
(3)制备Cl2反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,可采用酸碱中和滴定法。用___________ (填“酸式”或“碱式”)滴定管量取试样20.00 mL,用0.10 mol·L-1 NaOH标准溶液滴定,消耗22.00 mL,该次滴定测得试样中盐酸浓度为___________ mol·L-1。
(1)方法一:利用氯碱工业产品处理含SO2的烟气,流程如下:

①“吸收装置”中发生反应的离子方程式是
②合成塔中每合成1 mol气体放出热量92.3 kJ(25 ℃、101 kPa),反应的热化学方程式是
③上述流程中循环利用的物质是
(2)方法二:利用FeCl3溶液的氧化性吸收烟气中的SO2。
①该反应的离子方程式是
关于红褐色液体,以下是同学们的分析推测与实验。
| 分析推测 | 实验步骤及现象 |
| 甲:生成了Fe(OH)3胶体 乙:经查阅资料,可能发生反应:Fe3++6SO2  Fe(SO2) Fe(SO2)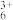 (反应b) (反应b) | ⅰ。制备Fe(OH)3胶体并检验 ⅱ。分别向Fe(OH)3胶体和该红褐色液体中加入适量铁粉,振荡后前者不变色,后者变为浅绿色 |
③根据反应b,说明步骤ⅱ中液体颜色变化的原因是
(3)制备Cl2反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,可采用酸碱中和滴定法。用
您最近一年使用:0次
7 . 尿素[CO(NH2)2]对于我国经济和社会的可持续发展具有重要意义,工业上以NH3和CO2为原料合成: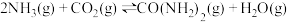 。回答下列问题:
。回答下列问题:
(1)已知上述反应的平衡常数K和温度T的关系如下表所示:
①该反应的△H_______ 0(填“>”或“<”,下同);该反应中反应物的总能量________ 生成物的总能量。
②该反应的平衡常数K的表达式为___________ 。
(2)传统的尿素生产工艺耗能较高,且产率较低。最近我国科学家发现TiO2纳米片负载的Pd-Cu合金纳米颗粒电催化剂可以将水溶液中的CO2和N2直接转化为尿素(反应机理如图所示,*表示催化剂活性中心原子)。
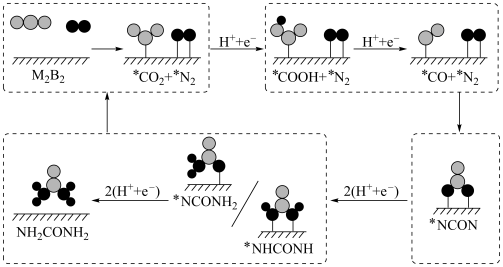
①根据以上反应机理,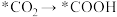 的过程发生
的过程发生_______ (填“氧化反应”或“还原反应”);断裂的是____ (填“极性键”或“非极性键”,下同),形成的是_________ 。
②与传统生产工艺相比,这种新方法的优点是___________ 。
(3)在2L的密闭容器中充入NH3和CO2模拟尿素的工业生产,测得一定温度和压强下,CO2的平衡转化率( )与氨碳比x(即NH3和CO2的物质的量之比)的关系如图所示。
)与氨碳比x(即NH3和CO2的物质的量之比)的关系如图所示。

①计算图中B点处NH3的平衡转化率为________ 。
②CO2平衡转化率随氨碳比增大而增大的原因是_________ 。
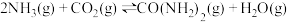 。回答下列问题:
。回答下列问题:(1)已知上述反应的平衡常数K和温度T的关系如下表所示:
| T/℃ | 165 | 175 | 185 |
| K | 111.9 | 74.1 | 50.6 |
②该反应的平衡常数K的表达式为
(2)传统的尿素生产工艺耗能较高,且产率较低。最近我国科学家发现TiO2纳米片负载的Pd-Cu合金纳米颗粒电催化剂可以将水溶液中的CO2和N2直接转化为尿素(反应机理如图所示,*表示催化剂活性中心原子)。

①根据以上反应机理,
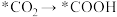 的过程发生
的过程发生②与传统生产工艺相比,这种新方法的优点是
(3)在2L的密闭容器中充入NH3和CO2模拟尿素的工业生产,测得一定温度和压强下,CO2的平衡转化率(
 )与氨碳比x(即NH3和CO2的物质的量之比)的关系如图所示。
)与氨碳比x(即NH3和CO2的物质的量之比)的关系如图所示。
①计算图中B点处NH3的平衡转化率为
②CO2平衡转化率随氨碳比增大而增大的原因是
您最近一年使用:0次
8 . 中国首次实现了利用二氧化碳人工合成淀粉,为全球的“碳达峰”、“碳中和”起到重大的支撑作用。其中最关键的一步是以CO2为原料制CH3OH。在某CO2催化加氢制CH3OH的反应体系中,发生的主要反应有:
I.CO2(g)+H2(g) CO(g)+H2O(g) ΔH1=+41.1kJ·mol-1
CO(g)+H2O(g) ΔH1=+41.1kJ·mol-1
II.CO(g)+2H2(g) CH3OH(g) ΔH2=-90.0kJ·mol-1
CH3OH(g) ΔH2=-90.0kJ·mol-1
(1)CO2(g)+3H2(g) CH3OH(g)+H2O(g)ΔH=
CH3OH(g)+H2O(g)ΔH=___ 。
(2)5Mpa时,往某密闭容器中按投料比n(H2)∶n(CO2)=3∶1充入H2和CO2。反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图1所示。
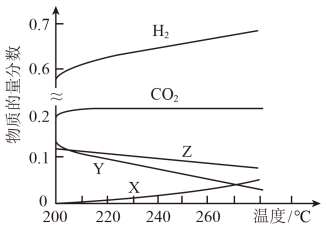
①图中X代表___ 。(填化学式)。
②体系中H2的物质的量分数随温度的增大而升高,试分析原因___ 。
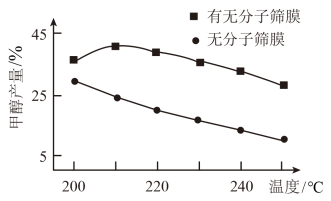
(3)H2和CO2起始物质的量比为3∶1时,该反应在有、无分子筛膜时甲醇的平衡产率随温度的变化如图2所示,其中分子筛膜能选择性分离出H2O。温度低于210℃时,随着温度升高,有分子筛膜的甲醇产率升高的可能原因是___ 。
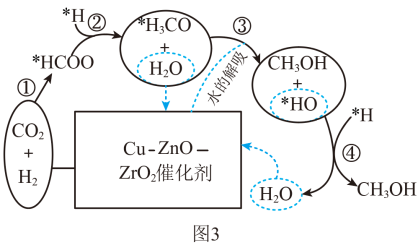
(4)我国科研人员研究出在Cu—ZnO—ZrO2催化剂上CO2氢化合成甲醇的反应历程如图3所示。反应③的化学方程式为___ ;分析在反应气中加入少量的水能够提升甲醇产率的可能原因是___ 。
I.CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH1=+41.1kJ·mol-1
CO(g)+H2O(g) ΔH1=+41.1kJ·mol-1II.CO(g)+2H2(g)
 CH3OH(g) ΔH2=-90.0kJ·mol-1
CH3OH(g) ΔH2=-90.0kJ·mol-1(1)CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)ΔH=
CH3OH(g)+H2O(g)ΔH=(2)5Mpa时,往某密闭容器中按投料比n(H2)∶n(CO2)=3∶1充入H2和CO2。反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图1所示。

①图中X代表
②体系中H2的物质的量分数随温度的增大而升高,试分析原因
(3)H2和CO2起始物质的量比为3∶1时,该反应在有、无分子筛膜时甲醇的平衡产率随温度的变化如图2所示,其中分子筛膜能选择性分离出H2O。温度低于210℃时,随着温度升高,有分子筛膜的甲醇产率升高的可能原因是

(4)我国科研人员研究出在Cu—ZnO—ZrO2催化剂上CO2氢化合成甲醇的反应历程如图3所示。反应③的化学方程式为

您最近一年使用:0次
9 . 随着科技的进步,合理利用资源保护环境成为当今社会关注的焦点。甲胺铅碘(CH3NH3PbI3)用作全固态钙钛矿敏化太阳能电池的敏化剂,可由CH3NH2、PbI2及HI为原料合成,回答下列问题:
(1)制取甲胺的反应为CH3OH(g)+NH3(g) CH3NH2(g)+H2O(g)ΔH=?已知该反应中相关化学键的键能数据如下:
CH3NH2(g)+H2O(g)ΔH=?已知该反应中相关化学键的键能数据如下:
则该反应的ΔH=_______ kJ·mol-1。
(2)上述反应中所需的甲醇工业上有多种方法合成。用电解法也可实现CO2加氢制甲醇(稀硫酸作电解质溶液)。电解时,阴极上的电极反应为_______ 。
(3)实验室可由四氧化三铅和氢碘酸反应制备难溶的PbI2,则每生成3molPbI2的反应中,转移电子的物质的量为_______ 。
(4)分解HI曲线和液相法制备HI反应曲线分别如下图1和图2所示:
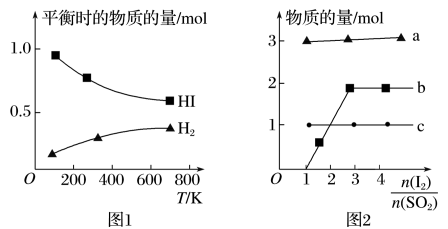
①反应H2(g)+I2(g) 2HI(g)的ΔH
2HI(g)的ΔH_______ 0(填“大于”或“小于”)。
②将二氧化硫通入碘水中会发生反应:SO2+I2+2H2O=3H++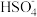 +2I-,I2+I-
+2I-,I2+I-
 ,图2中曲线c代表的微粒是
,图2中曲线c代表的微粒是_______ (填微粒符号),由图2可知,要提高碘的还原率,除控制温度外,还可以采取的措施是_______ 。
(1)制取甲胺的反应为CH3OH(g)+NH3(g)
 CH3NH2(g)+H2O(g)ΔH=?已知该反应中相关化学键的键能数据如下:
CH3NH2(g)+H2O(g)ΔH=?已知该反应中相关化学键的键能数据如下:共价键 | C-O | H-O | N-H | C-N |
键能/kJ·mol-1 | 351 | 463 | 393 | 293 |
(2)上述反应中所需的甲醇工业上有多种方法合成。用电解法也可实现CO2加氢制甲醇(稀硫酸作电解质溶液)。电解时,阴极上的电极反应为
(3)实验室可由四氧化三铅和氢碘酸反应制备难溶的PbI2,则每生成3molPbI2的反应中,转移电子的物质的量为
(4)分解HI曲线和液相法制备HI反应曲线分别如下图1和图2所示:

①反应H2(g)+I2(g)
 2HI(g)的ΔH
2HI(g)的ΔH②将二氧化硫通入碘水中会发生反应:SO2+I2+2H2O=3H++
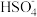 +2I-,I2+I-
+2I-,I2+I-
 ,图2中曲线c代表的微粒是
,图2中曲线c代表的微粒是
您最近一年使用:0次
10 . 以CO2和甲醇(MeOH)为原料合成碳酸二甲酯(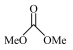 )的催化反应机理如图所示。下列说法不正确的是
)的催化反应机理如图所示。下列说法不正确的是
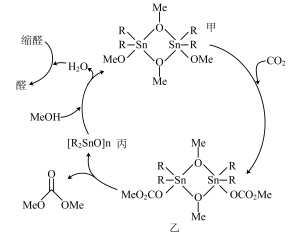
 )的催化反应机理如图所示。下列说法不正确的是
)的催化反应机理如图所示。下列说法不正确的是
A.总反应为: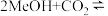 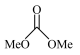 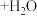 |
| B.乙是该反应的中间体 |
| C.甲→乙过程中Sn的配位数未发生改变 |
| D.加入缩醛能使总反应平衡逆向移动 |
您最近一年使用:0次



