1 . 抗击“疫情”期间,过氧乙酸是常用的消毒剂之一,实验室拟合成过氧乙酸并测定其含量。
(1)浓缩H2O2
在图示装置(加热装置已省略)中,由分液漏斗向冷凝管1中滴加30%H2O2溶液,最终得到质量分数约68%的H2O2溶液。
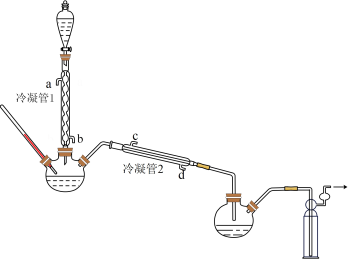
①冷凝管1、冷凝管2中进水接口依次为、___________ (填字母)。
②加热温度不宜超过60℃的原因是___________ 。
(2)合成过氧乙酸
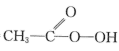
向带有搅拌装置及温度计的500mL三口烧瓶中先加入16g冰醋酸,在搅拌下滴加90g68%H2O2溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。(已知CH3COOH+H2O2= +H2O)
+H2O)
①用浓缩的68%H2O2溶液代替常见的30%H2O2溶液的目的是___________ 。
②充分搅拌的目的是___________ 。
(3)过氧乙酸含量的测定
步骤a:称取5.0g过氧乙酸试样(液体),配制成100mL溶液A。
步骤b:在碘量瓶中加入5.0mL 溶液、3滴
溶液、3滴 溶液、5.0mL溶液A,摇匀,用0.01mol/L的
溶液、5.0mL溶液A,摇匀,用0.01mol/L的 溶液滴定至溶液呈微红色。
溶液滴定至溶液呈微红色。
步骤c:向滴定后的溶液中再加1.0gKI( ),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的
),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的 标准溶液滴定至蓝色刚好褪去(
标准溶液滴定至蓝色刚好褪去( )。重复步骤b,步骤c三次,测得平均消耗
)。重复步骤b,步骤c三次,测得平均消耗 标准溶液的体积为20.00mL。
标准溶液的体积为20.00mL。
①步骤a中配制溶液A时,需要用到的玻璃仪器除烧杯、胶头滴管、玻璃棒和量筒外,还需要______ 。
②设计步骤b的目的是___________ 。
③过氧乙酸的质量分数为___________ %。
(1)浓缩H2O2
在图示装置(加热装置已省略)中,由分液漏斗向冷凝管1中滴加30%H2O2溶液,最终得到质量分数约68%的H2O2溶液。

①冷凝管1、冷凝管2中进水接口依次为、
②加热温度不宜超过60℃的原因是
(2)合成过氧乙酸
向带有搅拌装置及温度计的500mL三口烧瓶中先加入16g冰醋酸,在搅拌下滴加90g68%H2O2溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。(已知CH3COOH+H2O2=
 +H2O)
+H2O)①用浓缩的68%H2O2溶液代替常见的30%H2O2溶液的目的是
②充分搅拌的目的是
(3)过氧乙酸含量的测定
步骤a:称取5.0g过氧乙酸试样(液体),配制成100mL溶液A。
步骤b:在碘量瓶中加入5.0mL
 溶液、3滴
溶液、3滴 溶液、5.0mL溶液A,摇匀,用0.01mol/L的
溶液、5.0mL溶液A,摇匀,用0.01mol/L的 溶液滴定至溶液呈微红色。
溶液滴定至溶液呈微红色。步骤c:向滴定后的溶液中再加1.0gKI(
 ),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的
),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的 标准溶液滴定至蓝色刚好褪去(
标准溶液滴定至蓝色刚好褪去( )。重复步骤b,步骤c三次,测得平均消耗
)。重复步骤b,步骤c三次,测得平均消耗 标准溶液的体积为20.00mL。
标准溶液的体积为20.00mL。①步骤a中配制溶液A时,需要用到的玻璃仪器除烧杯、胶头滴管、玻璃棒和量筒外,还需要
②设计步骤b的目的是
③过氧乙酸的质量分数为
您最近半年使用:0次
2 . “绿水青山就是金山银山”。运用化学反应原理研究氮的化合物的反应对缓解能源危机、治理环境污染具有重要意义。
(1)基态氮原子有___________ 种能量不同的电子
(2)肼是一种高能燃料。已知各共价键键能如表:
N2H4(g)+O2(g)⇌N2(g)+2H2O(l) ∆H=___________ kJ/mol,(注:肼的结构式为: 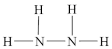 )
)
(3)目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理如图1,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2所示。
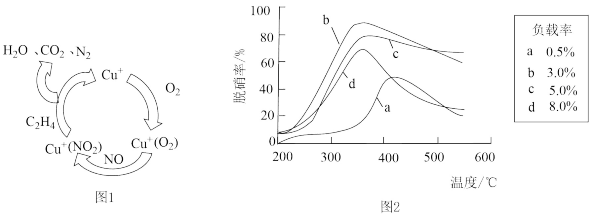
①若图1反应中NO与O2物质的量之比为2:1,则该脱硝原理总反应的化学方程式为:___________ 。
②为达到最佳的脱硝效果(分析图2),应采取的条件为___________ (填温度和负载率数值)。
(4)CaSO3与Na2SO4混合浆液可用于脱除NO2,反应过程为:
Ⅰ.CaSO3(s)+SO (aq)⇌CaSO4(s)+SO
(aq)⇌CaSO4(s)+SO (aq)
(aq)
Ⅱ.SO (aq)+2NO2(g)+H2O(l)⇌SO
(aq)+2NO2(g)+H2O(l)⇌SO (aq)+2NO
(aq)+2NO (aq)+2H+(aq)
(aq)+2H+(aq)
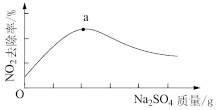
浆液中CaSO3质量一定时,Na2SO4的质量与NO2的去除率变化趋势如图所示。a点后NO2去除率降低的原因是___________ 。
(5)检测烟道气中NOx含量的步骤如下:
Ⅰ.将VL气样通入适量酸化的H2O2溶液中,使 完全被氧化为NO
完全被氧化为NO
Ⅱ.加水稀释至100.00mL,量取20.00mL该溶液,与V1mL c1 mol·L-1 FeSO4标准溶液(过量)充分混合;
Ⅲ.用c2mol·L-1 KMnO4标准溶液滴定剩余的 Fe2+,终点时消耗V2mL。
①某同学设计的如图滴定方式中,最合理的是___________ (夹持部分略去,填字母序号)
a.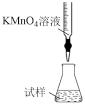 b.
b.  c.
c. 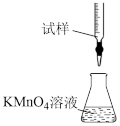
②滴定过程中有下列反应:3Fe2++NO +4H+=NO↑+3Fe3++2H2O, MnO
+4H+=NO↑+3Fe3++2H2O, MnO +5Fe2++8H+=Mn2++5Fe3++4H2O,判断下列情况对
+5Fe2++8H+=Mn2++5Fe3++4H2O,判断下列情况对 含量测定结果的影响(填“偏高”、“偏低”或“无影响”)
含量测定结果的影响(填“偏高”、“偏低”或“无影响”)
a.锥形瓶用蒸馏水洗净后没有干燥___________ 。
b.读取KMnO4标准溶液体积时,开始仰视读数,滴定结束时俯视读数___________ 。
(1)基态氮原子有
(2)肼是一种高能燃料。已知各共价键键能如表:
| N≡N | O=O | N−N | N−H | O−H | |
| 键能(kJ/mol) | 946 | 497 | 193 | 391 | 463 |
N2H4(g)+O2(g)⇌N2(g)+2H2O(l) ∆H=
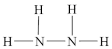 )
)(3)目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理如图1,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2所示。

①若图1反应中NO与O2物质的量之比为2:1,则该脱硝原理总反应的化学方程式为:
②为达到最佳的脱硝效果(分析图2),应采取的条件为
(4)CaSO3与Na2SO4混合浆液可用于脱除NO2,反应过程为:
Ⅰ.CaSO3(s)+SO
 (aq)⇌CaSO4(s)+SO
(aq)⇌CaSO4(s)+SO (aq)
(aq)Ⅱ.SO
 (aq)+2NO2(g)+H2O(l)⇌SO
(aq)+2NO2(g)+H2O(l)⇌SO (aq)+2NO
(aq)+2NO (aq)+2H+(aq)
(aq)+2H+(aq)浆液中CaSO3质量一定时,Na2SO4的质量与NO2的去除率变化趋势如图所示。a点后NO2去除率降低的原因是

(5)检测烟道气中NOx含量的步骤如下:
Ⅰ.将VL气样通入适量酸化的H2O2溶液中,使
 完全被氧化为NO
完全被氧化为NO
Ⅱ.加水稀释至100.00mL,量取20.00mL该溶液,与V1mL c1 mol·L-1 FeSO4标准溶液(过量)充分混合;
Ⅲ.用c2mol·L-1 KMnO4标准溶液滴定剩余的 Fe2+,终点时消耗V2mL。
①某同学设计的如图滴定方式中,最合理的是
a.
 b.
b.  c.
c. 
②滴定过程中有下列反应:3Fe2++NO
 +4H+=NO↑+3Fe3++2H2O, MnO
+4H+=NO↑+3Fe3++2H2O, MnO +5Fe2++8H+=Mn2++5Fe3++4H2O,判断下列情况对
+5Fe2++8H+=Mn2++5Fe3++4H2O,判断下列情况对 含量测定结果的影响(填“偏高”、“偏低”或“无影响”)
含量测定结果的影响(填“偏高”、“偏低”或“无影响”)a.锥形瓶用蒸馏水洗净后没有干燥
b.读取KMnO4标准溶液体积时,开始仰视读数,滴定结束时俯视读数
您最近半年使用:0次
3 . 过氧乙酸是具有重要用途的有机合成氧化剂和化工原料,实验室拟合成过氧乙酸并测定其含量。
(1)浓缩
在图示装置(加热装置已省略)中,由分液漏斗向冷凝管1中滴加30% 溶液,最终得到质量分数约68%的
溶液,最终得到质量分数约68%的 溶液。
溶液。
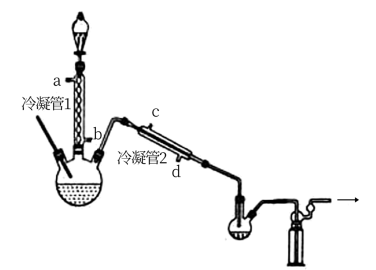
冷凝管1、冷凝管2中进水接口依次为___________ 、___________ (填字母)。
②加热温度不宜超过60℃的原因是___________ 。
(2)合成过氧乙酸
向带有搅拌装置及温度计的500mL三口烧瓶中先加入16g冰醋酸,在搅拌下滴加90g68% 溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。
溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。
(已知:CH3COOH+H2O2
 +H2O)
+H2O)
①用浓缩的68% 溶液代替常见的30%
溶液代替常见的30% 溶液的目的是
溶液的目的是___________ 。
②充分搅拌的目的是___________ 。
(3)过氧乙酸含量的测定
步骤a:称取5.0g过氧乙酸试样(液体),配制成100mL溶液A。
步骤b:在碘量瓶中加入5.0mL 溶液、3滴
溶液、3滴 溶液、5.0mL溶液A,摇匀,用0.01mol/L的
溶液、5.0mL溶液A,摇匀,用0.01mol/L的 溶液滴定至溶液呈微红色。
溶液滴定至溶液呈微红色。
步骤c:向滴定后的溶液中再加1.0gKI( ),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的
),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的 标准溶液滴定至蓝色刚好褪去(
标准溶液滴定至蓝色刚好褪去( )。重复步骤b,步骤c三次,测得平均消耗
)。重复步骤b,步骤c三次,测得平均消耗 标准溶液的体积为20.00mL。
标准溶液的体积为20.00mL。
①步骤a中配制溶液A时,需要用到的玻璃仪器除烧杯、100mL容量瓶,玻璃棒和量筒外,还需要___________
②设计步骤b的目的是___________
③过氧乙酸的质量分数为___________ %。
(1)浓缩

在图示装置(加热装置已省略)中,由分液漏斗向冷凝管1中滴加30%
 溶液,最终得到质量分数约68%的
溶液,最终得到质量分数约68%的 溶液。
溶液。
冷凝管1、冷凝管2中进水接口依次为
②加热温度不宜超过60℃的原因是
(2)合成过氧乙酸
向带有搅拌装置及温度计的500mL三口烧瓶中先加入16g冰醋酸,在搅拌下滴加90g68%
 溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。
溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。(已知:CH3COOH+H2O2
 +H2O)
+H2O)①用浓缩的68%
 溶液代替常见的30%
溶液代替常见的30% 溶液的目的是
溶液的目的是②充分搅拌的目的是
(3)过氧乙酸含量的测定
步骤a:称取5.0g过氧乙酸试样(液体),配制成100mL溶液A。
步骤b:在碘量瓶中加入5.0mL
 溶液、3滴
溶液、3滴 溶液、5.0mL溶液A,摇匀,用0.01mol/L的
溶液、5.0mL溶液A,摇匀,用0.01mol/L的 溶液滴定至溶液呈微红色。
溶液滴定至溶液呈微红色。步骤c:向滴定后的溶液中再加1.0gKI(
 ),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的
),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的 标准溶液滴定至蓝色刚好褪去(
标准溶液滴定至蓝色刚好褪去( )。重复步骤b,步骤c三次,测得平均消耗
)。重复步骤b,步骤c三次,测得平均消耗 标准溶液的体积为20.00mL。
标准溶液的体积为20.00mL。①步骤a中配制溶液A时,需要用到的玻璃仪器除烧杯、100mL容量瓶,玻璃棒和量筒外,还需要
②设计步骤b的目的是
③过氧乙酸的质量分数为
您最近半年使用:0次
4 . 过氧乙酸是具有重要用途的有机合成氧化剂和化工原料,实验室拟合成过氧乙酸并测定其含量。
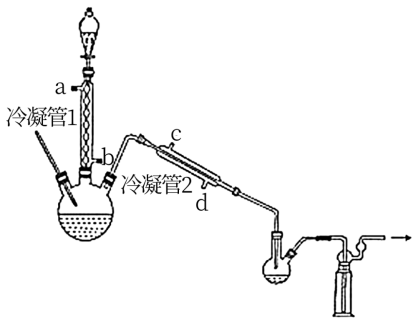
(1)浓缩H2O2
在图示装置(加热装置已省略)中,由分液漏斗向冷凝管1中滴加30% H2O2溶液,最终得到质量分数约68%的H2O2溶液。
①冷凝管1、冷凝管2中进水接口依次为___ 、___ 。(填字母)
②加热温度不宜超过60℃的原因是___ 。
(2)合成过氧乙酸
向带有搅拌装置及温度计的500mL三口烧瓶中先加入16g冰醋酸,在搅拌下滴加90g68%H2O2溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。
(已知:CH3COOH+H2O2
 +H2O)
+H2O)
①用浓缩的68%H2O2溶液代替常见的30%H2O2溶液的目的是___ ;浓硫酸的作用是___ 。
②充分搅拌的目的是___ 。
(3)过氧乙酸含量的测定
步骤a:称取5.0g过氧乙酸试样(液体),配制成100mL溶液A。
步骤b:在碘量瓶中加入5.0mLH2SO4溶液、3滴MnSO4溶液、5.0mL溶液A,摇匀,用0.01mol•L-1的KMnO4溶液滴定至溶液呈微红色。
步骤c:向滴定后的溶液中再加1.0gKI(CH3COOOH+2H++2I-=I2+CH3COOH+H2O),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂2.0mL,摇匀,用淀粉溶液作指示剂,用0.05mol•L-1的Na2S2O3标准溶液滴定至蓝色刚好褪去(I2+2S2O =2I-+S4O
=2I-+S4O )。重复步骤b、步骤c三次,测得平均消耗Na2S2O3标准溶液的体积为20.00mL。
)。重复步骤b、步骤c三次,测得平均消耗Na2S2O3标准溶液的体积为20.00mL。
①步骤a中配制溶液A时,需要用到的玻璃仪器除烧杯、100mL容量瓶、玻璃棒和量筒外,还需要____ 。
②设计步骤b的目的是___ 。
③过氧乙酸的质量分数为___ %。

(1)浓缩H2O2
在图示装置(加热装置已省略)中,由分液漏斗向冷凝管1中滴加30% H2O2溶液,最终得到质量分数约68%的H2O2溶液。
①冷凝管1、冷凝管2中进水接口依次为
②加热温度不宜超过60℃的原因是
(2)合成过氧乙酸
向带有搅拌装置及温度计的500mL三口烧瓶中先加入16g冰醋酸,在搅拌下滴加90g68%H2O2溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。
(已知:CH3COOH+H2O2
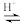
 +H2O)
+H2O)①用浓缩的68%H2O2溶液代替常见的30%H2O2溶液的目的是
②充分搅拌的目的是
(3)过氧乙酸含量的测定
步骤a:称取5.0g过氧乙酸试样(液体),配制成100mL溶液A。
步骤b:在碘量瓶中加入5.0mLH2SO4溶液、3滴MnSO4溶液、5.0mL溶液A,摇匀,用0.01mol•L-1的KMnO4溶液滴定至溶液呈微红色。
步骤c:向滴定后的溶液中再加1.0gKI(CH3COOOH+2H++2I-=I2+CH3COOH+H2O),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂2.0mL,摇匀,用淀粉溶液作指示剂,用0.05mol•L-1的Na2S2O3标准溶液滴定至蓝色刚好褪去(I2+2S2O
 =2I-+S4O
=2I-+S4O )。重复步骤b、步骤c三次,测得平均消耗Na2S2O3标准溶液的体积为20.00mL。
)。重复步骤b、步骤c三次,测得平均消耗Na2S2O3标准溶液的体积为20.00mL。①步骤a中配制溶液A时,需要用到的玻璃仪器除烧杯、100mL容量瓶、玻璃棒和量筒外,还需要
②设计步骤b的目的是
③过氧乙酸的质量分数为
您最近半年使用:0次
5 . 过氧乙酸是具有重要用途的有机合成氧化剂和化工原料,实验室拟合成过氧乙酸并测定其含量。
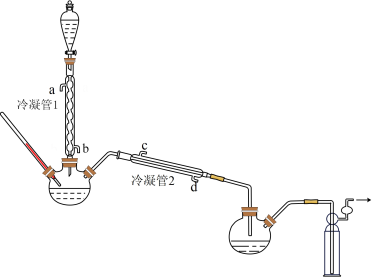
(1)浓缩
在图示装置(加热装置已省略)中,由分液漏斗向冷凝管1中滴加30% 溶液,最终得到质量分数约68%的
溶液,最终得到质量分数约68%的 溶液。
溶液。
①冷凝管1、冷凝管2中进水接口依次为___________ 、___________ (填字母);冷凝效果更好的是___________ (填“冷凝管1”或“冷凝管2”)。
②加热温度不宜超过60℃的原因是___________ 。
(2)合成过氧乙酸
向带有搅拌装置及温度计的500mL三口烧瓶中先加入16g冰醋酸,在搅拌下滴加90g68% 溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。
溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。
(已知: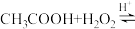

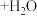 )
)
①用浓缩的68% 溶液代替常见的30%
溶液代替常见的30% 浴液的目的是
浴液的目的是___________ ;浓硫酸的作用是___________ 。
②充分搅拌的目的是___________ 。
(3)过氧乙酸含量的测定
步骤a:称取5.0g过氧乙酸试样(液体),配制成100mL溶液A。
步骤b:在碘量瓶中加入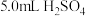 溶液、3滴
溶液、3滴 溶液、5.0mL溶液A,摇匀,用0.01mol/L的
溶液、5.0mL溶液A,摇匀,用0.01mol/L的 溶液滴定至溶液呈微红色。
溶液滴定至溶液呈微红色。
步骤c:向滴定后的溶液中再加1.0gKI ( ),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂2.0mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的
),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂2.0mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的 标准溶液滴定至蓝色刚好褪去(
标准溶液滴定至蓝色刚好褪去( )。重复步骤b、步骤c三次,测得平均消耗
)。重复步骤b、步骤c三次,测得平均消耗 标准溶液的体积为20.00mLml。
标准溶液的体积为20.00mLml。
①步骤a中配制溶液A时,需要用到的玻璃仪器除烧杯、100mL容量瓶、玻璃棒和量筒外,还需要___________ 。
②设计步骤b的目的是___________ 。
③过氧乙酸的质量分数为___________ %。

(1)浓缩

在图示装置(加热装置已省略)中,由分液漏斗向冷凝管1中滴加30%
 溶液,最终得到质量分数约68%的
溶液,最终得到质量分数约68%的 溶液。
溶液。①冷凝管1、冷凝管2中进水接口依次为
②加热温度不宜超过60℃的原因是
(2)合成过氧乙酸
向带有搅拌装置及温度计的500mL三口烧瓶中先加入16g冰醋酸,在搅拌下滴加90g68%
 溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。
溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。(已知:
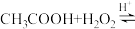

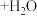 )
)①用浓缩的68%
 溶液代替常见的30%
溶液代替常见的30% 浴液的目的是
浴液的目的是②充分搅拌的目的是
(3)过氧乙酸含量的测定
步骤a:称取5.0g过氧乙酸试样(液体),配制成100mL溶液A。
步骤b:在碘量瓶中加入
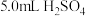 溶液、3滴
溶液、3滴 溶液、5.0mL溶液A,摇匀,用0.01mol/L的
溶液、5.0mL溶液A,摇匀,用0.01mol/L的 溶液滴定至溶液呈微红色。
溶液滴定至溶液呈微红色。步骤c:向滴定后的溶液中再加1.0gKI (
 ),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂2.0mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的
),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂2.0mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的 标准溶液滴定至蓝色刚好褪去(
标准溶液滴定至蓝色刚好褪去( )。重复步骤b、步骤c三次,测得平均消耗
)。重复步骤b、步骤c三次,测得平均消耗 标准溶液的体积为20.00mLml。
标准溶液的体积为20.00mLml。①步骤a中配制溶液A时,需要用到的玻璃仪器除烧杯、100mL容量瓶、玻璃棒和量筒外,还需要
②设计步骤b的目的是
③过氧乙酸的质量分数为
您最近半年使用:0次
6 . 自然界中锰是含量较高的元素,分布在海洋深处与地壳中,它有多种化合价,如KMnO4(Ⅶ)、K2MnO4(Ⅵ)、MnO2(Ⅳ)等具有氧化性,MnSO4(Ⅱ)等具有还原性。
(1)工业上常用锰酸钾溶液电解制备高锰酸钾,写出离子方程式___ 。
(2)某兴趣小组用KMnO4滴定法测定补铁剂乳酸亚铁{[CH3CH(OH)COO]2Fe}中Fe2+含量进而计算产品中乳酸亚铁的质量分数。
①结果测得产品的质量分数总是大于100%,其原因可能是___ 。
②在滴定的时候发现,一开始反应很慢,一段时间后,反应速率迅速加快,产生该现象的原因可能是___ ;验证的实验方法是___ 。
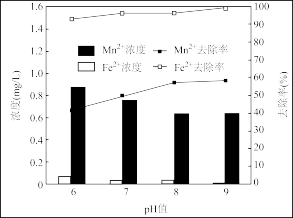
(3)地下水中往往铁锰元素含量超标,常以Fe2+、Mn2+形式存在,可用ClO2水溶液去除铁、锰元素。随ClO2浓度、pH的增加,铁锰去除率或浓度变化曲线如图:
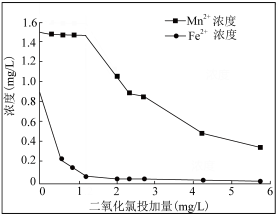
已知:1.碱性越大,Mn2+越易被氧化为MnO2,MnO2水合物可吸附Mn2+
2.ClO2易溶于水,不与水反应,消毒中常用作杀菌剂并转化为Cl-,碱性会歧化为ClO 和ClO
和ClO
①ClO2投加1.2mg前后,去除铁锰情况如图的原因是___ 。
②pH6~8锰去除率增大,其原因是___ 。
(1)工业上常用锰酸钾溶液电解制备高锰酸钾,写出离子方程式
(2)某兴趣小组用KMnO4滴定法测定补铁剂乳酸亚铁{[CH3CH(OH)COO]2Fe}中Fe2+含量进而计算产品中乳酸亚铁的质量分数。
①结果测得产品的质量分数总是大于100%,其原因可能是
②在滴定的时候发现,一开始反应很慢,一段时间后,反应速率迅速加快,产生该现象的原因可能是
(3)地下水中往往铁锰元素含量超标,常以Fe2+、Mn2+形式存在,可用ClO2水溶液去除铁、锰元素。随ClO2浓度、pH的增加,铁锰去除率或浓度变化曲线如图:

已知:1.碱性越大,Mn2+越易被氧化为MnO2,MnO2水合物可吸附Mn2+
2.ClO2易溶于水,不与水反应,消毒中常用作杀菌剂并转化为Cl-,碱性会歧化为ClO
 和ClO
和ClO
①ClO2投加1.2mg前后,去除铁锰情况如图的原因是
②pH6~8锰去除率增大,其原因是

您最近半年使用:0次
2021-05-19更新
|
367次组卷
|
2卷引用:江苏省(天一中学.海门中学.姜堰中学.淮阴中学)四校2021届高三4月联考化学试题
7 . 选择性催化还原法 是常用的氮氧化物
是常用的氮氧化物 的净化方法,原理是用
的净化方法,原理是用 在特定催化剂作用下将
在特定催化剂作用下将 ,还原为
,还原为 .
.
反应Ⅰ:
反应Ⅱ: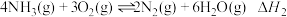
(1)反应Ⅱ_______ 反应Ⅰ(填“有利于”或“不利于”)中 的净化;一定温度和压强下,为了提高
的净化;一定温度和压强下,为了提高 的净化速率,可采取的最合理的措施是
的净化速率,可采取的最合理的措施是__________ .
(2) 是
是 催化剂的活性组分.在反应器中以一定流速通过烟气
催化剂的活性组分.在反应器中以一定流速通过烟气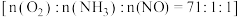 ,在不同温度下进行该催化还原反应,
,在不同温度下进行该催化还原反应, 的质量分数对单位时间内
的质量分数对单位时间内 去除率的影响如图所示.
去除率的影响如图所示.
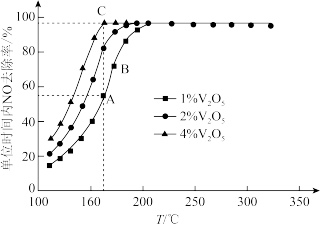
①下列说法中正确的是_________ (填标号).
A.该催化剂能加快反应速率,但不能改变反应的焓变
B.状态A时保持其他条件不变减小压强,能增大单位时间 的去除率
的去除率
C.状态B时选择合适催化剂,可以提高相同时间内 的去除率
的去除率
D. 的质量分数越高,催化剂的活性越好
的质量分数越高,催化剂的活性越好
E.该催化剂具有选择性,能降低特定反应的活化能
②从起始至对应A、B、C三点的平均反应速率由大到小的顺序为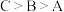 ,原因是
,原因是_________________ .
③若烟气中 含量一定,在催化剂适宜温度范围内,当
含量一定,在催化剂适宜温度范围内,当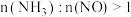 时,随着该比值的增大,
时,随着该比值的增大, 去除率无明显变化,可能的原因是
去除率无明显变化,可能的原因是______________________ .
(3)一定温度下,向 密闭刚性容器(含催化剂)中投入
密闭刚性容器(含催化剂)中投入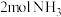 和
和 ,发生反应
,发生反应 .达到平衡状态时,
.达到平衡状态时, 的转化率为60%,此时再加入
的转化率为60%,此时再加入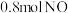 和
和 ,则反应速率
,则反应速率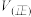
______ 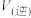 (填“大于”、“小于”、“等于”).
(填“大于”、“小于”、“等于”).
 是常用的氮氧化物
是常用的氮氧化物 的净化方法,原理是用
的净化方法,原理是用 在特定催化剂作用下将
在特定催化剂作用下将 ,还原为
,还原为 .
.反应Ⅰ:

反应Ⅱ:
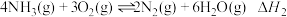
(1)反应Ⅱ
 的净化;一定温度和压强下,为了提高
的净化;一定温度和压强下,为了提高 的净化速率,可采取的最合理的措施是
的净化速率,可采取的最合理的措施是(2)
 是
是 催化剂的活性组分.在反应器中以一定流速通过烟气
催化剂的活性组分.在反应器中以一定流速通过烟气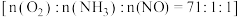 ,在不同温度下进行该催化还原反应,
,在不同温度下进行该催化还原反应, 的质量分数对单位时间内
的质量分数对单位时间内 去除率的影响如图所示.
去除率的影响如图所示.
①下列说法中正确的是
A.该催化剂能加快反应速率,但不能改变反应的焓变
B.状态A时保持其他条件不变减小压强,能增大单位时间
 的去除率
的去除率C.状态B时选择合适催化剂,可以提高相同时间内
 的去除率
的去除率D.
 的质量分数越高,催化剂的活性越好
的质量分数越高,催化剂的活性越好E.该催化剂具有选择性,能降低特定反应的活化能
②从起始至对应A、B、C三点的平均反应速率由大到小的顺序为
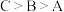 ,原因是
,原因是③若烟气中
 含量一定,在催化剂适宜温度范围内,当
含量一定,在催化剂适宜温度范围内,当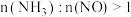 时,随着该比值的增大,
时,随着该比值的增大, 去除率无明显变化,可能的原因是
去除率无明显变化,可能的原因是(3)一定温度下,向
 密闭刚性容器(含催化剂)中投入
密闭刚性容器(含催化剂)中投入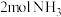 和
和 ,发生反应
,发生反应 .达到平衡状态时,
.达到平衡状态时, 的转化率为60%,此时再加入
的转化率为60%,此时再加入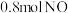 和
和 ,则反应速率
,则反应速率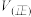
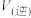 (填“大于”、“小于”、“等于”).
(填“大于”、“小于”、“等于”).
您最近半年使用:0次
2021-04-10更新
|
591次组卷
|
2卷引用:辽宁省沈阳市(东北三省四城市)2021届高考二模(高三质量监测二)化学试题
名校
8 . 硫酰氯(SO2Cl2)可用于有机合成和药物制造等。实验室利用SO2和Cl2在活性炭作用下制取SO2Cl2[SO2(g)+Cl2(g) SO2Cl2(l) ΔH=-97.3kJ/mol],装置如图所示(部分装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,有强腐蚀性,不宜接触碱、醇、纤维素等许多无机物和有机物,遇水能发生剧烈反应并产生白雾。回答下列问题:
SO2Cl2(l) ΔH=-97.3kJ/mol],装置如图所示(部分装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,有强腐蚀性,不宜接触碱、醇、纤维素等许多无机物和有机物,遇水能发生剧烈反应并产生白雾。回答下列问题:
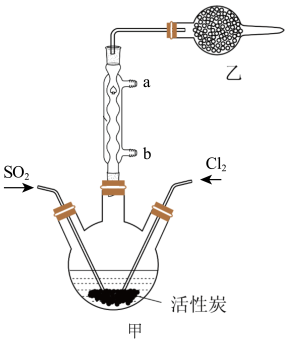
I.SO2Cl2的制备
(1)水应从___ (选填“a”或“b”)口进入。
(2)制取SO2的最佳组合是___ (填标号)。
①Fe+18.4mol/LH2SO4
②Na2SO3+70%H2SO4
③Na2SO3+3mo/LHNO3
(3)乙装置中盛放的试剂是___ 。
(4)制备过程中需要将装置甲置于冰水浴中,原因是___ 。
(5)反应结束后,分离甲中混合物的最佳实验操作是___ 。
II.测定产品中SO2Cl2的含量,实验步骤如下:
①取1.5g产品加入足量Ba(OH)2溶液,充分振荡、过滤、洗涤,将所得溶液均放入锥形瓶中;
②向锥形瓶中加入硝酸酸化,再加入0.2000mol·L-1的AgNO3溶液l00.00mL;
③向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖;
④加入NH4Fe(SO4)2指示剂,用0.1000mol·L-1NH4SCN溶液滴定过量Ag+,终点所用体积为10.00mL。
已知:Ksp(AgCl)=3.2×10-10 Ksp(AgSCN)=2×10-12
(6)滴定终点的现象为___ 。
(7)产品中SO2Cl2的质量分数为___ %,若步骤③不加入硝基苯则所测SO2Cl2含量将___ (填“偏高”、“偏低”或“无影响”)。
 SO2Cl2(l) ΔH=-97.3kJ/mol],装置如图所示(部分装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,有强腐蚀性,不宜接触碱、醇、纤维素等许多无机物和有机物,遇水能发生剧烈反应并产生白雾。回答下列问题:
SO2Cl2(l) ΔH=-97.3kJ/mol],装置如图所示(部分装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,有强腐蚀性,不宜接触碱、醇、纤维素等许多无机物和有机物,遇水能发生剧烈反应并产生白雾。回答下列问题:
I.SO2Cl2的制备
(1)水应从
(2)制取SO2的最佳组合是
①Fe+18.4mol/LH2SO4
②Na2SO3+70%H2SO4
③Na2SO3+3mo/LHNO3
(3)乙装置中盛放的试剂是
(4)制备过程中需要将装置甲置于冰水浴中,原因是
(5)反应结束后,分离甲中混合物的最佳实验操作是
II.测定产品中SO2Cl2的含量,实验步骤如下:
①取1.5g产品加入足量Ba(OH)2溶液,充分振荡、过滤、洗涤,将所得溶液均放入锥形瓶中;
②向锥形瓶中加入硝酸酸化,再加入0.2000mol·L-1的AgNO3溶液l00.00mL;
③向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖;
④加入NH4Fe(SO4)2指示剂,用0.1000mol·L-1NH4SCN溶液滴定过量Ag+,终点所用体积为10.00mL。
已知:Ksp(AgCl)=3.2×10-10 Ksp(AgSCN)=2×10-12
(6)滴定终点的现象为
(7)产品中SO2Cl2的质量分数为
您最近半年使用:0次
2019-12-10更新
|
482次组卷
|
3卷引用:陕西省西安市长安区第一中学2020-2021学年高三第七次质量检测理综化学试题
名校
9 . 过氧乙酸(CH3CO3H)是一种广谱高效消毒剂,不稳定、易分解,高浓度易爆炸。常用于空气、器材的消毒,可由乙酸与H2O2在硫酸催化下反应制得,热化学方程式为:CH3COOH(aq)+H2O2(aq) CH3CO3H(aq) + H2O(1) △H=-13.7kJ/mol
CH3CO3H(aq) + H2O(1) △H=-13.7kJ/mol
(1)利用上述反应制备760g CHCOH,放出的热量为_______ kJ。
(2)取质量相等的冰醋酸和50% H2O2溶液混合均匀,在一定量硫酸催化下进行如下实验。
实验1:在25℃下,测定不同时间所得溶液中过氧乙酸的质量分数。数据如图1所示。
实验2:在不同温度下反应(反应均未达到平衡),测定24小时所得溶液中过氧乙酸的质量分数。数据如图2所示。
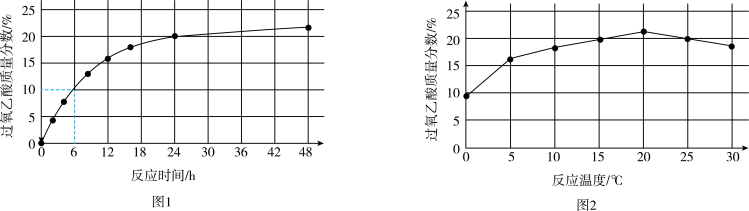 ①实验1中,若反应混合液的总质量为m g,依据图1数据计算,在0~6h间,v(CH3CO3H)=
①实验1中,若反应混合液的总质量为m g,依据图1数据计算,在0~6h间,v(CH3CO3H)=_____ g/h。(用含m的代数式表示)
②综合图1、图2分析,与20℃相比,25℃时过氧乙酸产率降低的可能原因是_______ (写出2条)。
(3)SV-1、SV-2是两种常用于实验研究的病毒,粒径分别为40nm和70nm。病毒在水中可能会聚集成团簇。不同pH下,病毒团簇粒径及过氧乙酸对两种病毒的相对杀灭速率分别如图3、图4所示。
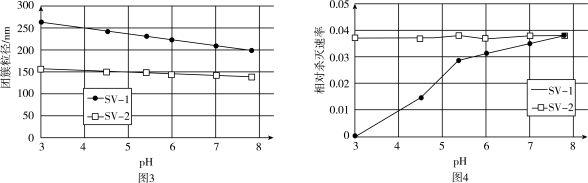
依据图3、图4分析,过氧乙酸对SV-1的杀灭速率随pH增大而增大的原因可能是___________ 。
 CH3CO3H(aq) + H2O(1) △H=-13.7kJ/mol
CH3CO3H(aq) + H2O(1) △H=-13.7kJ/mol(1)利用上述反应制备760g CHCOH,放出的热量为
(2)取质量相等的冰醋酸和50% H2O2溶液混合均匀,在一定量硫酸催化下进行如下实验。
实验1:在25℃下,测定不同时间所得溶液中过氧乙酸的质量分数。数据如图1所示。
实验2:在不同温度下反应(反应均未达到平衡),测定24小时所得溶液中过氧乙酸的质量分数。数据如图2所示。
 ①实验1中,若反应混合液的总质量为m g,依据图1数据计算,在0~6h间,v(CH3CO3H)=
①实验1中,若反应混合液的总质量为m g,依据图1数据计算,在0~6h间,v(CH3CO3H)=②综合图1、图2分析,与20℃相比,25℃时过氧乙酸产率降低的可能原因是
(3)SV-1、SV-2是两种常用于实验研究的病毒,粒径分别为40nm和70nm。病毒在水中可能会聚集成团簇。不同pH下,病毒团簇粒径及过氧乙酸对两种病毒的相对杀灭速率分别如图3、图4所示。

依据图3、图4分析,过氧乙酸对SV-1的杀灭速率随pH增大而增大的原因可能是
您最近半年使用:0次
18-19高二上·黑龙江·阶段练习
名校
解题方法
10 . 在一密闭容器中,反应 达到平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法正确的是
达到平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法正确的是
 达到平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法正确的是
达到平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法正确的是| A.平衡向逆反应方向移动了 | B.物质A的转化率减小了 |
| C.物质B的质量分数增大了 | D. |
您最近半年使用:0次
2023-11-14更新
|
357次组卷
|
25卷引用:【浙江新东方】双师118
(已下线)【浙江新东方】双师118安徽省淮北市树人高级中学2020-2021学年高二上学期第一次联考化学试题天津市武清区梅厂中学2021-2022学年高二上学期阶段性练习化学试题广西百色中学2021-2022学年高二上学期第一次月考化学试题黑龙江省哈尔滨市依兰县高级中学2021-2022学年高二上学期第一次月考化学试题天津市外国语大学附属外国语学校2021-2022学年高二上学期期中阶段性检测化学试题黑龙江省伊春市伊美区第二中学2018-2019学年高二上学期阶段考试(12月)化学试题黑龙江省大庆市东风中学2021-2022学年高二下学期开学考试化学试题黑龙江省绥化市第一中学2021-2022学年高二上学期期末考试化学试题吉林省长春希望高中2021-2022学年高二上学期期末考试化学试题广西桂林市第十八中学2021-2022学年高二下学期开学考试化学试题天津市第二南开学校2022-2023学年高二上学期9月阶段性线上练习化学试题 天津市宁河区芦台第一中学2022-2023学年高二上学期第一次学习诊断化学试题浙江省金华第一中学2022-2023学年高一下学期6月期末化学试题宁夏回族自治区中宁县第一中学2022-2023学年高二上学期10月月考化学试题山西省太原市第五中学校2023-2024学年高二上学期10月月考化学试题浙江省浙东北联盟(ZDB)2023-2024学年高二上学期期中考试化学试题北京师范大学附属实验中学2023-2024学年高二上学期期中考试化学试题 北京师范大学附属实验中学2023-2024学年高二上学期期中考试化学试题(已下线)寒假作业03 化学平衡-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)新疆石河子第一中学2023-2024学年高二上学期11月月考化学试题北京师范大学附属实验中学2023-2024学年高二上学期期中考试化学试题河北省石家庄市第十五中学2023-2024学年高二上学期12月阶段考试化学试题安徽省阜阳市临泉第一中学(高铁分校)2023-2024学年高二上学期期末考试化学试题广东省汕头市潮阳区河溪中学2023-2024学年高二上学期月考化学试题



