1 . 过氧乙酸是具有重要用途的有机合成氧化剂和化工原料,实验室拟合成过氧乙酸并测定其含量。
(1)浓缩
在图示装置(加热装置已省略)中,由分液漏斗向冷凝管1中滴加30% 溶液,最终得到质量分数约68%的
溶液,最终得到质量分数约68%的 溶液。
溶液。
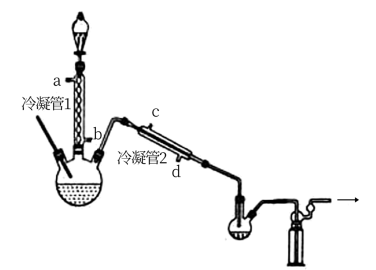
冷凝管1、冷凝管2中进水接口依次为___________ 、___________ (填字母)。
②加热温度不宜超过60℃的原因是___________ 。
(2)合成过氧乙酸
向带有搅拌装置及温度计的500mL三口烧瓶中先加入16g冰醋酸,在搅拌下滴加90g68% 溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。
溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。
(已知:CH3COOH+H2O2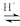
 +H2O)
+H2O)
①用浓缩的68% 溶液代替常见的30%
溶液代替常见的30% 溶液的目的是
溶液的目的是___________ 。
②充分搅拌的目的是___________ 。
(3)过氧乙酸含量的测定
步骤a:称取5.0g过氧乙酸试样(液体),配制成100mL溶液A。
步骤b:在碘量瓶中加入5.0mL 溶液、3滴
溶液、3滴 溶液、5.0mL溶液A,摇匀,用0.01mol/L的
溶液、5.0mL溶液A,摇匀,用0.01mol/L的 溶液滴定至溶液呈微红色。
溶液滴定至溶液呈微红色。
步骤c:向滴定后的溶液中再加1.0gKI(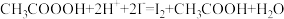 ),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的
),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的 标准溶液滴定至蓝色刚好褪去(
标准溶液滴定至蓝色刚好褪去(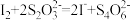 )。重复步骤b,步骤c三次,测得平均消耗
)。重复步骤b,步骤c三次,测得平均消耗 标准溶液的体积为20.00mL。
标准溶液的体积为20.00mL。
①步骤a中配制溶液A时,需要用到的玻璃仪器除烧杯、100mL容量瓶,玻璃棒和量筒外,还需要___________
②设计步骤b的目的是___________
③过氧乙酸的质量分数为___________ %。
(1)浓缩

在图示装置(加热装置已省略)中,由分液漏斗向冷凝管1中滴加30%
 溶液,最终得到质量分数约68%的
溶液,最终得到质量分数约68%的 溶液。
溶液。
冷凝管1、冷凝管2中进水接口依次为
②加热温度不宜超过60℃的原因是
(2)合成过氧乙酸
向带有搅拌装置及温度计的500mL三口烧瓶中先加入16g冰醋酸,在搅拌下滴加90g68%
 溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。
溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。(已知:CH3COOH+H2O2
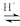
 +H2O)
+H2O)①用浓缩的68%
 溶液代替常见的30%
溶液代替常见的30% 溶液的目的是
溶液的目的是②充分搅拌的目的是
(3)过氧乙酸含量的测定
步骤a:称取5.0g过氧乙酸试样(液体),配制成100mL溶液A。
步骤b:在碘量瓶中加入5.0mL
 溶液、3滴
溶液、3滴 溶液、5.0mL溶液A,摇匀,用0.01mol/L的
溶液、5.0mL溶液A,摇匀,用0.01mol/L的 溶液滴定至溶液呈微红色。
溶液滴定至溶液呈微红色。步骤c:向滴定后的溶液中再加1.0gKI(
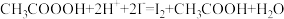 ),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的
),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的 标准溶液滴定至蓝色刚好褪去(
标准溶液滴定至蓝色刚好褪去(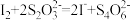 )。重复步骤b,步骤c三次,测得平均消耗
)。重复步骤b,步骤c三次,测得平均消耗 标准溶液的体积为20.00mL。
标准溶液的体积为20.00mL。①步骤a中配制溶液A时,需要用到的玻璃仪器除烧杯、100mL容量瓶,玻璃棒和量筒外,还需要
②设计步骤b的目的是
③过氧乙酸的质量分数为
您最近一年使用:0次
2 . 自然界中锰是含量较高的元素,分布在海洋深处与地壳中,它有多种化合价,如KMnO4(Ⅶ)、K2MnO4(Ⅵ)、MnO2(Ⅳ)等具有氧化性,MnSO4(Ⅱ)等具有还原性。
(1)工业上常用锰酸钾溶液电解制备高锰酸钾,写出离子方程式___ 。
(2)某兴趣小组用KMnO4滴定法测定补铁剂乳酸亚铁{[CH3CH(OH)COO]2Fe}中Fe2+含量进而计算产品中乳酸亚铁的质量分数。
①结果测得产品的质量分数总是大于100%,其原因可能是___ 。
②在滴定的时候发现,一开始反应很慢,一段时间后,反应速率迅速加快,产生该现象的原因可能是___ ;验证的实验方法是___ 。
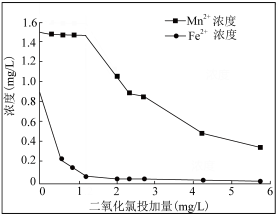
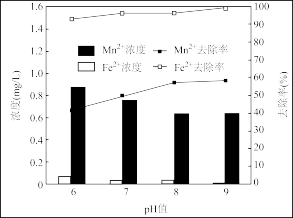
(3)地下水中往往铁锰元素含量超标,常以Fe2+、Mn2+形式存在,可用ClO2水溶液去除铁、锰元素。随ClO2浓度、pH的增加,铁锰去除率或浓度变化曲线如图:
已知:1.碱性越大,Mn2+越易被氧化为MnO2,MnO2水合物可吸附Mn2+
2.ClO2易溶于水,不与水反应,消毒中常用作杀菌剂并转化为Cl-,碱性会歧化为ClO 和ClO
和ClO
①ClO2投加1.2mg前后,去除铁锰情况如图的原因是___ 。
②pH6~8锰去除率增大,其原因是___ 。
(1)工业上常用锰酸钾溶液电解制备高锰酸钾,写出离子方程式
(2)某兴趣小组用KMnO4滴定法测定补铁剂乳酸亚铁{[CH3CH(OH)COO]2Fe}中Fe2+含量进而计算产品中乳酸亚铁的质量分数。
①结果测得产品的质量分数总是大于100%,其原因可能是
②在滴定的时候发现,一开始反应很慢,一段时间后,反应速率迅速加快,产生该现象的原因可能是
(3)地下水中往往铁锰元素含量超标,常以Fe2+、Mn2+形式存在,可用ClO2水溶液去除铁、锰元素。随ClO2浓度、pH的增加,铁锰去除率或浓度变化曲线如图:

已知:1.碱性越大,Mn2+越易被氧化为MnO2,MnO2水合物可吸附Mn2+
2.ClO2易溶于水,不与水反应,消毒中常用作杀菌剂并转化为Cl-,碱性会歧化为ClO
 和ClO
和ClO
①ClO2投加1.2mg前后,去除铁锰情况如图的原因是
②pH6~8锰去除率增大,其原因是

您最近一年使用:0次
2021-05-19更新
|
368次组卷
|
2卷引用:江苏省(天一中学.海门中学.姜堰中学.淮阴中学)四校2021届高三4月联考化学试题
3 . 四氧化三铅(化学式可以写为2PbO·PbO2)被广泛用作防锈漆成分。测定某样品中四氧化三铅含量的步骤如下(样品中杂质均不参与反应):
Ⅰ.称取ag样品,加酸溶解,滤去不溶物,所有的铅元素进入溶液中并得到含有Pb2+的溶液。
Ⅱ.加入过量K2Cr2O7溶液,加热,生成黄色沉淀(PbCrO4),冷却,过滤。
Ⅲ.将沉淀全部转移至仪器A中,加入浓HCl,沉淀溶解,溶液转为橙色。
Ⅳ.加入过量KI溶液,置于暗处5~10分钟,溶液呈棕黄色。
Ⅴ.加入cmol·L−1Na2S2O3溶液进行滴定,当溶液转为浅黄色时,加入淀粉,滴定至终点。进行3次平行实验,消耗Na2S2O3溶液的体积平均值为vmL。
已知:ⅰ. (橙色)+H2O
(橙色)+H2O 2
2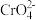 (黄色)+2H+。
(黄色)+2H+。
ⅱ.I2在水中溶解度小,易挥发。
ⅲ.I2(黄色)+I−(无色)
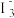 (棕黄色)。
(棕黄色)。
ⅳ.I2+2 (无色)=2I−+
(无色)=2I−+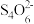 (无色)。
(无色)。
(1)PbO2中Pb的化合价是___________ 。
(2)Ⅱ中生成沉淀的离子方程式为___________ 。
(3)结合化学用语解释:Ⅲ中加入浓HCl后沉淀溶解的原因是___________ 。
(4)将Ⅳ中反应的离子方程式补全:□I−+___________+___________=□Cr3++___________+___________,___________
(5)Ⅴ中滴定终点的现象是___________ 。
(6)样品中四氧化三铅的质量分数为___________ 。(列出表达式即可,M(四氧化三铅)=685g·mol−1)
(7)步骤Ⅱ、Ⅲ在达成实验目的中起到的作用是___________ 。
Ⅰ.称取ag样品,加酸溶解,滤去不溶物,所有的铅元素进入溶液中并得到含有Pb2+的溶液。
Ⅱ.加入过量K2Cr2O7溶液,加热,生成黄色沉淀(PbCrO4),冷却,过滤。
Ⅲ.将沉淀全部转移至仪器A中,加入浓HCl,沉淀溶解,溶液转为橙色。
Ⅳ.加入过量KI溶液,置于暗处5~10分钟,溶液呈棕黄色。
Ⅴ.加入cmol·L−1Na2S2O3溶液进行滴定,当溶液转为浅黄色时,加入淀粉,滴定至终点。进行3次平行实验,消耗Na2S2O3溶液的体积平均值为vmL。
已知:ⅰ.
 (橙色)+H2O
(橙色)+H2O 2
2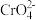 (黄色)+2H+。
(黄色)+2H+。ⅱ.I2在水中溶解度小,易挥发。
ⅲ.I2(黄色)+I−(无色)

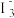 (棕黄色)。
(棕黄色)。ⅳ.I2+2
 (无色)=2I−+
(无色)=2I−+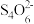 (无色)。
(无色)。(1)PbO2中Pb的化合价是
(2)Ⅱ中生成沉淀的离子方程式为
(3)结合化学用语解释:Ⅲ中加入浓HCl后沉淀溶解的原因是
(4)将Ⅳ中反应的离子方程式补全:□I−+___________+___________=□Cr3++___________+___________,
(5)Ⅴ中滴定终点的现象是
(6)样品中四氧化三铅的质量分数为
(7)步骤Ⅱ、Ⅲ在达成实验目的中起到的作用是
您最近一年使用:0次
解题方法
4 . 甲烷水蒸气重整反应是工业制备氢气的重要方式,在催化剂(如镍)表面发生的主要反应有:
①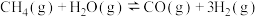
 kJ⋅mol-1
kJ⋅mol-1
②

副反应: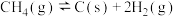 ,
,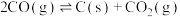 ,
,
Ⅰ.已知: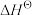 为标准摩尔生成焓,其定义为标准状态下,由稳定相态的单质生成1 mol该物质的焓变。对于稳定相态单质,其
为标准摩尔生成焓,其定义为标准状态下,由稳定相态的单质生成1 mol该物质的焓变。对于稳定相态单质,其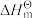 为零。
为零。
例如C(石墨)
 kJ·mol-1,则
kJ·mol-1,则 的标准生成焓为-393.5 kJ⋅mol-1。
的标准生成焓为-393.5 kJ⋅mol-1。
(1)
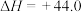 kJ⋅mol-1,结合表中数据计算反应
kJ⋅mol-1,结合表中数据计算反应
___________ 。
(2)在镍催化剂表面甲烷和水蒸气发生反应,最后生成CO、 和
和 ,反应机理如下,请补充其中的两个反应方程式(Z表示催化剂的活性中心)。
,反应机理如下,请补充其中的两个反应方程式(Z表示催化剂的活性中心)。
a. ;
;
b.___________ ;
c. ;
;
d.___________ ;
e.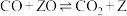
Ⅱ.在一体积可变的密闭容器中,投入一定量的 和
和 发生甲烷水蒸气重整反应。
发生甲烷水蒸气重整反应。
(3)下列有关说法正确的是___________。
(4)维持压强100 kPa,平衡时 、
、 、CO、
、CO、 的体积分数分别为a、b、c、d,反应①的平衡常数
的体积分数分别为a、b、c、d,反应①的平衡常数
___________ 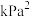 (用含字母的式子表示。
(用含字母的式子表示。 是以分压表示的平衡常数,分压=总压×体积分数)。
是以分压表示的平衡常数,分压=总压×体积分数)。
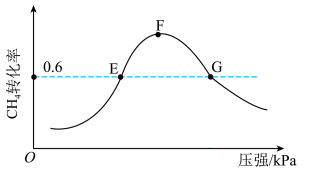
(5)500℃时,反应相同时间后测得 的转化率随压强的变化如图所示。则图中E点和G点CH4的浓度大小关系为c(E)
的转化率随压强的变化如图所示。则图中E点和G点CH4的浓度大小关系为c(E)___________ c(G)(填“>”“<”或“=”)。
(6)通过甲烷水蒸气重整反应的平衡含量计算,以及析碳条件的判断,该转化需适当增大水碳比[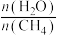 ],请分析可能的原因:
],请分析可能的原因:___________ 。
①
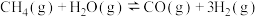
 kJ⋅mol-1
kJ⋅mol-1②


副反应:
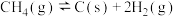 ,
,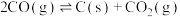 ,
,
Ⅰ.已知:
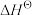 为标准摩尔生成焓,其定义为标准状态下,由稳定相态的单质生成1 mol该物质的焓变。对于稳定相态单质,其
为标准摩尔生成焓,其定义为标准状态下,由稳定相态的单质生成1 mol该物质的焓变。对于稳定相态单质,其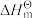 为零。
为零。例如C(石墨)

 kJ·mol-1,则
kJ·mol-1,则 的标准生成焓为-393.5 kJ⋅mol-1。
的标准生成焓为-393.5 kJ⋅mol-1。| 物质 | 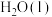 |  | CO |
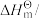 /kJ⋅mol-1 /kJ⋅mol-1 | -285.8 | -393.5 | -110.5 |

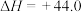 kJ⋅mol-1,结合表中数据计算反应
kJ⋅mol-1,结合表中数据计算反应
(2)在镍催化剂表面甲烷和水蒸气发生反应,最后生成CO、
 和
和 ,反应机理如下,请补充其中的两个反应方程式(Z表示催化剂的活性中心)。
,反应机理如下,请补充其中的两个反应方程式(Z表示催化剂的活性中心)。a.
 ;
; b.
c.
 ;
;d.
e.
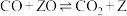
Ⅱ.在一体积可变的密闭容器中,投入一定量的
 和
和 发生甲烷水蒸气重整反应。
发生甲烷水蒸气重整反应。(3)下列有关说法正确的是___________。
A. 浓度不变,说明体系已达平衡状态 浓度不变,说明体系已达平衡状态 |
| B.反应②前后气体物质的量不变,所以此反应熵变为0 |
C.在催化剂表面, 、 、 分子中的化学键被削弱 分子中的化学键被削弱 |
D.在体系中通入适量的 ,有利于减少积碳,从而有利于反应进行 ,有利于减少积碳,从而有利于反应进行 |
 、
、 、CO、
、CO、 的体积分数分别为a、b、c、d,反应①的平衡常数
的体积分数分别为a、b、c、d,反应①的平衡常数
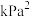 (用含字母的式子表示。
(用含字母的式子表示。 是以分压表示的平衡常数,分压=总压×体积分数)。
是以分压表示的平衡常数,分压=总压×体积分数)。(5)500℃时,反应相同时间后测得
 的转化率随压强的变化如图所示。则图中E点和G点CH4的浓度大小关系为c(E)
的转化率随压强的变化如图所示。则图中E点和G点CH4的浓度大小关系为c(E)
(6)通过甲烷水蒸气重整反应的平衡含量计算,以及析碳条件的判断,该转化需适当增大水碳比[
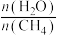 ],请分析可能的原因:
],请分析可能的原因:
您最近一年使用:0次
解题方法
5 . 大气、水体常见污染元素主要有氮、硫。含氮废气、废液处理是化学学科重要研究课题。
(1)在含 、
、 废水中加入镁矿工业废水(含Mg2+),以除去N、P,其反应离子方程为Mg2++
废水中加入镁矿工业废水(含Mg2+),以除去N、P,其反应离子方程为Mg2++ +
+
 MgNH4PO4↓,该方法除N、P需要控制污水的pH在适当范围,原因是
MgNH4PO4↓,该方法除N、P需要控制污水的pH在适当范围,原因是___ 。
(2)用NaClO可以将氨氮(NH3、NH )氧化为N2脱离溶液,NaClO去除NH3反应的化学方程式
)氧化为N2脱离溶液,NaClO去除NH3反应的化学方程式___ 。
(3)目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)方法,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图1所示。
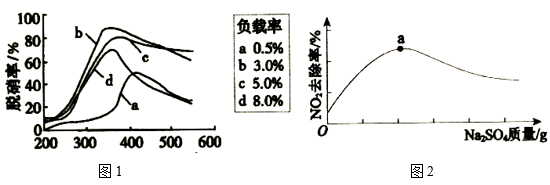
为达到最佳的脱硝效果,应采取的反应条件为___ (填温度和负载率数值)。
(4)CaSO3与Na2SO4混合浆液可用于脱除NO2,反应过程为:
Ⅰ.CaSO3(s)+ (aq)
(aq) CaSO4(s)+
CaSO4(s)+ (aq)
(aq)
Ⅱ. (aq)+2NO2(g)+H2O(l)
(aq)+2NO2(g)+H2O(l)
 (aq)+2
(aq)+2 (aq)+2H+( aq)
(aq)+2H+( aq)
浆液中CaSO3质量一定时,Na2SO4的质量与NO2的去除率变化趋势如图2所示。a点后NO2去除率降低的原因是___ 。
(1)在含
 、
、 废水中加入镁矿工业废水(含Mg2+),以除去N、P,其反应离子方程为Mg2++
废水中加入镁矿工业废水(含Mg2+),以除去N、P,其反应离子方程为Mg2++ +
+
 MgNH4PO4↓,该方法除N、P需要控制污水的pH在适当范围,原因是
MgNH4PO4↓,该方法除N、P需要控制污水的pH在适当范围,原因是(2)用NaClO可以将氨氮(NH3、NH
 )氧化为N2脱离溶液,NaClO去除NH3反应的化学方程式
)氧化为N2脱离溶液,NaClO去除NH3反应的化学方程式(3)目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)方法,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图1所示。

为达到最佳的脱硝效果,应采取的反应条件为
(4)CaSO3与Na2SO4混合浆液可用于脱除NO2,反应过程为:
Ⅰ.CaSO3(s)+
 (aq)
(aq) CaSO4(s)+
CaSO4(s)+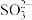 (aq)
(aq)Ⅱ.
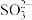 (aq)+2NO2(g)+H2O(l)
(aq)+2NO2(g)+H2O(l)
 (aq)+2
(aq)+2 (aq)+2H+( aq)
(aq)+2H+( aq) 浆液中CaSO3质量一定时,Na2SO4的质量与NO2的去除率变化趋势如图2所示。a点后NO2去除率降低的原因是
您最近一年使用:0次
2021-06-30更新
|
140次组卷
|
2卷引用:江苏省宿迁市2020-2021学年高二下学期期末考试化学试题
名校
6 . 某种工业废水中含有一定量的Cr2O 和CrO
和CrO ,它们易被人体吸收积累而导致肝癌。
,它们易被人体吸收积累而导致肝癌。
I.污水处理厂常用还原沉淀法处理含铬废水,其流程如下:
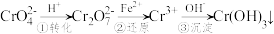
(1)已知第①步存在平衡:2CrO (黄色)+2H+
(黄色)+2H+ Cr2O
Cr2O (橙色)+H2O
(橙色)+H2O
①Cr2O 中Cr的化合价是
中Cr的化合价是___________ 。
②常温下,若平衡体系的pH=12,则溶液显___________ 色。
(2)第②步发生反应的离子方程式为___________ 。
(3)往FeCl3+3KSCN 3KCl+Fe(SCN)3的平衡体系中加少量的KCl固体,平衡向哪个方向移动
3KCl+Fe(SCN)3的平衡体系中加少量的KCl固体,平衡向哪个方向移动___________ (向逆反应方向、向正反应方向、不移动)
II.取样该工业废水,检测其中铬的含量。
步骤Ⅰ:取25.00mL废水于锥形瓶中,加入适量稀硫酸酸化。
步骤Ⅱ:加入过量的碘化钾溶液,充分反应后滴入几滴淀粉作指示剂。
步骤Ⅲ:用0.1000mol·L-1的Na2S2O3溶液测定上面产生的碘单质。(I2+2Na2S2O3=2NaI+Na2S4O6)当溶液由蓝色变无色时为滴定终点,消耗Na2S2O3溶液18.00mL
(4)求所取25.00mL废水经酸化后,含有Cr2O 的物质的量为
的物质的量为___________ mol。
 和CrO
和CrO ,它们易被人体吸收积累而导致肝癌。
,它们易被人体吸收积累而导致肝癌。I.污水处理厂常用还原沉淀法处理含铬废水,其流程如下:
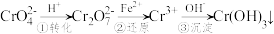
(1)已知第①步存在平衡:2CrO
 (黄色)+2H+
(黄色)+2H+ Cr2O
Cr2O (橙色)+H2O
(橙色)+H2O①Cr2O
 中Cr的化合价是
中Cr的化合价是②常温下,若平衡体系的pH=12,则溶液显
(2)第②步发生反应的离子方程式为
(3)往FeCl3+3KSCN
 3KCl+Fe(SCN)3的平衡体系中加少量的KCl固体,平衡向哪个方向移动
3KCl+Fe(SCN)3的平衡体系中加少量的KCl固体,平衡向哪个方向移动II.取样该工业废水,检测其中铬的含量。
步骤Ⅰ:取25.00mL废水于锥形瓶中,加入适量稀硫酸酸化。
步骤Ⅱ:加入过量的碘化钾溶液,充分反应后滴入几滴淀粉作指示剂。
步骤Ⅲ:用0.1000mol·L-1的Na2S2O3溶液测定上面产生的碘单质。(I2+2Na2S2O3=2NaI+Na2S4O6)当溶液由蓝色变无色时为滴定终点,消耗Na2S2O3溶液18.00mL
(4)求所取25.00mL废水经酸化后,含有Cr2O
 的物质的量为
的物质的量为
您最近一年使用:0次
7 . 在密闭容器中进行如下反应
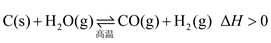
达平衡后,改变下列条件,用“正反应”“逆反应”或“不移动”分析判断平衡移动情况,用“增大”“减小”或“不变”分析判断物质的量变情况:
(1)增加C的含量,平衡____________ ,c(H2O)___________ 。
(2)保持反应容器体积和温度不变,通入He,平衡____________ ,c(H2)____________ 。
(3)在一定温度下,缩小反应容器体积,平衡向____________ 方向移动,c(CO)___________ ,H2O(g)的转化率
______________ 。
(4)保持反应容器体积不变,升高温度,平衡向_________ 方向移动,c(H2)___________ 。
(5)保持反应容器体积和温度不变,再通入H2O(g),平衡向__________ 方向移动,H2O(g)的转化率
_________ ,c(CO)___________ 。
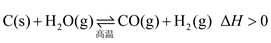
达平衡后,改变下列条件,用“正反应”“逆反应”或“不移动”分析判断平衡移动情况,用“增大”“减小”或“不变”分析判断物质的量变情况:
(1)增加C的含量,平衡
(2)保持反应容器体积和温度不变,通入He,平衡
(3)在一定温度下,缩小反应容器体积,平衡向

(4)保持反应容器体积不变,升高温度,平衡向
(5)保持反应容器体积和温度不变,再通入H2O(g),平衡向

您最近一年使用:0次
2021-11-07更新
|
313次组卷
|
2卷引用:四川省成都市蓉城名校联盟2021-2022学年高二上学期期中联考化学试题
名校
解题方法
8 . 锑(Sb)位于元素周期表第VA族。高纯锑在光电催化、半导体材料等方面有着重要的应用。以辉锑矿(主要成分为Sb2S3,还含有PbS、CuS、SiO2等)为原料酸性浸出法、氢气还原冶炼高纯锑的工艺流程如图:

已知:①浸出液中除含有盐酸外,还含有Sb3+、Pb2+、Cu2+、Fe2+、Fe3+等;
②常温下,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Fe(OH)2]=8.0×10-16,Ksp[Sb(OH)3]=1.0×10-41,Ksp(PbS)=8.0×10-28,Ksp(CuS)=6.4×10-36。
回答下列问题:
(1)滤渣1中除S外,还有________________ 。
(2)“浸出”时,Sb2S3发生反应的化学方程式为________________________ 。
(3)“还原”是用锑粉还原高价金属离子。其中,Sb将Fe3+转化为Fe2+的离子方程式为________ ,该转化有利于“水解”时锑铁分离,理由是________________________ 。
(4)“沉铜、铅”过程中,缓慢滴加极稀的Na2S溶液,当Pb2+沉淀完全时,溶液中c(Cu2+)=________ mol·L-1。
(5)“水解”是利用SbCl3的水解反应制取Sb2O3(SbCl3的水解反应分为三步,中间产物有SbOCl等)。写出SbOCl水解生成Sb2O3的化学方程式:________________________ 。为了促进水解趋于完全,操作时将SbCl3徐徐加入大量水中,反应后期还要加入少量氨水。试结合平衡移动原理解释这两项操作的作用:________________________ 。
(6)已知辉锑矿中Sb2S3的含量为68%,整个流程中锑元素的损耗率为10%,则5t该辉锑矿可制得Sb的质量为________ kg。

已知:①浸出液中除含有盐酸外,还含有Sb3+、Pb2+、Cu2+、Fe2+、Fe3+等;
②常温下,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Fe(OH)2]=8.0×10-16,Ksp[Sb(OH)3]=1.0×10-41,Ksp(PbS)=8.0×10-28,Ksp(CuS)=6.4×10-36。
回答下列问题:
(1)滤渣1中除S外,还有
(2)“浸出”时,Sb2S3发生反应的化学方程式为
(3)“还原”是用锑粉还原高价金属离子。其中,Sb将Fe3+转化为Fe2+的离子方程式为
(4)“沉铜、铅”过程中,缓慢滴加极稀的Na2S溶液,当Pb2+沉淀完全时,溶液中c(Cu2+)=
(5)“水解”是利用SbCl3的水解反应制取Sb2O3(SbCl3的水解反应分为三步,中间产物有SbOCl等)。写出SbOCl水解生成Sb2O3的化学方程式:
(6)已知辉锑矿中Sb2S3的含量为68%,整个流程中锑元素的损耗率为10%,则5t该辉锑矿可制得Sb的质量为
您最近一年使用:0次
9 . 工业合成氨是人工固研究的重要领域。回答下列问题:
(1)如图所示是电解法合成氨反应装置示意图
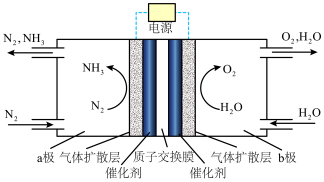
则b极为___________ (填“阴”或“阳”)极,a极的电极反应式为___________ ,电解装置中质子交换膜的作用为___________ ;若b极产生的O2在一定条件下的体积为336L,a极中通入相同条件下N2的总体积为672L,则N2的转化率为___________ %(保留两位有效数字)。
(2)合成氨反应的一种反应机理的相对能量—反应进程如下图所示,其中标有“*”的微粒为吸附态(图中“*H”均未标出)。
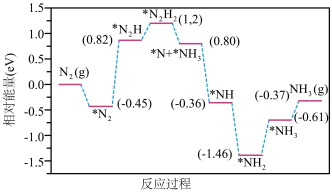
则各步反应中决定合成氨反应速率的反应方程式为___________
(3)当氮气和氢气的比例为1:3时,工业合成氨所得混合气体中,氨气的含量与温度、压强的关系如下
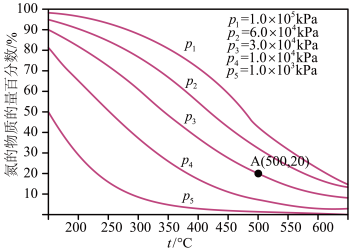
①平衡曲线上A点的平衡常数
___________ (用含 的式子表示)
的式子表示)
②工业实际生产投料时,氮气与氢气的体积比为1:2.8,适当增加氮气的比重的目的是___________ 。
(1)如图所示是电解法合成氨反应装置示意图

则b极为
(2)合成氨反应的一种反应机理的相对能量—反应进程如下图所示,其中标有“*”的微粒为吸附态(图中“*H”均未标出)。

则各步反应中决定合成氨反应速率的反应方程式为
(3)当氮气和氢气的比例为1:3时,工业合成氨所得混合气体中,氨气的含量与温度、压强的关系如下

①平衡曲线上A点的平衡常数

 的式子表示)
的式子表示)②工业实际生产投料时,氮气与氢气的体积比为1:2.8,适当增加氮气的比重的目的是
您最近一年使用:0次



