解题方法
1 . 在一定条件下,反应x A+yB zC达到平衡:
zC达到平衡:
(1)若A、B、C均为气体,减压后平衡向逆反应方向移动,则x、y、z间的关系是_______ ;
(2)若已知C是气体,且x+y=z。在增大压强时,若平衡发生移动,则一定向______ (填“正”或“逆”)反应方向移动;
(3)已知B、C是气体,当其他条件不变时,增大A的物质的量,平衡不移动,则A为____ 态;
(4)加热后C的质量分数减少,则正反应是________ (填“放热”或“吸热”)反应。升高温度达到新的平衡后,该反应的平衡常数将变___ (填“大”或“小”)。
 zC达到平衡:
zC达到平衡:(1)若A、B、C均为气体,减压后平衡向逆反应方向移动,则x、y、z间的关系是
(2)若已知C是气体,且x+y=z。在增大压强时,若平衡发生移动,则一定向
(3)已知B、C是气体,当其他条件不变时,增大A的物质的量,平衡不移动,则A为
(4)加热后C的质量分数减少,则正反应是
您最近一年使用:0次
2022-12-05更新
|
48次组卷
|
2卷引用:贵州省金沙县精诚中学2021-2022学年高二上学期期中理综化学试题
2 . 现有反应

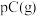 ,ΔH<0,达到平衡后,减小压强,混合物体系中C的质量分数减小,则:
,ΔH<0,达到平衡后,减小压强,混合物体系中C的质量分数减小,则:
(1)该反应
_______ p(填“>”“=”或“<”)。
(2)该反应在一定条件下能否自发进行_______ (填“能”或“不能”),说明理由_______ 。
(3)若B是有色物质,A、C均无色,则加入C(容器容积不变)时混合物的颜色_______ (填“变深”、“变浅”或“不变”);若容器容积不变,充入氖气时,容器内压强增大,这时化学平衡_______ 移动(填“正向”、“逆向”或“不”)。


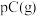 ,ΔH<0,达到平衡后,减小压强,混合物体系中C的质量分数减小,则:
,ΔH<0,达到平衡后,减小压强,混合物体系中C的质量分数减小,则:(1)该反应

(2)该反应在一定条件下能否自发进行
(3)若B是有色物质,A、C均无色,则加入C(容器容积不变)时混合物的颜色
您最近一年使用:0次
名校
3 . 过氧化钙(CaO2)是一种白色晶体,无臭无味,能潮解,难溶于水,可与水缓慢反应;不溶于醇类、乙醚等,易与酸反应,常用作杀菌剂、防腐剂等。通常利用CaCl2在碱性条件下与H2O2反应制得。某化学兴趣小组在实验室制备CaO2的实验方案和装置示意图(图一)如下:
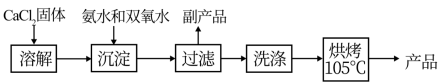
已知:CaO2的制备原理:CaCl2+H2O2+2NH3·H2O+6H2O=CaO2·8H2O↓+2NH4Cl
请回答下列问题
(1)仪器A的名称为___________ ,仪器C支管B的作用___________ ;
(2)加入氨水的作用是___________ ;(从化学平衡移动的原理分析)
(3)过滤后洗涤沉淀的试剂最好用__________
(4)沉淀反应时常用冰水浴控制温度在0℃左右,其可能原因是___________ 、___________ (写出两种)。
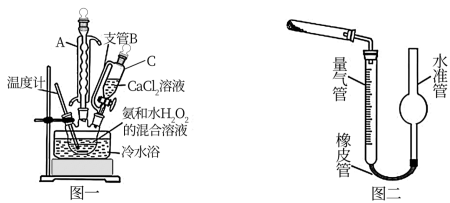
(5)已知CaO2在350℃时能迅速分解,生成CaO和O2。该小组采用如图二所示的装置测定刚才制备的产品中CaO2的纯度(设杂质不分解产生气体)
①量气管读数的方法是:___________ ;
②准确称取0.50g样品,置于试管中加热使其完全分解,收集到44.80mL(已换算为标准状况)气体,则产品中过氧化钙的质量分数为___________ (保留4位有效数字);


已知:CaO2的制备原理:CaCl2+H2O2+2NH3·H2O+6H2O=CaO2·8H2O↓+2NH4Cl
请回答下列问题
(1)仪器A的名称为
(2)加入氨水的作用是
(3)过滤后洗涤沉淀的试剂最好用__________
| A.水 | B.浓盐酸 | C.无水乙醇 | D.CaCl2溶液 |
(5)已知CaO2在350℃时能迅速分解,生成CaO和O2。该小组采用如图二所示的装置测定刚才制备的产品中CaO2的纯度(设杂质不分解产生气体)
①量气管读数的方法是:
②准确称取0.50g样品,置于试管中加热使其完全分解,收集到44.80mL(已换算为标准状况)气体,则产品中过氧化钙的质量分数为
您最近一年使用:0次
4 . 以硅藻土为载体的五氧化二钒(V2O5)是接触法生产硫酸的催化剂。从废矾催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为
如图是一种废钒催化剂回收工艺路线:
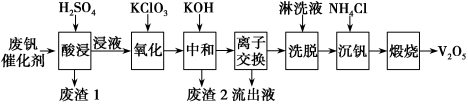
回答下列问题:
(1)已知“酸浸”时,V2O5转化为VO ,V2O4转化成VO2+,请写出废钒催化剂“酸浸”时V2O5发生反应的离子方程式
,V2O4转化成VO2+,请写出废钒催化剂“酸浸”时V2O5发生反应的离子方程式___________ 。
(2)工艺中“氧化”步骤使VO2+变为VO 反应的离子方程式
反应的离子方程式___________ 。
(3)“离子交换”和“洗脱”可简单表示为4ROH+V4O
 R4V4O12+4OH-(ROH为强碱性阴离子交换树脂)。为了提高“洗脱”效率,“淋洗液”应该呈
R4V4O12+4OH-(ROH为强碱性阴离子交换树脂)。为了提高“洗脱”效率,“淋洗液”应该呈___________ (填“酸”“碱”或“中”)性。
(4)“流出液”中阳离子最多的是___________ 。
| 物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
| 质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
如图是一种废钒催化剂回收工艺路线:

回答下列问题:
(1)已知“酸浸”时,V2O5转化为VO
 ,V2O4转化成VO2+,请写出废钒催化剂“酸浸”时V2O5发生反应的离子方程式
,V2O4转化成VO2+,请写出废钒催化剂“酸浸”时V2O5发生反应的离子方程式(2)工艺中“氧化”步骤使VO2+变为VO
 反应的离子方程式
反应的离子方程式(3)“离子交换”和“洗脱”可简单表示为4ROH+V4O
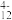
 R4V4O12+4OH-(ROH为强碱性阴离子交换树脂)。为了提高“洗脱”效率,“淋洗液”应该呈
R4V4O12+4OH-(ROH为强碱性阴离子交换树脂)。为了提高“洗脱”效率,“淋洗液”应该呈(4)“流出液”中阳离子最多的是
您最近一年使用:0次
名校
5 . (NH4)2Cr2O7用于有机合成催化剂,媒染剂,显影液等。某化学兴趣小组对(NH4)2Cr2O7的部分性质及含氮量进行探究。已知: (橙色)+H2O
(橙色)+H2O 2
2 (黄色)+2H+,回答下列问题:
(黄色)+2H+,回答下列问题:
(1)在试管中加入少量固体(NH4)2Cr2O7,滴加足量浓KOH溶液,振荡、微热,观察到的主要现象是固体溶解、有刺激性气味气体放出、___________ 。
(2)实验室常用甲醛法测定含(NH4)2Cr2O7的样品中氮的质量分数,其反应原理为:2Ba2++ +H2O=2BaCrO4↓+2H+;4
+H2O=2BaCrO4↓+2H+;4 +6HCHO=3H++6H2O+(CH2)6N4H+;(CH2)6N4H+
+6HCHO=3H++6H2O+(CH2)6N4H+;(CH2)6N4H+ (CH2)6N4+H+,K=7×10-6,然后用NaOH标准溶液滴定反应生成的酸和酸性物质。
(CH2)6N4+H+,K=7×10-6,然后用NaOH标准溶液滴定反应生成的酸和酸性物质。
实验步骤:
ⅰ.称取样品mg,配成250mL溶液。
ⅱ.量取25.00mL样品溶液,用氯化钡溶液使 完全沉淀后,加入10mL20%的中性甲醛溶液,摇匀、静置5min。
完全沉淀后,加入10mL20%的中性甲醛溶液,摇匀、静置5min。
ⅲ.以酚酞作指示剂,用cmol·L-1标准NaOH溶液滴定,记录数据。
ⅳ.重复步骤ⅱ、ⅲ 2-3次,处理数据。
①滴定终点的现象是___________ 。
②滴定操作使用的玻璃仪器主要有___________ 。
③滴定时边滴边摇动锥形瓶,眼睛应观察___________ 。
④步骤ⅲ发生反应的离子方程式是H++OH-= H2O和___________ 。
⑤若实验平均消耗NaOH溶液的体积为vmL,该样品中氮的质量分数的计算式为___________ 。(用含m、c、v式子表示,需要化简)
⑥下列情况会导致测定结果偏低的是___________ 。(填序号)
a. 若步骤ⅰ中定容时俯视溶液液面
b. 若实验中使用的甲醛常混有微量甲酸
c. 若步骤ⅱ没有静置5min
d. 若实验时装NaOH标准液的滴定管只用蒸馏水洗涤而未用标准液润洗
 (橙色)+H2O
(橙色)+H2O 2
2 (黄色)+2H+,回答下列问题:
(黄色)+2H+,回答下列问题:(1)在试管中加入少量固体(NH4)2Cr2O7,滴加足量浓KOH溶液,振荡、微热,观察到的主要现象是固体溶解、有刺激性气味气体放出、
(2)实验室常用甲醛法测定含(NH4)2Cr2O7的样品中氮的质量分数,其反应原理为:2Ba2++
 +H2O=2BaCrO4↓+2H+;4
+H2O=2BaCrO4↓+2H+;4 +6HCHO=3H++6H2O+(CH2)6N4H+;(CH2)6N4H+
+6HCHO=3H++6H2O+(CH2)6N4H+;(CH2)6N4H+ (CH2)6N4+H+,K=7×10-6,然后用NaOH标准溶液滴定反应生成的酸和酸性物质。
(CH2)6N4+H+,K=7×10-6,然后用NaOH标准溶液滴定反应生成的酸和酸性物质。实验步骤:
ⅰ.称取样品mg,配成250mL溶液。
ⅱ.量取25.00mL样品溶液,用氯化钡溶液使
 完全沉淀后,加入10mL20%的中性甲醛溶液,摇匀、静置5min。
完全沉淀后,加入10mL20%的中性甲醛溶液,摇匀、静置5min。ⅲ.以酚酞作指示剂,用cmol·L-1标准NaOH溶液滴定,记录数据。
ⅳ.重复步骤ⅱ、ⅲ 2-3次,处理数据。
①滴定终点的现象是
②滴定操作使用的玻璃仪器主要有
③滴定时边滴边摇动锥形瓶,眼睛应观察
④步骤ⅲ发生反应的离子方程式是H++OH-= H2O和
⑤若实验平均消耗NaOH溶液的体积为vmL,该样品中氮的质量分数的计算式为
⑥下列情况会导致测定结果偏低的是
a. 若步骤ⅰ中定容时俯视溶液液面
b. 若实验中使用的甲醛常混有微量甲酸
c. 若步骤ⅱ没有静置5min
d. 若实验时装NaOH标准液的滴定管只用蒸馏水洗涤而未用标准液润洗
您最近一年使用:0次
解题方法
6 . 甲烷水蒸气重整反应是工业制备氢气的重要方式,在催化剂(如镍)表面发生的主要反应有:
①
 kJ⋅mol-1
kJ⋅mol-1
②

副反应: ,
,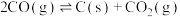 ,
,
Ⅰ.已知: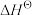 为标准摩尔生成焓,其定义为标准状态下,由稳定相态的单质生成1 mol该物质的焓变。对于稳定相态单质,其
为标准摩尔生成焓,其定义为标准状态下,由稳定相态的单质生成1 mol该物质的焓变。对于稳定相态单质,其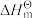 为零。
为零。
例如C(石墨)
 kJ·mol-1,则
kJ·mol-1,则 的标准生成焓为-393.5 kJ⋅mol-1。
的标准生成焓为-393.5 kJ⋅mol-1。
(1)
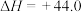 kJ⋅mol-1,结合表中数据计算反应
kJ⋅mol-1,结合表中数据计算反应
___________ 。
(2)在镍催化剂表面甲烷和水蒸气发生反应,最后生成CO、 和
和 ,反应机理如下,请补充其中的两个反应方程式(Z表示催化剂的活性中心)。
,反应机理如下,请补充其中的两个反应方程式(Z表示催化剂的活性中心)。
a. ;
;
b.___________ ;
c. ;
;
d.___________ ;
e.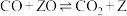
Ⅱ.在一体积可变的密闭容器中,投入一定量的 和
和 发生甲烷水蒸气重整反应。
发生甲烷水蒸气重整反应。
(3)下列有关说法正确的是___________。
(4)维持压强100 kPa,平衡时 、
、 、CO、
、CO、 的体积分数分别为a、b、c、d,反应①的平衡常数
的体积分数分别为a、b、c、d,反应①的平衡常数
___________  (用含字母的式子表示。
(用含字母的式子表示。 是以分压表示的平衡常数,分压=总压×体积分数)。
是以分压表示的平衡常数,分压=总压×体积分数)。
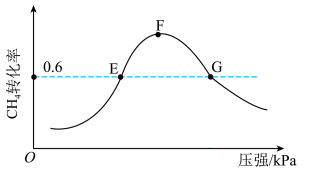
(5)500℃时,反应相同时间后测得 的转化率随压强的变化如图所示。则图中E点和G点CH4的浓度大小关系为c(E)
的转化率随压强的变化如图所示。则图中E点和G点CH4的浓度大小关系为c(E)___________ c(G)(填“>”“<”或“=”)。
(6)通过甲烷水蒸气重整反应的平衡含量计算,以及析碳条件的判断,该转化需适当增大水碳比[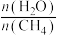 ],请分析可能的原因:
],请分析可能的原因:___________ 。
①

 kJ⋅mol-1
kJ⋅mol-1②


副反应:
 ,
,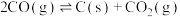 ,
,
Ⅰ.已知:
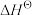 为标准摩尔生成焓,其定义为标准状态下,由稳定相态的单质生成1 mol该物质的焓变。对于稳定相态单质,其
为标准摩尔生成焓,其定义为标准状态下,由稳定相态的单质生成1 mol该物质的焓变。对于稳定相态单质,其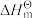 为零。
为零。例如C(石墨)

 kJ·mol-1,则
kJ·mol-1,则 的标准生成焓为-393.5 kJ⋅mol-1。
的标准生成焓为-393.5 kJ⋅mol-1。| 物质 |  |  | CO |
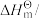 /kJ⋅mol-1 /kJ⋅mol-1 | -285.8 | -393.5 | -110.5 |

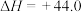 kJ⋅mol-1,结合表中数据计算反应
kJ⋅mol-1,结合表中数据计算反应
(2)在镍催化剂表面甲烷和水蒸气发生反应,最后生成CO、
 和
和 ,反应机理如下,请补充其中的两个反应方程式(Z表示催化剂的活性中心)。
,反应机理如下,请补充其中的两个反应方程式(Z表示催化剂的活性中心)。a.
 ;
; b.
c.
 ;
;d.
e.
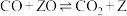
Ⅱ.在一体积可变的密闭容器中,投入一定量的
 和
和 发生甲烷水蒸气重整反应。
发生甲烷水蒸气重整反应。(3)下列有关说法正确的是___________。
A. 浓度不变,说明体系已达平衡状态 浓度不变,说明体系已达平衡状态 |
| B.反应②前后气体物质的量不变,所以此反应熵变为0 |
C.在催化剂表面, 、 、 分子中的化学键被削弱 分子中的化学键被削弱 |
D.在体系中通入适量的 ,有利于减少积碳,从而有利于反应进行 ,有利于减少积碳,从而有利于反应进行 |
 、
、 、CO、
、CO、 的体积分数分别为a、b、c、d,反应①的平衡常数
的体积分数分别为a、b、c、d,反应①的平衡常数
 (用含字母的式子表示。
(用含字母的式子表示。 是以分压表示的平衡常数,分压=总压×体积分数)。
是以分压表示的平衡常数,分压=总压×体积分数)。(5)500℃时,反应相同时间后测得
 的转化率随压强的变化如图所示。则图中E点和G点CH4的浓度大小关系为c(E)
的转化率随压强的变化如图所示。则图中E点和G点CH4的浓度大小关系为c(E)
(6)通过甲烷水蒸气重整反应的平衡含量计算,以及析碳条件的判断,该转化需适当增大水碳比[
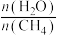 ],请分析可能的原因:
],请分析可能的原因:
您最近一年使用:0次
名校
解题方法
7 . 以硅藻土为载体的五氧化二钒(V2O5)是接触法生产硫酸的催化剂。从废矾催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为
以下是一种废钒催化剂回收工艺路线:
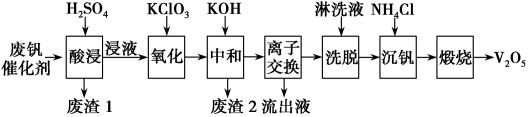
回答下列问题:
(1)“酸浸”时V2O5转化为VO ,反应的离子方程式为
,反应的离子方程式为___________ ,同时V2O4转化成VO2+。
(2)“氧化”中欲使3 mol的VO2+变为VO ,则需要氧化剂KClO3至少为
,则需要氧化剂KClO3至少为___________ mol。
(3)“中和”作用之一是使钒以V4O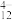 形式存在于溶液中,将Al和Fe元素转化为难溶物。“废渣2”中含有
形式存在于溶液中,将Al和Fe元素转化为难溶物。“废渣2”中含有___________ 。
(4)“离子交换”和“洗脱”可简单表示为4ROH+V4O
 R4V4O12+4OH-(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈
R4V4O12+4OH-(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈___________ 性(填“酸”、“碱”或“中”)。
(5)“流出液”中阳离子最多的是___________ 。
(6)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式___________ 。
| 物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
| 质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:

回答下列问题:
(1)“酸浸”时V2O5转化为VO
 ,反应的离子方程式为
,反应的离子方程式为(2)“氧化”中欲使3 mol的VO2+变为VO
 ,则需要氧化剂KClO3至少为
,则需要氧化剂KClO3至少为(3)“中和”作用之一是使钒以V4O
 形式存在于溶液中,将Al和Fe元素转化为难溶物。“废渣2”中含有
形式存在于溶液中,将Al和Fe元素转化为难溶物。“废渣2”中含有(4)“离子交换”和“洗脱”可简单表示为4ROH+V4O
 R4V4O12+4OH-(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈
R4V4O12+4OH-(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈(5)“流出液”中阳离子最多的是
(6)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式
您最近一年使用:0次
名校
解题方法
8 . 合成氨工业中采用循环操作,主要是为了
| A.增大化学反应速率 | B.提高平衡混合物中氨的含量 |
| C.降低氨的沸点 | D.提高氮气和氢气的利用率 |
您最近一年使用:0次
2023-06-30更新
|
504次组卷
|
16卷引用:湖北省武汉市长虹中学2021-2022学年高二上学期10月月考化学试卷
湖北省武汉市长虹中学2021-2022学年高二上学期10月月考化学试卷山西省怀仁市2021-2022学年高二上学期期中化学试题人教2019版选择性必修一第二章 第四节 化学反应的调控 课后习题河北省石家庄市2021-2022学年高二上学期期末考试化学试题(已下线)2.4 化学反应的调控-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)吉林省吉林市2022-2023学年高二上学期期中调研测试化学试题黑龙江省虎林市高级中学2022-2023学年高二上学期期中考试化学试题云南省玉溪市华宁县第二中学2021-2022年高二下学期开学考试化学试题新疆喀什地区疏附县第一中学2022-2023学年高二上学期期末考试化学试题(已下线)化学反应速率与化学平衡——课时7化学反应的调控(已下线)第08讲 化学反应的调控-【暑假自学课】2023年新高二化学暑假精品课(人教版2019选择性必修1)陕西省西安市鄠邑区2022-2023学年高一下学期6月期末考试化学试题 广东实验中学越秀学校2023-2024学年高二上学期期中考试化学试题四川省遂宁市射洪中学校2023-2024学年高二上学期11月期中化学试题青海省西宁市大通县2023-2024学年高二上学期期末考试化学试题贵州神贵阳市2023-2024学年清镇市博雅实验学校高二上学期第四次月考化学试卷
名校
9 . 可逆反应A(g)+B C(g)+D,达到平衡时,下列说法不正确的是
C(g)+D,达到平衡时,下列说法不正确的是
 C(g)+D,达到平衡时,下列说法不正确的是
C(g)+D,达到平衡时,下列说法不正确的是| A.增大压强,平衡不移动说明B、D一定是气体 |
| B.若A为有色气体,增大A的浓度,平衡体系气体颜色加深 |
| C.若B是气体,增大B的浓度会使A的转化率增大 |
| D.升高温度C的质量分数减小,说明正反应为放热反应 |
您最近一年使用:0次
2021-10-23更新
|
243次组卷
|
2卷引用:山西省长治市第二中学校2021-2022学年高二上学期第一次月考化学试题
10 . 重金属元素钒(V)性能优良,用途广泛,有金属“维生素”之称,以硅藻土为载体的五氧化二钒(V2O5)是接触法制备硫酸的催化剂。
废钒催化剂的主要成分为:
以下是一种废钒催化剂回收 工艺路线:
工艺路线:

回答下列问题:
(1)“酸浸”时V2O5转化为 ,V2O4转化为VO2+,写出V2O4转化为VO2+反应的离子方程式:
,V2O4转化为VO2+,写出V2O4转化为VO2+反应的离子方程式:_______ 。
(2)“氧化”中VO2+转变为 ,反应的离子方程式为
,反应的离子方程式为_______ 。
(3)V2O5能与盐酸反应产生VO2+和一种黄绿色气体,该气体能与Na2SO3溶液反应被吸收,则 、Cl-、VO2+还原性由小到大的顺序是
、Cl-、VO2+还原性由小到大的顺序是_______ 。
(4)“中和”作用之一是使钒以 形式存在于溶液中,“废渣2”中含有
形式存在于溶液中,“废渣2”中含有_______ 。
(5)“离子交换”和“洗脱”可简单表示为: (以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈
(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_______ 性(填“酸”“碱”“中”)。
(6)“煅烧”中使用的主要实验仪器名称为(写3种)_______ 。
废钒催化剂的主要成分为:
| 物质 |  |  | 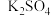 |  |  |  |
| 质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
 工艺路线:
工艺路线:
回答下列问题:
(1)“酸浸”时V2O5转化为
 ,V2O4转化为VO2+,写出V2O4转化为VO2+反应的离子方程式:
,V2O4转化为VO2+,写出V2O4转化为VO2+反应的离子方程式:(2)“氧化”中VO2+转变为
 ,反应的离子方程式为
,反应的离子方程式为(3)V2O5能与盐酸反应产生VO2+和一种黄绿色气体,该气体能与Na2SO3溶液反应被吸收,则
 、Cl-、VO2+还原性由小到大的顺序是
、Cl-、VO2+还原性由小到大的顺序是(4)“中和”作用之一是使钒以
 形式存在于溶液中,“废渣2”中含有
形式存在于溶液中,“废渣2”中含有(5)“离子交换”和“洗脱”可简单表示为:
 (以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈
(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈(6)“煅烧”中使用的主要实验仪器名称为(写3种)
您最近一年使用:0次



