名校
1 . 碳达峰是指我国承诺2030年前,二氧化碳的排放不再增长。因此,诸多科学家都在大力研合理利用 和CO以减少碳的排放。
和CO以减少碳的排放。
(1) 可通过以下4种方式转化成有机物,从而有效实现碳循环。
可通过以下4种方式转化成有机物,从而有效实现碳循环。
a.
b.
c.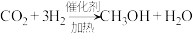
已知: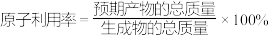
以上反应中,最环保节能的是_______ ,原子利用率最高的是_______ 。(填编号)
(2)我国科学家设计出一条仅11步的工业合成路线,实现了 到淀粉的合成。其第一步是把
到淀粉的合成。其第一步是把 还原为甲醇(
还原为甲醇( ),该方法的化学方程式是:
),该方法的化学方程式是:
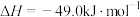 。回答下列问题:
。回答下列问题:
①能说明该反应已达平衡状态的是_______ (填字母)。
A.单位时间内生成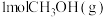 的同时消耗了
的同时消耗了
B.在恒温恒容的容器中,混合气体的平均摩尔质量保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒压的容器中,混合气体的密度不再变化
②该反应正逆反应的活化能大小为:Ea(正)_______ Ea(逆)(填“>”、“=”或“<”)
(3)利用CO高温时与磷石膏(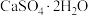 )反应,可减少CO的排放,又可以实现硫酸盐资源的再利用。已知该反应的产物与温度有关。
)反应,可减少CO的排放,又可以实现硫酸盐资源的再利用。已知该反应的产物与温度有关。
①在700℃时,主要的还原产物是一种硫的最低价盐,该物质为_______ (填化学式)。
②在1150℃时,向盛有足量 的真空恒容密闭容器中充入一定量CO,反应体系起始压强为
的真空恒容密闭容器中充入一定量CO,反应体系起始压强为 ,主要发生反应:
,主要发生反应: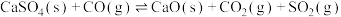 。该反应达到平衡时,
。该反应达到平衡时,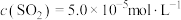 ,CO的转化率为50%,则初始时
,CO的转化率为50%,则初始时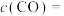
_______ mol/L,该反应的压强平衡常数
_______ MPa(忽略副反应;气体分压=总压×气体物质的量分数)。
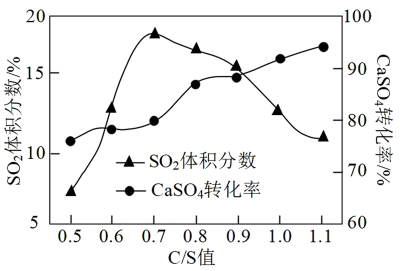
(4)工业上也可用炭粉还原磷石膏,该反应的产物与C/S值(炭粉与 的物质的量之比)有关。向密闭容器中加入几组不同C/S值的炭粉与磷石膏的混合物,1100℃煅烧至无气体产生,结果如图所示。当C/S值为0.5时,反应产物主要为CaO、
的物质的量之比)有关。向密闭容器中加入几组不同C/S值的炭粉与磷石膏的混合物,1100℃煅烧至无气体产生,结果如图所示。当C/S值为0.5时,反应产物主要为CaO、 和
和 ;当C/S值大于0.7时,反应所得气体中
;当C/S值大于0.7时,反应所得气体中 的体积分数下降,可能的原因是
的体积分数下降,可能的原因是_______ 。
 和CO以减少碳的排放。
和CO以减少碳的排放。(1)
 可通过以下4种方式转化成有机物,从而有效实现碳循环。
可通过以下4种方式转化成有机物,从而有效实现碳循环。a.

b.

c.
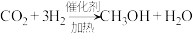
已知:
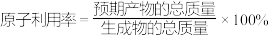
以上反应中,最环保节能的是
(2)我国科学家设计出一条仅11步的工业合成路线,实现了
 到淀粉的合成。其第一步是把
到淀粉的合成。其第一步是把 还原为甲醇(
还原为甲醇( ),该方法的化学方程式是:
),该方法的化学方程式是:
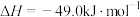 。回答下列问题:
。回答下列问题:①能说明该反应已达平衡状态的是
A.单位时间内生成
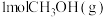 的同时消耗了
的同时消耗了
B.在恒温恒容的容器中,混合气体的平均摩尔质量保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒压的容器中,混合气体的密度不再变化
②该反应正逆反应的活化能大小为:Ea(正)
(3)利用CO高温时与磷石膏(
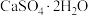 )反应,可减少CO的排放,又可以实现硫酸盐资源的再利用。已知该反应的产物与温度有关。
)反应,可减少CO的排放,又可以实现硫酸盐资源的再利用。已知该反应的产物与温度有关。①在700℃时,主要的还原产物是一种硫的最低价盐,该物质为
②在1150℃时,向盛有足量
 的真空恒容密闭容器中充入一定量CO,反应体系起始压强为
的真空恒容密闭容器中充入一定量CO,反应体系起始压强为 ,主要发生反应:
,主要发生反应: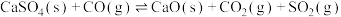 。该反应达到平衡时,
。该反应达到平衡时,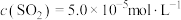 ,CO的转化率为50%,则初始时
,CO的转化率为50%,则初始时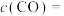

(4)工业上也可用炭粉还原磷石膏,该反应的产物与C/S值(炭粉与
 的物质的量之比)有关。向密闭容器中加入几组不同C/S值的炭粉与磷石膏的混合物,1100℃煅烧至无气体产生,结果如图所示。当C/S值为0.5时,反应产物主要为CaO、
的物质的量之比)有关。向密闭容器中加入几组不同C/S值的炭粉与磷石膏的混合物,1100℃煅烧至无气体产生,结果如图所示。当C/S值为0.5时,反应产物主要为CaO、 和
和 ;当C/S值大于0.7时,反应所得气体中
;当C/S值大于0.7时,反应所得气体中 的体积分数下降,可能的原因是
的体积分数下降,可能的原因是
您最近一年使用:0次
2022-09-21更新
|
142次组卷
|
2卷引用:四川省蓬溪中学校2023-2024学年高二上学期开学考试化学试题
22-23高三上·北京西城·阶段练习
名校
解题方法
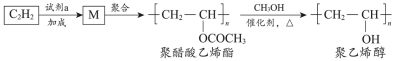
2 . 聚醋酸乙烯酯难溶于水,可用作白乳胶、塑料薄膜和涂料等,用它可得到聚乙烯醇,聚乙烯醇水溶液可用作医用滴眼液。合成路线如下:
已知: (R’、
(R’、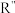 不同的羟基)
不同的羟基)
下列说法不正确 的是

已知:
 (R’、
(R’、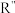 不同的羟基)
不同的羟基)下列说法
| A.试剂a是乙酸 |
| B.通过增加甲醇用量可提高聚乙烯醇的产率 |
| C.由M转化为聚醋酸乙烯酯的过程中发生了缩聚反应 |
| D.由聚醋酸乙烯酯转化为聚乙烯醇过程中还会生成乙酸甲酯 |
您最近一年使用:0次
名校
3 . CO2是一种温室气体,对人类的生存环境产生巨大的影响,将CO2作为原料转化为有用化学品,对实现碳中和及生态环境保护有着重要意义。
Ⅰ.工业上以CO2和NH3为原料合成尿素,在合成塔中存在如下转化:

(1)液相中,合成尿素的热化学方程式为:2NH3(l)+CO2(l) H2O(l)+NH2CONH2(l) ΔH=
H2O(l)+NH2CONH2(l) ΔH=___________ kJ/mol。
Ⅱ.可利用CO2和CH4催化制备合成气(CO、H2),在一定温度下容积为1 L密闭容器中,充入等物质的量CH4和CO2,加入Ni/Al2O3使其发生反应:CH4(g)+CO2(g) 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
(2)制备“合成气”反应历程分两步:
上述反应中C(ads)为吸附性活性炭,反应历程的能量图变化如下图所示:
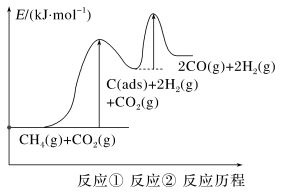
①反应速率快慢比较:反应①___________ 反应②(填“>”“<”或“=”),请依据有效碰撞理论微观探析其原因___________ 。
②一定温度下,反应CH4(g)+CO2(g) 2CO(g)+2H2(g)的平衡常数K=
2CO(g)+2H2(g)的平衡常数K=___________ (用k1、k2、k3、k4表示)。
(3)制备合成气(CO、H2)过程中发生副反应:CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41.0 kJ/mol,在刚性密闭容器中,进料比
CO(g)+H2O(g) ΔH2=+41.0 kJ/mol,在刚性密闭容器中,进料比 分别等于1.0、1.5、2.0,且反应达到平衡状态。反应体系中,
分别等于1.0、1.5、2.0,且反应达到平衡状态。反应体系中, 随温度变化的关系如图所示:
随温度变化的关系如图所示:
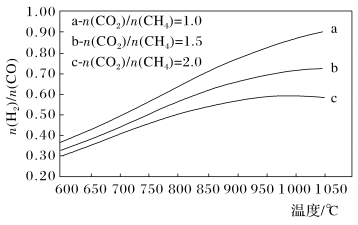
随着进料比 的增加,
的增加, 的值
的值___________ (填“增大”、“不变”或“减小”),其原因是___________ 。
Ⅰ.工业上以CO2和NH3为原料合成尿素,在合成塔中存在如下转化:

(1)液相中,合成尿素的热化学方程式为:2NH3(l)+CO2(l)
 H2O(l)+NH2CONH2(l) ΔH=
H2O(l)+NH2CONH2(l) ΔH=Ⅱ.可利用CO2和CH4催化制备合成气(CO、H2),在一定温度下容积为1 L密闭容器中,充入等物质的量CH4和CO2,加入Ni/Al2O3使其发生反应:CH4(g)+CO2(g)
 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。(2)制备“合成气”反应历程分两步:
| 步骤 | 反应 | 正反应速率方程 | 逆反应速率方程 |
| 反应① | CH4(g) C(ads)+2H2(g) C(ads)+2H2(g) | v正=k1·c(CH4) | v逆=k2·c2(H2) |
| 反应② | C(ads)+CO2(g) 2CO(g) 2CO(g) | v正=k3·c(CO2) | v逆=k4·c2(CO) |

①反应速率快慢比较:反应①
②一定温度下,反应CH4(g)+CO2(g)
 2CO(g)+2H2(g)的平衡常数K=
2CO(g)+2H2(g)的平衡常数K=(3)制备合成气(CO、H2)过程中发生副反应:CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2=+41.0 kJ/mol,在刚性密闭容器中,进料比
CO(g)+H2O(g) ΔH2=+41.0 kJ/mol,在刚性密闭容器中,进料比 分别等于1.0、1.5、2.0,且反应达到平衡状态。反应体系中,
分别等于1.0、1.5、2.0,且反应达到平衡状态。反应体系中, 随温度变化的关系如图所示:
随温度变化的关系如图所示:
随着进料比
 的增加,
的增加, 的值
的值
您最近一年使用:0次
名校
解题方法
4 . 苯酚是重要的有机化工原料,还可用作溶剂、实验试剂和消毒剂,苯酚的水溶液可以使植物细胞内染色体上蛋白质与DNA分离,便于对DNA进行染色,实验小组同学查阅文献后进行苯酚的制备和相关性质的探究。回答下列问题:
I.苯酚的制备
工业上用异丙苯氧化法合成苯酚,其合成原理如下:
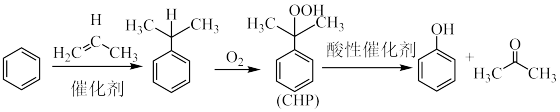
已知:①过氧化氢异丙苯基(CHP)受热易分解。
②相关化合物的物理常数如下表所示:
③苯酚显色反应的原理为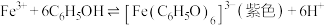 。
。
(1)苯和丙烯在催化下发生烷基化反应生成异丙苯,异丙苯经 氧化生成过氧化氢异丙苯基(CHP),氧化过程中温度不能过高的原因是
氧化生成过氧化氢异丙苯基(CHP),氧化过程中温度不能过高的原因是___________ ,___________ 。
(2)过氧化氢异丙苯基(CHP)在酸性催化剂作用下分解为苯酚和丙酮,再通过蒸馏得到高纯度苯酚。蒸馏时先得到的馏分是___________ 。在蒸馏操作中,下列仪器安装正确的是___________ (填标号)。
A.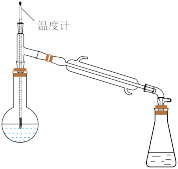 B.
B.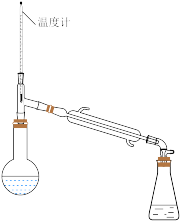 C.
C.  D.
D.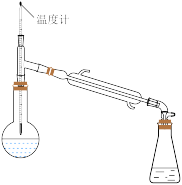
(3)若检验丙酮中是否存在苯酚杂质,可选择的试剂是___________(填标号)。
Ⅱ.探究铁离子与苯酚的显色反应
实验1:

实验2:

【提出猜想】
猜想1: 对铁离子与苯酚的反应有促进作用。
对铁离子与苯酚的反应有促进作用。
猜想2: 对铁离子与苯酚的反应有抑制作用。
对铁离子与苯酚的反应有抑制作用。
(4)若向实验1反应后溶液中继续加入NaCl固体,溶液颜色无变化,由此得出的结论是___________ 。
(5)若向实验1反应后溶液中加入___________ 固体(填化学式),溶液颜色变为浅紫色,说明猜想2成立。
(6)实验小组同学提出猜想3:溶液的pH会影响显色效果。设计如下实验:
①实验ⅱ中红褐色沉淀是___________ (填化学式)。
②实验ⅲ中继续滴加过量盐酸,溶液由紫色变为浅黄色的原因是___________ 。
I.苯酚的制备
工业上用异丙苯氧化法合成苯酚,其合成原理如下:

已知:①过氧化氢异丙苯基(CHP)受热易分解。
②相关化合物的物理常数如下表所示:
| 物质 | 相对分子质量 | 密度/( ) ) | 沸点/℃ |
| 异丙苯 | 120 | 0.8640 | 153 |
| 丙酮 | 58 | 0.7898 | 56.5 |
| 苯酚 | 94 | 1.0722 | 182 |
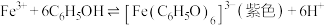 。
。(1)苯和丙烯在催化下发生烷基化反应生成异丙苯,异丙苯经
 氧化生成过氧化氢异丙苯基(CHP),氧化过程中温度不能过高的原因是
氧化生成过氧化氢异丙苯基(CHP),氧化过程中温度不能过高的原因是(2)过氧化氢异丙苯基(CHP)在酸性催化剂作用下分解为苯酚和丙酮,再通过蒸馏得到高纯度苯酚。蒸馏时先得到的馏分是
A.
 B.
B. C.
C.  D.
D.
(3)若检验丙酮中是否存在苯酚杂质,可选择的试剂是___________(填标号)。
| A.酸性高锰酸钾溶液 | B.乙醇 |
| C.石蕊溶液 | D.氢氧化钠溶液 |
Ⅱ.探究铁离子与苯酚的显色反应
实验1:

实验2:

【提出猜想】
猜想1:
 对铁离子与苯酚的反应有促进作用。
对铁离子与苯酚的反应有促进作用。猜想2:
 对铁离子与苯酚的反应有抑制作用。
对铁离子与苯酚的反应有抑制作用。(4)若向实验1反应后溶液中继续加入NaCl固体,溶液颜色无变化,由此得出的结论是
(5)若向实验1反应后溶液中加入
(6)实验小组同学提出猜想3:溶液的pH会影响显色效果。设计如下实验:
| 实验 | 操作 | 现象 |
| ⅰ | 向2mL苯酚溶液(调节pH=5.5)滴加 溶液 溶液 | 溶液显紫色(显色效果最佳) |
| ⅱ | 向2mL苯酚溶液(调节pH=9)滴加 溶液 溶液 | 生成红褐色沉淀 |
| ⅲ | 向实验Ⅱ所得悬浊液中逐滴加入过量 盐酸 盐酸 | 沉淀逐渐溶解,溶液变为紫色;继续滴加过量盐酸,溶液由紫色变为浅黄色 |
②实验ⅲ中继续滴加过量盐酸,溶液由紫色变为浅黄色的原因是
您最近一年使用:0次
5 . 我国在第75届联合国大会上正式提出了2030年实现碳达峰、2060年实现碳中和的目标,所以研发利用二氧化碳技术,降低空气中二氧化碳含量成为重要的任务。
Ⅰ.化石燃料的燃烧产生大量的二氧化碳。已知25℃时,相关物质的燃烧热数据如表:
(1)则25℃时H2(g)和C(石墨,s)生成C2H2(l)的热化学方程式为___________ 。
Ⅱ.二氧化碳甲烷化反应合成替代天然气,是利用二氧化碳的技术之一
甲烷化主反应:CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH =-165 kJ∙mol-1
CH4(g)+2H2O(g) ΔH =-165 kJ∙mol-1
副反应:ⅰ.CO(g)+3H2(g) CH4(g)+H2O(g) ΔH1 =___________;
CH4(g)+H2O(g) ΔH1 =___________;
ⅱ.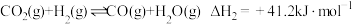 ;
;
ⅲ. =-90kJ∙mol-1;
=-90kJ∙mol-1;
ⅳ. C(s)+H2O(g) CO(g)+H2(g) ΔH4 = +131.3kJ∙mol-1。
CO(g)+H2(g) ΔH4 = +131.3kJ∙mol-1。
(2)反应ⅰ的ΔH1=___________ 。
(3)在恒温恒容的密闭容器中,关于反应ⅲ叙述正确的是___________。
(4)某容器中加入一定量的CO2和H2,保持温度和压强不变的情况下,达平衡后再向该容器中注入Ar稀释,反应ⅲ的化学平衡将___________ (填“正向移动”“逆向移动”或“不移动”),平衡时,CO2的分压P(CO2)___________ (填“增大”、“减小”或“不变”,下同)。
(5)以4molH2和1molCO2为初始原料,在催化剂(Ni/xMg)作用下保持总压为P0时,若只发生反应 ,不同温度下在相同时间测得CO2的转化率如图所示。
,不同温度下在相同时间测得CO2的转化率如图所示。
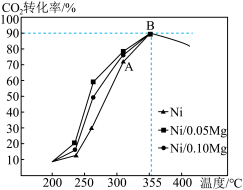
①B点的平衡常数KP___________ 。
②由图像可知,影响该催化剂活性的因素有___________ 。
Ⅰ.化石燃料的燃烧产生大量的二氧化碳。已知25℃时,相关物质的燃烧热数据如表:
| 物质 | H2(g) | C(石墨,s) | C2H2(l) |
| 燃烧热ΔH(kJ∙mol-1) | -285.8 | -393.5 | -1299.5 |
Ⅱ.二氧化碳甲烷化反应合成替代天然气,是利用二氧化碳的技术之一
甲烷化主反应:CO2(g)+4H2(g)
 CH4(g)+2H2O(g) ΔH =-165 kJ∙mol-1
CH4(g)+2H2O(g) ΔH =-165 kJ∙mol-1副反应:ⅰ.CO(g)+3H2(g)
 CH4(g)+H2O(g) ΔH1 =___________;
CH4(g)+H2O(g) ΔH1 =___________;ⅱ.
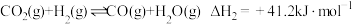 ;
;ⅲ.
 =-90kJ∙mol-1;
=-90kJ∙mol-1;ⅳ. C(s)+H2O(g)
 CO(g)+H2(g) ΔH4 = +131.3kJ∙mol-1。
CO(g)+H2(g) ΔH4 = +131.3kJ∙mol-1。(2)反应ⅰ的ΔH1=
(3)在恒温恒容的密闭容器中,关于反应ⅲ叙述正确的是___________。
| A.用CO2、H2、H2O表示的速率之比为1:2:2,可以作为判断化学平衡的依据。 |
| B.容器中气体的压强不变,不能作为平衡的判断依据。 |
| C.容器内的气体密度不变时,可以作为平衡的判断依据。 |
| D.使用催化剂不能改变平衡转化率。 |
(5)以4molH2和1molCO2为初始原料,在催化剂(Ni/xMg)作用下保持总压为P0时,若只发生反应
 ,不同温度下在相同时间测得CO2的转化率如图所示。
,不同温度下在相同时间测得CO2的转化率如图所示。
①B点的平衡常数KP
②由图像可知,影响该催化剂活性的因素有
您最近一年使用:0次
名校
6 . 甲醇是重要的化工原料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,相关反应的热化学方程式为:
ⅰ.CO(g)+2H2(g) CH3OH(g) ΔH=a kJ/mol;
CH3OH(g) ΔH=a kJ/mol;
ⅱ.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=b kJ/mol;
CH3OH(g)+H2O(g) ΔH=b kJ/mol;
ⅲ.CO2(g)+H2(g) CO(g)+H2O(g) ΔH=−c kJ/mol。
CO(g)+H2O(g) ΔH=−c kJ/mol。
回答下列问题:
(1)a=______ (用b、c表示),已知反应ⅱ在一定条件下可自发进行,则b______ (填“>”“<”或“=”)0。
(2)在一定温度下,向体积为1L的恒容密闭容器中通入等物质的量的CO2与H2,在催化剂的作用下仅发生反应ⅲ。该反应达到平衡时,其他条件不变,通入CO2时,则v(正)___ (填“>”“<”或“=”)v(逆),平衡常数_______ (填“变大”“变小”或“不变”)。
(3)一定温度下,向体积为2L的恒容密闭容器中通入CO、H2、CH3OH,发生反应ⅰ,其中X、Y的物质的量与时间的关系如图所示,反应进行1min时三种物质的体积分数均相等。
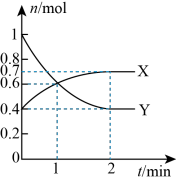
①Y为_____ (填化学式)。
②0~1min时v(CO)为_____ mol/(L·min)。
③该温度下,该反应的平衡常数Kc=______ 。
(4)工业上以 和
和 为原料可制备合成气(CO、H2),已知
为原料可制备合成气(CO、H2),已知 、
、 、CO的燃烧热分别为890 kJ/mol、285kJ/mol、283kJ/mol,则反应
、CO的燃烧热分别为890 kJ/mol、285kJ/mol、283kJ/mol,则反应

______ 。若该反应的 ,
, (
(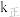 、
、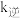 为速率常数,只与温度有关),平衡后降低温度,则
为速率常数,只与温度有关),平衡后降低温度,则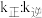
_______ (填“增大”“不变”或“减小”)。
(5)化学反应常伴随热效应。某些反应(如中和反应)的热量变化,其数值Q可通过量热装置测量反应前后体系温度变化,用公式Q=cm△T计算获得。
①热量的测定:取0.5000mol/LNaOH溶液和0.5500mol/L盐酸各50mL进行反应,测得反应前后体系的温度值(℃)分别为T0、T1,(c和 分别取
分别取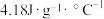 和
和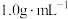 ,忽略水以外各物质吸收的热量,后同),则该实验测得中和热
,忽略水以外各物质吸收的热量,后同),则该实验测得中和热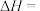
_____  。
。
②下列操作会使所测得的焓变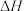 偏小的是
偏小的是______ 。
a.用等物质的量浓度的醋酸代替盐酸实验 b.量热装置绝热效果欠佳 c.NaOH溶液量多了
ⅰ.CO(g)+2H2(g)
 CH3OH(g) ΔH=a kJ/mol;
CH3OH(g) ΔH=a kJ/mol;ⅱ.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH=b kJ/mol;
CH3OH(g)+H2O(g) ΔH=b kJ/mol;ⅲ.CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH=−c kJ/mol。
CO(g)+H2O(g) ΔH=−c kJ/mol。回答下列问题:
(1)a=
(2)在一定温度下,向体积为1L的恒容密闭容器中通入等物质的量的CO2与H2,在催化剂的作用下仅发生反应ⅲ。该反应达到平衡时,其他条件不变,通入CO2时,则v(正)
(3)一定温度下,向体积为2L的恒容密闭容器中通入CO、H2、CH3OH,发生反应ⅰ,其中X、Y的物质的量与时间的关系如图所示,反应进行1min时三种物质的体积分数均相等。
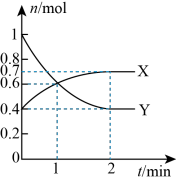
①Y为
②0~1min时v(CO)为
③该温度下,该反应的平衡常数Kc=
(4)工业上以
 和
和 为原料可制备合成气(CO、H2),已知
为原料可制备合成气(CO、H2),已知 、
、 、CO的燃烧热分别为890 kJ/mol、285kJ/mol、283kJ/mol,则反应
、CO的燃烧热分别为890 kJ/mol、285kJ/mol、283kJ/mol,则反应

 ,
, (
(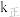 、
、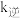 为速率常数,只与温度有关),平衡后降低温度,则
为速率常数,只与温度有关),平衡后降低温度,则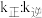
(5)化学反应常伴随热效应。某些反应(如中和反应)的热量变化,其数值Q可通过量热装置测量反应前后体系温度变化,用公式Q=cm△T计算获得。
①热量的测定:取0.5000mol/LNaOH溶液和0.5500mol/L盐酸各50mL进行反应,测得反应前后体系的温度值(℃)分别为T0、T1,(c和
 分别取
分别取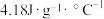 和
和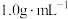 ,忽略水以外各物质吸收的热量,后同),则该实验测得中和热
,忽略水以外各物质吸收的热量,后同),则该实验测得中和热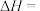
 。
。②下列操作会使所测得的焓变
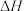 偏小的是
偏小的是a.用等物质的量浓度的醋酸代替盐酸实验 b.量热装置绝热效果欠佳 c.NaOH溶液量多了
您最近一年使用:0次
名校
7 . Ⅰ.将CO2转化为CO、CH3OH等燃料,可以有效的缓解能源危机,同时可以减少温室气体,实现“双碳目标”。
800℃时,H2还原CO2反应的热化学方程式及其平衡常数如下:
ⅰ:CO2(g)+H2(g) CO(g)+H2O(g) ΔH1=+41kJ·mol-1 K1=104
CO(g)+H2O(g) ΔH1=+41kJ·mol-1 K1=104
ⅱ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2=-49.5kJ·mol-1 K2=10-3
CH3OH(g)+H2O(g) ΔH2=-49.5kJ·mol-1 K2=10-3
(1)反应CO(g)+2H2(g) CH3OH(g) ΔH3=
CH3OH(g) ΔH3=___________ kJ·mol-1,K3=___________ 。
Ⅱ.为了减少CO的排放,某环境研究小组以CO和H2为原料合成清洁能源二甲醚(DME),反应如下:4H2(g)+2CO(g) CH3OCH3(g)+H2O(g) ΔH=-198kJ·mol-1。
CH3OCH3(g)+H2O(g) ΔH=-198kJ·mol-1。
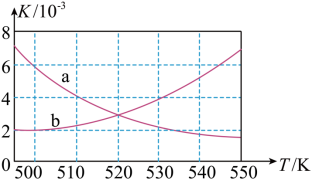
(2)如图所示能正确反映平衡常数K随温度变化关系的曲线为___________ (填曲线标记字母),其判断理由是___________ 。
(3)在一定温度下,向2.0L固定容积的密闭容器中充入2mol H2和1mol CO,经过一段时间后,反应4H2(g)+2CO(g) CH3OCH3(g)+H2O(g)达到平衡。反应过程中测得的部分数据见下表:
CH3OCH3(g)+H2O(g)达到平衡。反应过程中测得的部分数据见下表:
①0~20min的平均反应速率v(CO)=___________ mol·L−1·min−1。
②达到平衡时,H2的转化率为___________ 。
③能表明该反应达到平衡状态的是___________ (填字母)。
A.容器中二甲醚的浓度不变 B.混合气体的平均相对分子质量不变
C.v(CO)与v(H2)的比值不变 D.混合气体的密度不变
800℃时,H2还原CO2反应的热化学方程式及其平衡常数如下:
ⅰ:CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH1=+41kJ·mol-1 K1=104
CO(g)+H2O(g) ΔH1=+41kJ·mol-1 K1=104ⅱ:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH2=-49.5kJ·mol-1 K2=10-3
CH3OH(g)+H2O(g) ΔH2=-49.5kJ·mol-1 K2=10-3(1)反应CO(g)+2H2(g)
 CH3OH(g) ΔH3=
CH3OH(g) ΔH3=Ⅱ.为了减少CO的排放,某环境研究小组以CO和H2为原料合成清洁能源二甲醚(DME),反应如下:4H2(g)+2CO(g)
 CH3OCH3(g)+H2O(g) ΔH=-198kJ·mol-1。
CH3OCH3(g)+H2O(g) ΔH=-198kJ·mol-1。(2)如图所示能正确反映平衡常数K随温度变化关系的曲线为

(3)在一定温度下,向2.0L固定容积的密闭容器中充入2mol H2和1mol CO,经过一段时间后,反应4H2(g)+2CO(g)
 CH3OCH3(g)+H2O(g)达到平衡。反应过程中测得的部分数据见下表:
CH3OCH3(g)+H2O(g)达到平衡。反应过程中测得的部分数据见下表:| 时间/min | 0 | 20 | 40 | 80 | 100 |
| n(H2)/mol | 2.0 | 1.4 | 0.85 | 0.4 | — |
| n(CO)/mol | 1.0 | — | 0.425 | 0.2 | 0.2 |
| n(CH3OCH3)/mol | 0 | 0.15 | — | — | 0.4 |
| n(H2O)/mol | 0 | 0.15 | 0.2875 | 0.4 | 0.4 |
②达到平衡时,H2的转化率为
③能表明该反应达到平衡状态的是
A.容器中二甲醚的浓度不变 B.混合气体的平均相对分子质量不变
C.v(CO)与v(H2)的比值不变 D.混合气体的密度不变
您最近一年使用:0次
解题方法
8 . 我国 加氢制甲醇技术取得了大突破,对解决能源紧缺和环境问题具有重要意义。
加氢制甲醇技术取得了大突破,对解决能源紧缺和环境问题具有重要意义。
(1)铜基催化剂制甲醇其主要反应如下:
Ⅰ. 合成甲醇:
合成甲醇: ;
; ;
;
Ⅱ.逆水煤气反应: ;
; ;
;
Ⅲ.成气合成甲醇: ;
; ;
;
回答下列问题:
①基态 的3d电子轨道表示式为
的3d电子轨道表示式为___________ 。
②
___________  ,
,
___________ (用 ,
, 表示)。
表示)。
(2)若 时将6mol
时将6mol  和8mol
和8mol  充入容积为2L的密闭容器中只发生反应Ⅰ:
充入容积为2L的密闭容器中只发生反应Ⅰ: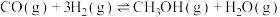 ,
, 的物质的量变化如上表所示。
的物质的量变化如上表所示。
①在 ℃条件下5-10min内,以
℃条件下5-10min内,以 表示的该反应速率
表示的该反应速率
___________ ,该条件下的平衡常数K=___________ 。
②下列说法正确的是___________ 。
A.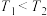
B.混合气体的密度保持不变时,说明反应Ⅰ已达到平衡
C.平衡时向容器中充入惰性气体,反应Ⅰ的平衡正向移动
D.加入适当催化剂,可加快反应速率
(3)某研究小组对催化剂材料进行了研究。下列四组实验,控制 和
和 初始投料比均为1∶2.2,经过相同反应时间(
初始投料比均为1∶2.2,经过相同反应时间( min)
min)
由表格中的数据可知,相同温度下不同的催化剂对 的转化为
的转化为 的选择性有显著影响,根据上表所给数据结合反应原理,所得最优选项为
的选择性有显著影响,根据上表所给数据结合反应原理,所得最优选项为___________ (填字母符号)。
(4)在p=4.00MPa、原料气 、合适催化剂的条件下发生反应,温度对
、合适催化剂的条件下发生反应,温度对 转化率、
转化率、 产率、
产率、 选择性的影响如图所示。已知:
选择性的影响如图所示。已知: 的选择性
的选择性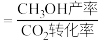 。
。

① 转化率随温度升高而增大的原因可能是
转化率随温度升高而增大的原因可能是___________ 。
② 选择性随温度升高而减小的原因可能是
选择性随温度升高而减小的原因可能是___________ 。
 加氢制甲醇技术取得了大突破,对解决能源紧缺和环境问题具有重要意义。
加氢制甲醇技术取得了大突破,对解决能源紧缺和环境问题具有重要意义。(1)铜基催化剂制甲醇其主要反应如下:
Ⅰ.
 合成甲醇:
合成甲醇: ;
; ;
;
Ⅱ.逆水煤气反应:
 ;
; ;
;
Ⅲ.成气合成甲醇:
 ;
; ;
;
回答下列问题:
①基态
 的3d电子轨道表示式为
的3d电子轨道表示式为②

 ,
,
 ,
, 表示)。
表示)。(2)若
 时将6mol
时将6mol  和8mol
和8mol  充入容积为2L的密闭容器中只发生反应Ⅰ:
充入容积为2L的密闭容器中只发生反应Ⅰ: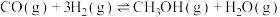 ,
, 的物质的量变化如上表所示。
的物质的量变化如上表所示。| 物质的量/mol |  /℃ /℃ |  /℃ /℃ | |||||
| 0 | 5min | 10min | 15min | 20min | 25min | 30min | |
 | 8.0 | 3.5 | 2.0 | 2.0 | 1.7 | 1.5 | 1.5 |
 ℃条件下5-10min内,以
℃条件下5-10min内,以 表示的该反应速率
表示的该反应速率
②下列说法正确的是
A.
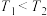
B.混合气体的密度保持不变时,说明反应Ⅰ已达到平衡
C.平衡时向容器中充入惰性气体,反应Ⅰ的平衡正向移动
D.加入适当催化剂,可加快反应速率
(3)某研究小组对催化剂材料进行了研究。下列四组实验,控制
 和
和 初始投料比均为1∶2.2,经过相同反应时间(
初始投料比均为1∶2.2,经过相同反应时间( min)
min)| 温度(K) | 催化剂 |  转化率(%) 转化率(%) | 甲醇选择性(%) | 综合选项 |
| 543 | Cu/ZnO纳米棒材料 | 12.3 | 42.3 | A |
| 543 | Cu/ZnO纳米片材料 | 11.9 | 72.7 | B |
| 553 | Cu/ZnO纳米棒材料 | 15.3 | 39.1 | C |
| 553 | Cu/ZnO纳米片材料 | 12.0 | 71.6 | D |
 的转化为
的转化为 的选择性有显著影响,根据上表所给数据结合反应原理,所得最优选项为
的选择性有显著影响,根据上表所给数据结合反应原理,所得最优选项为(4)在p=4.00MPa、原料气
 、合适催化剂的条件下发生反应,温度对
、合适催化剂的条件下发生反应,温度对 转化率、
转化率、 产率、
产率、 选择性的影响如图所示。已知:
选择性的影响如图所示。已知: 的选择性
的选择性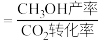 。
。
①
 转化率随温度升高而增大的原因可能是
转化率随温度升高而增大的原因可能是②
 选择性随温度升高而减小的原因可能是
选择性随温度升高而减小的原因可能是
您最近一年使用:0次
名校
9 . 当今世界多国相继规划了碳达峰、碳中和的时间节点。因此,研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。其中用 、
、 为原料合成甲醇(
为原料合成甲醇( )过程主要涉及以下反应:
)过程主要涉及以下反应:
反应Ⅰ:

反应Ⅱ:

反应Ⅲ:
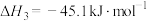
(1)根据盖斯定律,反应Ⅰ的
_______ 。
(2)我国学者结合实验与计算机模拟结果,研究了 与
与 在
在 /Cu催化剂表面生成
/Cu催化剂表面生成 和
和 的部分反应历程,如图所示,其中吸附在催化剂表面的物种用*标注。
的部分反应历程,如图所示,其中吸附在催化剂表面的物种用*标注。
_______ eV。并写出该历程的化学方程式_______ 。
(3)上述反应体系在一定条件下建立平衡后,下列说法正确的有_______(填字母)。
(4)加压,甲醇产率将_______ (填“升高”“不变”“降低”或“无法确定”);若原料二氧化碳中掺混一氧化碳,随一氧化碳含量的增加,甲醇产率将_______ (填“升高”“不变”“降低”或“无法确定”)。
(5)加入新催化剂使1mol 和3mol
和3mol  在1L密闭容器中只发生反应Ⅰ、Ⅱ,
在1L密闭容器中只发生反应Ⅰ、Ⅱ, 平衡转化率和甲醇选择率(甲醇选择率是指转化生成甲醇的
平衡转化率和甲醇选择率(甲醇选择率是指转化生成甲醇的 物质的量分数)与温度的变化趋势如图所示。
物质的量分数)与温度的变化趋势如图所示。_______ (填“473K”“513K”或“553K”)。
②553K时,若反应后体系的总压为p,反应Ⅰ的
_______ (列出计算式)。( 为压强平衡常数,其表达式写法:在浓度平衡常数表达式中用气体分压代替浓度,气体的分压等于总压乘以物质的量分数。)
为压强平衡常数,其表达式写法:在浓度平衡常数表达式中用气体分压代替浓度,气体的分压等于总压乘以物质的量分数。)
 、
、 为原料合成甲醇(
为原料合成甲醇( )过程主要涉及以下反应:
)过程主要涉及以下反应:反应Ⅰ:


反应Ⅱ:


反应Ⅲ:

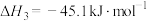
(1)根据盖斯定律,反应Ⅰ的

(2)我国学者结合实验与计算机模拟结果,研究了
 与
与 在
在 /Cu催化剂表面生成
/Cu催化剂表面生成 和
和 的部分反应历程,如图所示,其中吸附在催化剂表面的物种用*标注。
的部分反应历程,如图所示,其中吸附在催化剂表面的物种用*标注。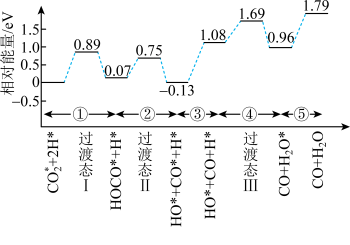

(3)上述反应体系在一定条件下建立平衡后,下列说法正确的有_______(填字母)。
| A.升高温度,反应Ⅱ正向移动,反应Ⅲ逆向移动 |
| B.加入反应Ⅰ的催化剂,可以降低反应的活化能及反应热 |
C.增大 的浓度,有利于提高 的浓度,有利于提高 的平衡转化率 的平衡转化率 |
D.及时分离出 ,可以使得反应Ⅰ的正反应速率增大 ,可以使得反应Ⅰ的正反应速率增大 |
(4)加压,甲醇产率将
(5)加入新催化剂使1mol
 和3mol
和3mol  在1L密闭容器中只发生反应Ⅰ、Ⅱ,
在1L密闭容器中只发生反应Ⅰ、Ⅱ, 平衡转化率和甲醇选择率(甲醇选择率是指转化生成甲醇的
平衡转化率和甲醇选择率(甲醇选择率是指转化生成甲醇的 物质的量分数)与温度的变化趋势如图所示。
物质的量分数)与温度的变化趋势如图所示。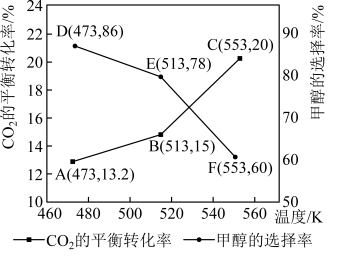
②553K时,若反应后体系的总压为p,反应Ⅰ的

 为压强平衡常数,其表达式写法:在浓度平衡常数表达式中用气体分压代替浓度,气体的分压等于总压乘以物质的量分数。)
为压强平衡常数,其表达式写法:在浓度平衡常数表达式中用气体分压代替浓度,气体的分压等于总压乘以物质的量分数。)
您最近一年使用:0次
2023-09-30更新
|
254次组卷
|
5卷引用:广东省河源中学2023-2024学年上学期高三年级一调考试化学试题
解题方法
10 . 苯甲酸甲酯是一种无色透明油状液体,具有浓郁的冬青油香气,用于配制香水、香精,也可用作有机合成中间体、溶剂等。某实验小组以苯甲酸和甲醇为原料模拟工业合成苯甲酸甲酯,步骤如下:
Ⅰ.制备:向100mL如图所示的装置A中加入磁力搅拌子,然 后依次加入6.1 g苯甲酸、10 mL 95%甲醇、20 mL苯,微热将苯甲酸全部融化后,加入2.5克固体氯化铝催化剂。按如图所示组装好仪器,并预先在分水器内加入水至略低于支管口,加热回流4 h,直至反应基本完成。
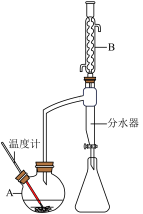
实验过程中分水器得到的液体会分层,需多次开启分水器活塞将下层液体放出。
Ⅱ.分离提纯:待反应液冷却至室温后过滤掉氯化铝,将液体倒入盛有冷水的烧杯中,再经过一系列分离提纯操作,最后蒸馏收集196~199°C馏分,得到5.0 g产品。
可能用到的数据如下:
请回答下列问题:
(1)苯甲酸的沸点高于苯甲酸甲酯的原因为___________ 。
(2)加料时,n(甲醇):n(苯甲酸)约为5:1,甲醇过量的原因是____________ ;但醇酸比超过5:1时,醇酸比的增加对产率影响不大,原因是___________ 。
(3)该实验的温度控制在85°C,应采取的加热方式为___________ 。
(4)实验中需多次将分水器中下层液体放出,其目的是___________ ,判断反应已经完成的标志是___________ 。
(5)步骤Ⅱ中,“一系列分离提纯操作”过程中用到的试剂包括a.无水氯化钙,b.饱和食盐水,c.5% Na2CO3溶液。按操作先后顺序应依次加入___________ (填字母),加入饱和食盐水的作用是___________ 。
(6)传统制法用浓硫酸催化,浓硫酸催化具有活性高,价格低廉的优点,但现代工艺多以固体氯化铝作催化剂。这样改进最主要的原因是___________ 。
Ⅰ.制备:向100mL如图所示的装置A中加入磁力搅拌子,然 后依次加入6.1 g苯甲酸、10 mL 95%甲醇、20 mL苯,微热将苯甲酸全部融化后,加入2.5克固体氯化铝催化剂。按如图所示组装好仪器,并预先在分水器内加入水至略低于支管口,加热回流4 h,直至反应基本完成。

实验过程中分水器得到的液体会分层,需多次开启分水器活塞将下层液体放出。
Ⅱ.分离提纯:待反应液冷却至室温后过滤掉氯化铝,将液体倒入盛有冷水的烧杯中,再经过一系列分离提纯操作,最后蒸馏收集196~199°C馏分,得到5.0 g产品。
可能用到的数据如下:
| 有机物名称 | 相对分子质量 | 密度/(g· cm-3) | 沸点/°C | 溶解性 |
| 苯甲酸 | 122 | 1.26 | 249 | 微溶于水,易溶于乙醇 |
| 甲醇 | 32 | 0.79 | 64.8 | 易溶于水 |
| 苯甲酸甲酯 | 136 | 1.08 | 198 | 难溶于水、易溶于乙醇 |
| 苯 | 78 | 0.88 | 80.1 | 难溶于水 |
(1)苯甲酸的沸点高于苯甲酸甲酯的原因为
(2)加料时,n(甲醇):n(苯甲酸)约为5:1,甲醇过量的原因是
(3)该实验的温度控制在85°C,应采取的加热方式为
(4)实验中需多次将分水器中下层液体放出,其目的是
(5)步骤Ⅱ中,“一系列分离提纯操作”过程中用到的试剂包括a.无水氯化钙,b.饱和食盐水,c.5% Na2CO3溶液。按操作先后顺序应依次加入
(6)传统制法用浓硫酸催化,浓硫酸催化具有活性高,价格低廉的优点,但现代工艺多以固体氯化铝作催化剂。这样改进最主要的原因是
您最近一年使用:0次



