CO2是一种温室气体,对人类的生存环境产生巨大的影响,将CO2作为原料转化为有用化学品,对实现碳中和及生态环境保护有着重要意义。
Ⅰ.工业上以CO2和NH3为原料合成尿素,在合成塔中存在如下转化:

(1)液相中,合成尿素的热化学方程式为:2NH3(l)+CO2(l) H2O(l)+NH2CONH2(l) ΔH=
H2O(l)+NH2CONH2(l) ΔH=___________ kJ/mol。
Ⅱ.可利用CO2和CH4催化制备合成气(CO、H2),在一定温度下容积为1 L密闭容器中,充入等物质的量CH4和CO2,加入Ni/Al2O3使其发生反应:CH4(g)+CO2(g) 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
(2)制备“合成气”反应历程分两步:
上述反应中C(ads)为吸附性活性炭,反应历程的能量图变化如下图所示:
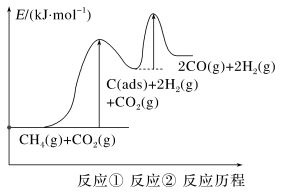
①反应速率快慢比较:反应①___________ 反应②(填“>”“<”或“=”),请依据有效碰撞理论微观探析其原因___________ 。
②一定温度下,反应CH4(g)+CO2(g) 2CO(g)+2H2(g)的平衡常数K=
2CO(g)+2H2(g)的平衡常数K=___________ (用k1、k2、k3、k4表示)。
(3)制备合成气(CO、H2)过程中发生副反应:CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41.0 kJ/mol,在刚性密闭容器中,进料比
CO(g)+H2O(g) ΔH2=+41.0 kJ/mol,在刚性密闭容器中,进料比 分别等于1.0、1.5、2.0,且反应达到平衡状态。反应体系中,
分别等于1.0、1.5、2.0,且反应达到平衡状态。反应体系中, 随温度变化的关系如图所示:
随温度变化的关系如图所示:
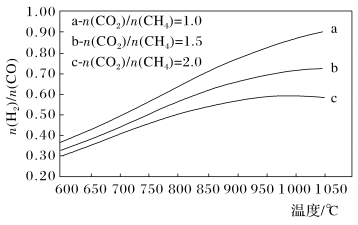
随着进料比 的增加,
的增加, 的值
的值___________ (填“增大”、“不变”或“减小”),其原因是___________ 。
Ⅰ.工业上以CO2和NH3为原料合成尿素,在合成塔中存在如下转化:

(1)液相中,合成尿素的热化学方程式为:2NH3(l)+CO2(l)
 H2O(l)+NH2CONH2(l) ΔH=
H2O(l)+NH2CONH2(l) ΔH=Ⅱ.可利用CO2和CH4催化制备合成气(CO、H2),在一定温度下容积为1 L密闭容器中,充入等物质的量CH4和CO2,加入Ni/Al2O3使其发生反应:CH4(g)+CO2(g)
 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。(2)制备“合成气”反应历程分两步:
| 步骤 | 反应 | 正反应速率方程 | 逆反应速率方程 |
| 反应① | CH4(g) C(ads)+2H2(g) C(ads)+2H2(g) | v正=k1·c(CH4) | v逆=k2·c2(H2) |
| 反应② | C(ads)+CO2(g) 2CO(g) 2CO(g) | v正=k3·c(CO2) | v逆=k4·c2(CO) |

①反应速率快慢比较:反应①
②一定温度下,反应CH4(g)+CO2(g)
 2CO(g)+2H2(g)的平衡常数K=
2CO(g)+2H2(g)的平衡常数K=(3)制备合成气(CO、H2)过程中发生副反应:CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2=+41.0 kJ/mol,在刚性密闭容器中,进料比
CO(g)+H2O(g) ΔH2=+41.0 kJ/mol,在刚性密闭容器中,进料比 分别等于1.0、1.5、2.0,且反应达到平衡状态。反应体系中,
分别等于1.0、1.5、2.0,且反应达到平衡状态。反应体系中, 随温度变化的关系如图所示:
随温度变化的关系如图所示:
随着进料比
 的增加,
的增加, 的值
的值
更新时间:2024-04-08 17:38:41
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】近年来雾霾天气经常肆虐北京、天津、河北等地区,其中汽车尾气和燃煤是造成空气污染的原因之一。因此研究氮氧化物的反应机理,对消除和防治环境污染有重要意义。
(1) 对于2NO(g) + 2H2(g) = N2(g) + 2H2O(g) △H = − 665 kJ/mol 的反应分三步完成:
① 2NO(g) = N2O2(g) (快)
② N2O2(g) + H2(g) = N2O(g) + H2O(g) (慢)
③______________________________ (快),请完成第③步的化学方程式。因此决定此总反应速率的是第_____ 步的反应。(填序号)
(2) 已知:H2(g) + CO2(g) = H2O(g) + CO(g) △H = + 41 kJ/mol汽车尾气的净化原理主要是用催化剂把NO与CO反应转化为两种对大气无污染的气体,试写出该反应的热化学方程式:______________ 。
该反应在一定条件下达到平衡后,为了能加快反应速率并让反应向正方向移动,可采取的措施有:( )
A.适当升高温度 B.适当降低温度 C.压缩体积增大压强 D.使用正催化剂
该反应采取上述措施重新达到平衡后K值将______ (填“增大”、“减小”和“不变”)
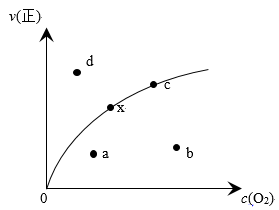
(3) 升高温度能让绝大多数的化学反应加快反应速率,但是研究发现2NO(g) + O2(g) = 2NO2(g) △H < 0 存在一些特殊现象。现有某化学小组通过实验测得不同温度下该反应速率常数k (代表反应速率的一个常数)的数值如下表:
由实验数据测到v(正)~c(O2)的关系如图所示,当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为_____ 点(填字母),并解析原因:①__________ ,②__________ 。
(1) 对于2NO(g) + 2H2(g) = N2(g) + 2H2O(g) △H = − 665 kJ/mol 的反应分三步完成:
① 2NO(g) = N2O2(g) (快)
② N2O2(g) + H2(g) = N2O(g) + H2O(g) (慢)
③
(2) 已知:H2(g) + CO2(g) = H2O(g) + CO(g) △H = + 41 kJ/mol汽车尾气的净化原理主要是用催化剂把NO与CO反应转化为两种对大气无污染的气体,试写出该反应的热化学方程式:
该反应在一定条件下达到平衡后,为了能加快反应速率并让反应向正方向移动,可采取的措施有:
A.适当升高温度 B.适当降低温度 C.压缩体积增大压强 D.使用正催化剂
该反应采取上述措施重新达到平衡后K值将
(3) 升高温度能让绝大多数的化学反应加快反应速率,但是研究发现2NO(g) + O2(g) = 2NO2(g) △H < 0 存在一些特殊现象。现有某化学小组通过实验测得不同温度下该反应速率常数k (代表反应速率的一个常数)的数值如下表:
| T(K) | k | T(K) | k | T(K) | k |
| 143 | 1.48 × 105 | 273 | 1.04 × 104 | 514 | 3.00 × 103 |
| 195 | 2.58 × 104 | 333 | 5.50 × 103 | 613 | 2.80 × 103 |
| 254 | 1.30 × 104 | 414 | 4.00 × 103 | 663 | 2.50 × 103 |

您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】回答下列问题
(1)已知:2Zn(s)+O2(g)=2ZnO(s) ΔH=-701.0 kJ/mol
2Hg(l)+O2(g)= 2HgO(s) ΔH=-181.6 kJ/mol
则Zn和HgO反应生成ZnO和Hg的热化学方程式为_______
(2)某温度时,在一密闭容器中,A、B、C三种物质的物质的量随时间的变化曲线如图所示。
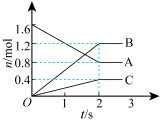
则该反应的化学方程式为_______ (用A、B、C表示)
(3)温度一定时, 于密闭容器中发生可逆反应: mA(g) + nB(g) pC(g), 达到平衡, 若将混合气体的体积压缩到原来的 1/2, 当再次达到平衡时, C的浓度为原平衡时C的浓度的 1.9 倍, 则 m + n
pC(g), 达到平衡, 若将混合气体的体积压缩到原来的 1/2, 当再次达到平衡时, C的浓度为原平衡时C的浓度的 1.9 倍, 则 m + n _______ p(填“>、<、=” )。
(1)已知:2Zn(s)+O2(g)=2ZnO(s) ΔH=-701.0 kJ/mol
2Hg(l)+O2(g)= 2HgO(s) ΔH=-181.6 kJ/mol
则Zn和HgO反应生成ZnO和Hg的热化学方程式为
(2)某温度时,在一密闭容器中,A、B、C三种物质的物质的量随时间的变化曲线如图所示。

则该反应的化学方程式为
(3)温度一定时, 于密闭容器中发生可逆反应: mA(g) + nB(g)
 pC(g), 达到平衡, 若将混合气体的体积压缩到原来的 1/2, 当再次达到平衡时, C的浓度为原平衡时C的浓度的 1.9 倍, 则 m + n
pC(g), 达到平衡, 若将混合气体的体积压缩到原来的 1/2, 当再次达到平衡时, C的浓度为原平衡时C的浓度的 1.9 倍, 则 m + n
您最近半年使用:0次
【推荐3】国家实施“青山绿水工程”,大力研究脱硝和脱硫技术。
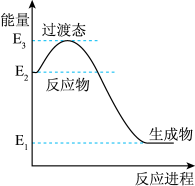
(1)H2在催化剂作用下可将NO还原为N2。下图是该反应生成1 mol水蒸气的能量变化示意图。写出该反应的热化学方程式____________ (△H可用E1、E2、E3表示)。
(2)我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2=H2O2+S↓
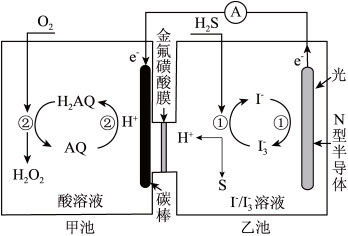
①装置中H+向________ 池迁移。
②乙池溶液中发生反应的离子方程式:____________
(3)2NO(g)+O2(g)⇌2NO2(g)的反应历程如下:
反应I:2NO(g)⇌N2O2(g)(快); <0 v1正=k1正 ▪c2(NO) 、v1逆=k1逆 ▪c(N2O2)
<0 v1正=k1正 ▪c2(NO) 、v1逆=k1逆 ▪c(N2O2)
反应Ⅱ:N2O2(g)+O2(g)⇌2NO2(g)(慢) 2<0 v2正=k2正 ▪c(N2O2)▪c(O2) v2逆=k2逆 ▪c2(NO2);
2<0 v2正=k2正 ▪c(N2O2)▪c(O2) v2逆=k2逆 ▪c2(NO2);
在一定条件下,反应2NO(g)+O2(g)⇌2NO2(g)达到平衡状态,平衡常数=___________ (用含K1正、K1逆、K2正、K2逆的代数式表示)。
(4)废水处理时,通H2S(或加S2-)能使某些金属离子生成极难溶的硫化物而除去。25°℃,某废液中c(Mn2+)=0.02mol·L-1,调节废液的pH使Mn2+开始沉淀为MnS时,废液中c(H2S)=0.1mol·L-1,此时pH约为____ 。(已知:Ksp(MnS)=5.0×10-14,H2S的电离常数:K1=1.5×10-7,K2=6.0×10-15,1g6=0.8)
(1)H2在催化剂作用下可将NO还原为N2。下图是该反应生成1 mol水蒸气的能量变化示意图。写出该反应的热化学方程式

(2)我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2=H2O2+S↓

①装置中H+向
②乙池溶液中发生反应的离子方程式:
(3)2NO(g)+O2(g)⇌2NO2(g)的反应历程如下:
反应I:2NO(g)⇌N2O2(g)(快);
 <0 v1正=k1正 ▪c2(NO) 、v1逆=k1逆 ▪c(N2O2)
<0 v1正=k1正 ▪c2(NO) 、v1逆=k1逆 ▪c(N2O2) 反应Ⅱ:N2O2(g)+O2(g)⇌2NO2(g)(慢)
 2<0 v2正=k2正 ▪c(N2O2)▪c(O2) v2逆=k2逆 ▪c2(NO2);
2<0 v2正=k2正 ▪c(N2O2)▪c(O2) v2逆=k2逆 ▪c2(NO2);在一定条件下,反应2NO(g)+O2(g)⇌2NO2(g)达到平衡状态,平衡常数=
(4)废水处理时,通H2S(或加S2-)能使某些金属离子生成极难溶的硫化物而除去。25°℃,某废液中c(Mn2+)=0.02mol·L-1,调节废液的pH使Mn2+开始沉淀为MnS时,废液中c(H2S)=0.1mol·L-1,此时pH约为
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】研究人员开发新型Cu-Pd催化剂实现CO还原制备CH3COOH:2CO(g)+2H2(g) CH3COOH(g)△H。
CH3COOH(g)△H。
(1)已知:①CO(g)+ O2(g)=CO2(g)△H1
O2(g)=CO2(g)△H1
②H2(g)+ O2(g)=H2O(l)△H2
O2(g)=H2O(l)△H2
③CH3COOH(g)+2O2(g)=2CO2(g)+2H2O(l)△H3
上述反应中,△H=______ (用△H1、△H2、△H3的代数式表示)。
(2)一定温度下,在2L恒容密闭容器中充入4molCO和3molH2,发生上述反应。测得CH3COOH的物质的量(mol)与时间(min)的关系如表所示。
下列说法错误的是_____ (填标号)。
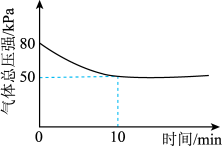
(3)在某温度下,向2L恒容密闭容器中充入2molCO和2molH2,发生上述反应,测得混合气体总压强变化如图所示。0~5min内v(H2)_____ (填“大于“小于”或“等于”)5~10min内v(H2)。该温度下,上述反应的平衡常数K=_____ (mol•L-1)-3。
(4)一定条件下CO2和H2可制得甲酸(HCOOH),又名蚁酸,是一种常见的弱酸,催化甲酸分解的一种反应机理和相对能量的变化情况如图所示。
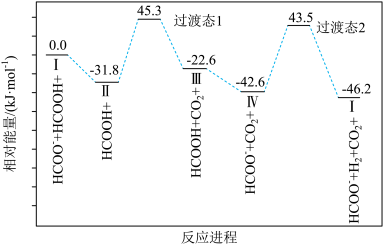
①已知催化剂“I”带一个正电荷,反应过程中的中间产物也带一个正电荷的是_____ (填“II”“III”或“IV”)。
②由反应进程可知甲酸分解的△H_____ (填“>”“=”或“<”)0,该历程中的决速步骤为_____ (填选项字母)
a.I转化为II的过程b.II转化为III的过程
c.III转化为IV的过程d.IV转化为I的过程
 CH3COOH(g)△H。
CH3COOH(g)△H。(1)已知:①CO(g)+
 O2(g)=CO2(g)△H1
O2(g)=CO2(g)△H1②H2(g)+
 O2(g)=H2O(l)△H2
O2(g)=H2O(l)△H2③CH3COOH(g)+2O2(g)=2CO2(g)+2H2O(l)△H3
上述反应中,△H=
(2)一定温度下,在2L恒容密闭容器中充入4molCO和3molH2,发生上述反应。测得CH3COOH的物质的量(mol)与时间(min)的关系如表所示。
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
| n(CH3COOH)/mol | 0.00 | 0.80 | 1.00 | 1.20 | 1.30 | 1.30 |
| A.15~20min时混合气体的密度不随时间变化 |
| B.CO消耗速率等于乙酸消耗速率的3倍时达到平衡状态 |
| C.0~10min内v(H2)=0.05mol•L-1•min-1 |
| D.上述条件下CO的平衡转化率为65% |

(4)一定条件下CO2和H2可制得甲酸(HCOOH),又名蚁酸,是一种常见的弱酸,催化甲酸分解的一种反应机理和相对能量的变化情况如图所示。

①已知催化剂“I”带一个正电荷,反应过程中的中间产物也带一个正电荷的是
②由反应进程可知甲酸分解的△H
a.I转化为II的过程b.II转化为III的过程
c.III转化为IV的过程d.IV转化为I的过程
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】铁及其化合物在生产、生活中有广泛的应用。
(1)中科院兰州化学物理研究所用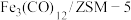 催化
催化 加氢合成低碳烯烃反应,反应过程如图,催化剂中添加助剂
加氢合成低碳烯烃反应,反应过程如图,催化剂中添加助剂 (也起催化作用)后可改变反应的选择性。
(也起催化作用)后可改变反应的选择性。
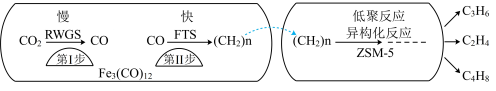
下列说法正确的是___________ 。
a.第1步所发生的反应为: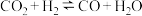
b.第1步反应的活化能低于第2步
c.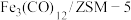 使
使 加氢合成低碳烯烃的
加氢合成低碳烯烃的 减小
减小
d.添加不同助剂后,各反应的平衡常数不变
(2)纳米铁是重要的储氢材料,可用反应 制得。在
制得。在 恒容密闭容器中加入足量铁粉和
恒容密闭容器中加入足量铁粉和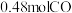 ,在
,在 不同温度下进行反应,测得
不同温度下进行反应,测得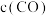 与温度、时间的关系如图所示。
与温度、时间的关系如图所示。
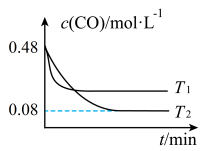

___________ 0(填“>”或“<”);
(3) 温度下,平衡时体系的压强为
温度下,平衡时体系的压强为 ,反应的标准平衡常数
,反应的标准平衡常数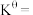
___________ (已知:标准平衡常数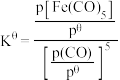 ,其中
,其中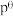 为标准压强
为标准压强 为各组分的平衡分压。)
为各组分的平衡分压。)
(4)高铁酸钾 被称为“绿色化学”净水剂,在酸性至弱碱性条件下不稳定。
被称为“绿色化学”净水剂,在酸性至弱碱性条件下不稳定。
①电解法可制得 ,装置如图,阳极电极反应式为
,装置如图,阳极电极反应式为___________ 。

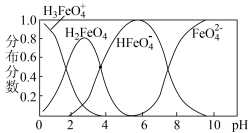
② 在水解过程中铁元素形成的微粒分布分数与
在水解过程中铁元素形成的微粒分布分数与 的关系如图所示,向
的关系如图所示,向 的溶液中加入
的溶液中加入 溶液,发生反应的离子方程式为
溶液,发生反应的离子方程式为___________ 。
(5)复合氧化物铁酸锰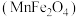 可用于热化学循环分解制氢气,原理如下:
可用于热化学循环分解制氢气,原理如下:
①

②

③

则: 与
与 、
、 的关系为
的关系为
___________
(1)中科院兰州化学物理研究所用
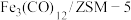 催化
催化 加氢合成低碳烯烃反应,反应过程如图,催化剂中添加助剂
加氢合成低碳烯烃反应,反应过程如图,催化剂中添加助剂 (也起催化作用)后可改变反应的选择性。
(也起催化作用)后可改变反应的选择性。
下列说法正确的是
a.第1步所发生的反应为:
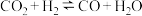
b.第1步反应的活化能低于第2步
c.
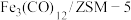 使
使 加氢合成低碳烯烃的
加氢合成低碳烯烃的 减小
减小d.添加不同助剂后,各反应的平衡常数不变
(2)纳米铁是重要的储氢材料,可用反应
 制得。在
制得。在 恒容密闭容器中加入足量铁粉和
恒容密闭容器中加入足量铁粉和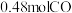 ,在
,在 不同温度下进行反应,测得
不同温度下进行反应,测得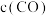 与温度、时间的关系如图所示。
与温度、时间的关系如图所示。

(3)
 温度下,平衡时体系的压强为
温度下,平衡时体系的压强为 ,反应的标准平衡常数
,反应的标准平衡常数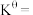
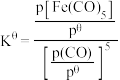 ,其中
,其中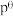 为标准压强
为标准压强 为各组分的平衡分压。)
为各组分的平衡分压。)(4)高铁酸钾
 被称为“绿色化学”净水剂,在酸性至弱碱性条件下不稳定。
被称为“绿色化学”净水剂,在酸性至弱碱性条件下不稳定。①电解法可制得
 ,装置如图,阳极电极反应式为
,装置如图,阳极电极反应式为
②
 在水解过程中铁元素形成的微粒分布分数与
在水解过程中铁元素形成的微粒分布分数与 的关系如图所示,向
的关系如图所示,向 的溶液中加入
的溶液中加入 溶液,发生反应的离子方程式为
溶液,发生反应的离子方程式为
(5)复合氧化物铁酸锰
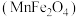 可用于热化学循环分解制氢气,原理如下:
可用于热化学循环分解制氢气,原理如下: ①


②


③


则:
 与
与 、
、 的关系为
的关系为
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】尿素是一种重要的氮肥,也是一种化工原料。合成尿素能回收利用二氧化碳,实现碳的固定。
(1)合成尿素分图示的两步进行:
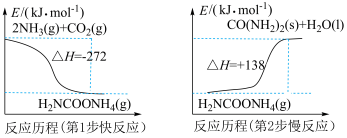
反应 的反应热为
的反应热为_______ 。
(2)某课题组使用氢氧化铟 纳米晶电催化剂直接由
纳米晶电催化剂直接由 和
和 高选择性地合成
高选择性地合成 。
。

①上述 和
和 转化中,被还原的物质是
转化中,被还原的物质是_______ (填化学式)。
②上述转化中,控速步骤是_______ (填标号)。
A. B.
B.
C. D.
D.
(3)在恒温恒容密闭容器中投入1mol 和2mol
和2mol 合成尿素,原理是
合成尿素,原理是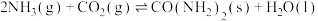 。下列表明该反应达到平衡状态的是_______。
。下列表明该反应达到平衡状态的是_______。
(4)在恒容密闭容器中发生反应: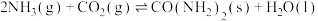 ,测得
,测得 的平衡转化率与起始投料比[
的平衡转化率与起始投料比[ ,
, 分别为1:1、2:1、3:1]、温度关系如图。①在相同投料比下,升高温度,
分别为1:1、2:1、3:1]、温度关系如图。①在相同投料比下,升高温度, 的平衡转化率降低的主要原因是
的平衡转化率降低的主要原因是_______ 。
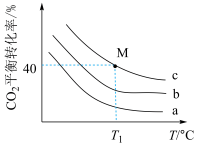
②曲线a代表的投料比为_______ 。
③若 下,从反应开始至达到M点历时5min,测得M点对应的总压强为140kPa,则0~5min内,
下,从反应开始至达到M点历时5min,测得M点对应的总压强为140kPa,则0~5min内, 分压的平均变化率为
分压的平均变化率为_______ 
(1)合成尿素分图示的两步进行:

反应
 的反应热为
的反应热为(2)某课题组使用氢氧化铟
 纳米晶电催化剂直接由
纳米晶电催化剂直接由 和
和 高选择性地合成
高选择性地合成 。
。
①上述
 和
和 转化中,被还原的物质是
转化中,被还原的物质是②上述转化中,控速步骤是
A.
 B.
B.
C.
 D.
D.
(3)在恒温恒容密闭容器中投入1mol
 和2mol
和2mol 合成尿素,原理是
合成尿素,原理是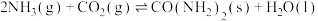 。下列表明该反应达到平衡状态的是_______。
。下列表明该反应达到平衡状态的是_______。| A.气体密度不随时间变化 | B. 体积分数不随时间变化 体积分数不随时间变化 |
| C.气体总压强不随时间变化 | D. 、 、 的转化率之比不随时间变化 的转化率之比不随时间变化 |
(4)在恒容密闭容器中发生反应:
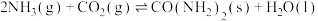 ,测得
,测得 的平衡转化率与起始投料比[
的平衡转化率与起始投料比[ ,
, 分别为1:1、2:1、3:1]、温度关系如图。①在相同投料比下,升高温度,
分别为1:1、2:1、3:1]、温度关系如图。①在相同投料比下,升高温度, 的平衡转化率降低的主要原因是
的平衡转化率降低的主要原因是
②曲线a代表的投料比为
③若
 下,从反应开始至达到M点历时5min,测得M点对应的总压强为140kPa,则0~5min内,
下,从反应开始至达到M点历时5min,测得M点对应的总压强为140kPa,则0~5min内, 分压的平均变化率为
分压的平均变化率为
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】X、Y、Z、R、M、N为六种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。
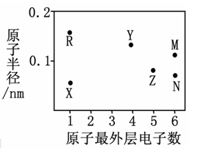
(1)M元素的原子核外有__________ 种能量不同的电子,有__________ 个未成对电子;Z元素在元素周期表中的位置是第______ 周期________ 族。
(2)N、R、X三种元素的原子可构成一种强碱性物质,该物质的电子式是_____________ ;Y元素的氧化物是制造光纤的主要材料,该氧化物是________ 晶体(填晶体类型)。
某化工生产的核心环节的反应为:2MN2(g) + N2(g) ⇌ 2 MN3(g) + Q(Q>0)
(3)该反应的平衡常数表达式K=__________________________ ;欲使K值变大,可采取的措施是__________________________ 。
(4)该反应达到平衡后,在其他条件不变的情况下,若使容器的体积扩大为原来的两倍,则平衡____________________ 。(选填“正向移动”、“逆向移动”或“不移动”)

(1)M元素的原子核外有
(2)N、R、X三种元素的原子可构成一种强碱性物质,该物质的电子式是
某化工生产的核心环节的反应为:2MN2(g) + N2(g) ⇌ 2 MN3(g) + Q(Q>0)
(3)该反应的平衡常数表达式K=
(4)该反应达到平衡后,在其他条件不变的情况下,若使容器的体积扩大为原来的两倍,则平衡
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】根据要求填空:
(1)FeSO4可转化为FeCO3,FeCO3在空气中加热可制得铁系氧化物材料。已知25℃,101kPa时:4Fe(s)+3O2(g)
=2Fe2O3(s)ΔH=-1648kJ/mol,C(s)+O2(g)=CO2(g) ΔH=-393kJ/mol,2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) ΔH=-1480kJ/mol,FeCO3在空气中加热反应生成Fe2O3的热化学方程式为_______ 。
(2)一定条件下,向容积可变的密闭容器中通入N2和H2,发生反应:N2(g)+3H2(g) 2NH3(g) ΔH<0达到平衡后,试回答下列问题:
2NH3(g) ΔH<0达到平衡后,试回答下列问题:
①达到平衡后,若其它条件不变,把容器体积缩小一半,平衡将____ (填“向逆反应方向”、“向正反应方向”或“不”)移动,平衡常数K将_____ (填“增大”、“减小”或“不变”)。
②达到平衡后,在恒压条件下,向容器中通入氦气(He),氮气的转化率将___ (填“增大”、“减小”或“不变”)。
(3)AlCl3溶液加热蒸干并灼烧最终得到物质是________ (填化学式),将NaHCO3与Al2 (SO4)3溶液混合后可做泡沫灭火剂,其原理是_______ (用离子方程式表示)。
(1)FeSO4可转化为FeCO3,FeCO3在空气中加热可制得铁系氧化物材料。已知25℃,101kPa时:4Fe(s)+3O2(g)
=2Fe2O3(s)ΔH=-1648kJ/mol,C(s)+O2(g)=CO2(g) ΔH=-393kJ/mol,2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) ΔH=-1480kJ/mol,FeCO3在空气中加热反应生成Fe2O3的热化学方程式为
(2)一定条件下,向容积可变的密闭容器中通入N2和H2,发生反应:N2(g)+3H2(g)
 2NH3(g) ΔH<0达到平衡后,试回答下列问题:
2NH3(g) ΔH<0达到平衡后,试回答下列问题:①达到平衡后,若其它条件不变,把容器体积缩小一半,平衡将
②达到平衡后,在恒压条件下,向容器中通入氦气(He),氮气的转化率将
(3)AlCl3溶液加热蒸干并灼烧最终得到物质是
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】某研究小组对下列有关甲醇制取的三条化学反应原理进行探究。已知在不同温度下的化学反应平衡常数如下表所示。请回答下列问题:
(1)根据上述反应可推导出 、
、 与
与 之间的关系:
之间的关系:
_______ ;
(2)根据反应③判断熵变
_______ 0(填“>”“=”或“<”),依据反应自发进行的判据:ΔG=ΔH-TΔS<0时反应可自发进行,判断:在_______ (填“较高”或“较低”)温度下有利于该反应自发进行。
(3)500℃下,测得反应③在某时刻时,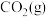 、
、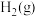 、
、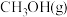 、
、 的浓度分别为
的浓度分别为 、
、 、
、 、
、 ,则此时v正
,则此时v正____ v逆(填“>”“=”或“<”)。
(4)提高反应③的反应速率且增大 的产率,可采取的措施_______。
的产率,可采取的措施_______。
(5) 捕获和转化可减少
捕获和转化可减少 排放并实现资源利用,原理如图1所示。反应④完成之后,以
排放并实现资源利用,原理如图1所示。反应④完成之后,以 为载气,将恒定组成的
为载气,将恒定组成的 、
、 混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图2所示。反应过程中始终未检测到
混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图2所示。反应过程中始终未检测到 ,在催化剂上有积碳。
,在催化剂上有积碳。
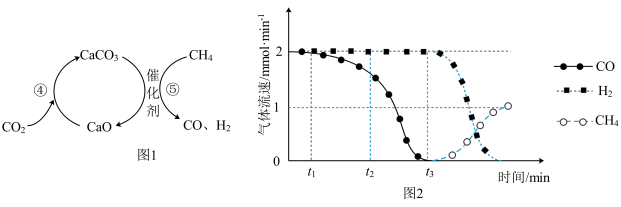
则反应⑤的化学方程式为_______ ,下列叙述正确的是_______ 。
A. ,
, 比
比 多,且生成
多,且生成 速率不变,有可能是发生副反应
速率不变,有可能是发生副反应
B. 时刻,副反应生成
时刻,副反应生成 的速率大于反应⑤生成
的速率大于反应⑤生成 速率
速率
C. 之后,生成
之后,生成 的速率为0,是因为反应⑤不再发生
的速率为0,是因为反应⑤不再发生
| 化学反应 | 平衡常数 | |||
| 500℃ | 700℃ | 800℃ | ||
①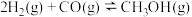  |  | 2.5 | 0.34 | 0.15 |
②  |  | 1.0 | 1.70 | 2.52 |
③  |  | |||
 、
、 与
与 之间的关系:
之间的关系:
(2)根据反应③判断熵变

(3)500℃下,测得反应③在某时刻时,
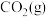 、
、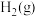 、
、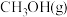 、
、 的浓度分别为
的浓度分别为 、
、 、
、 、
、 ,则此时v正
,则此时v正(4)提高反应③的反应速率且增大
 的产率,可采取的措施_______。
的产率,可采取的措施_______。| A.扩大反应容器的容积 | B.使用合适的催化剂 |
| C.缩小反应容器的容积 | D.从平衡体系中及时分离出 |
 捕获和转化可减少
捕获和转化可减少 排放并实现资源利用,原理如图1所示。反应④完成之后,以
排放并实现资源利用,原理如图1所示。反应④完成之后,以 为载气,将恒定组成的
为载气,将恒定组成的 、
、 混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图2所示。反应过程中始终未检测到
混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图2所示。反应过程中始终未检测到 ,在催化剂上有积碳。
,在催化剂上有积碳。
则反应⑤的化学方程式为
A.
 ,
, 比
比 多,且生成
多,且生成 速率不变,有可能是发生副反应
速率不变,有可能是发生副反应
B.
 时刻,副反应生成
时刻,副反应生成 的速率大于反应⑤生成
的速率大于反应⑤生成 速率
速率C.
 之后,生成
之后,生成 的速率为0,是因为反应⑤不再发生
的速率为0,是因为反应⑤不再发生
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】“ 氧化法”和“光催化氧化法”常用于烟气脱硫、脱硝,对环境保护意义重大。回答下列问题:
氧化法”和“光催化氧化法”常用于烟气脱硫、脱硝,对环境保护意义重大。回答下列问题:
Ⅰ. 氧化法
氧化法
(1)用 氧化烟气中的
氧化烟气中的 时,体系中存在以下反应:
时,体系中存在以下反应:
a)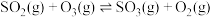

b)
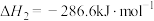
c)
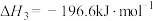
根据盖斯定律,
_______ 。
(2)在密闭容器中充入
 和
和
 ,发生以下反应:
,发生以下反应:
d)
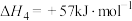
e)
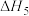
不同压强(p)下, 的平衡转化率
的平衡转化率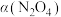 随反应温度(T)的变化关系如下图所示:
随反应温度(T)的变化关系如下图所示:
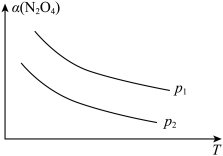
①由图可知,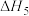
_______ 0(填“大于”或“小于”下同),
_______  。
。
②下列有关该反应体系的说法正确的是_______ (填标号)。
A.恒压下,混合气体的密度保持不变时,说明反应体系已达到平衡
B.任意时刻,存在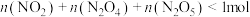
C.恒容下,升高温度,该体系中气体颜色变浅
D.恒容下,增大 的浓度,反应d、e的正反应速率均增大
的浓度,反应d、e的正反应速率均增大
③某温度下,平衡时 的物质的量分数为
的物质的量分数为 ,且
,且 与
与 的物质的量分数相等,此时
的物质的量分数相等,此时
_______ mol。
Ⅱ.光催化氧化法
光照条件下,催化剂 表面产生电子(
表面产生电子( )和空穴(
)和空穴( )。电子与
)。电子与 作用生成离子自由基(
作用生成离子自由基( ),空穴与水电离出的
),空穴与水电离出的 作用生成羟基自由基(
作用生成羟基自由基( ),
), 和
和 分别与
分别与 反应生成
反应生成 。变化过程如下图所示:
。变化过程如下图所示:

(3)一定范围内,NO脱除速率随烟气湿度的增大而增大,结合催化剂的作用机理,分析可能的原因_______ 。
(4)已知该过程中生成的 可继续与
可继续与 发生反应:
发生反应: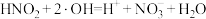 ;该反应可分两步进行,请补充反应ⅰ:
;该反应可分两步进行,请补充反应ⅰ:
ⅰ._______ ;
ⅱ.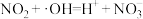 。
。
(5)理论上“光催化氧化法”中,消耗的 与生成的
与生成的 的物质的量之比为
的物质的量之比为_______ 。
 氧化法”和“光催化氧化法”常用于烟气脱硫、脱硝,对环境保护意义重大。回答下列问题:
氧化法”和“光催化氧化法”常用于烟气脱硫、脱硝,对环境保护意义重大。回答下列问题:Ⅰ.
 氧化法
氧化法(1)用
 氧化烟气中的
氧化烟气中的 时,体系中存在以下反应:
时,体系中存在以下反应:a)
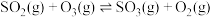

b)

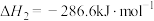
c)

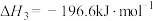
根据盖斯定律,

(2)在密闭容器中充入

 和
和
 ,发生以下反应:
,发生以下反应:d)

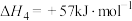
e)

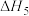
不同压强(p)下,
 的平衡转化率
的平衡转化率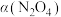 随反应温度(T)的变化关系如下图所示:
随反应温度(T)的变化关系如下图所示:
①由图可知,
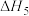

 。
。②下列有关该反应体系的说法正确的是
A.恒压下,混合气体的密度保持不变时,说明反应体系已达到平衡
B.任意时刻,存在
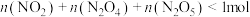
C.恒容下,升高温度,该体系中气体颜色变浅
D.恒容下,增大
 的浓度,反应d、e的正反应速率均增大
的浓度,反应d、e的正反应速率均增大③某温度下,平衡时
 的物质的量分数为
的物质的量分数为 ,且
,且 与
与 的物质的量分数相等,此时
的物质的量分数相等,此时
Ⅱ.光催化氧化法
光照条件下,催化剂
 表面产生电子(
表面产生电子( )和空穴(
)和空穴( )。电子与
)。电子与 作用生成离子自由基(
作用生成离子自由基( ),空穴与水电离出的
),空穴与水电离出的 作用生成羟基自由基(
作用生成羟基自由基( ),
), 和
和 分别与
分别与 反应生成
反应生成 。变化过程如下图所示:
。变化过程如下图所示:
(3)一定范围内,NO脱除速率随烟气湿度的增大而增大,结合催化剂的作用机理,分析可能的原因
(4)已知该过程中生成的
 可继续与
可继续与 发生反应:
发生反应: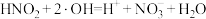 ;该反应可分两步进行,请补充反应ⅰ:
;该反应可分两步进行,请补充反应ⅰ:ⅰ.
ⅱ.
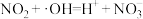 。
。(5)理论上“光催化氧化法”中,消耗的
 与生成的
与生成的 的物质的量之比为
的物质的量之比为
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
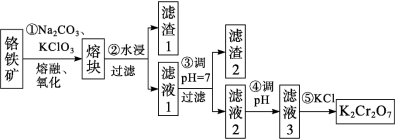
【推荐2】重铬酸钾在工业中有广泛的应用,可用铬铁矿为原料制备。以铬铁矿(主要成分可表示为FeO·Cr2O3,还含有SiO2、Al2O3、Fe2O3等杂质)制备重铬酸钾(K2Cr2O7)固体的工艺流程如下:
资料:① NaFeO2遇水强烈水解。
② +H2O
+H2O
 +2H+。
+2H+。
(1)K2Cr2O7中Cr元素的化合价是___________ 。
(2)步骤①发生多个反应,补全下列化学方程式。___________
FeO·Cr2O3+___________Na2CO3+___________KClO3=12Na2CrO4+___________Fe2O3+___________CO2↑+___________KCl
(3)熔块的主要成分为Na2CrO4、NaFeO2、Na2SiO3和NaAlO2等可溶性盐,滤渣1为红褐色固体,写出步骤②NaFeO2水解的离子方程式:___________ 。
(4)结合化学用语解释步骤④调pH的目的是___________

资料:① NaFeO2遇水强烈水解。
②
 +H2O
+H2O
 +2H+。
+2H+。(1)K2Cr2O7中Cr元素的化合价是
(2)步骤①发生多个反应,补全下列化学方程式。
FeO·Cr2O3+___________Na2CO3+___________KClO3=12Na2CrO4+___________Fe2O3+___________CO2↑+___________KCl
(3)熔块的主要成分为Na2CrO4、NaFeO2、Na2SiO3和NaAlO2等可溶性盐,滤渣1为红褐色固体,写出步骤②NaFeO2水解的离子方程式:
(4)结合化学用语解释步骤④调pH的目的是
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】已知 溶液中存在平衡:
溶液中存在平衡:
 。
。 溶液为橙色,
溶液为橙色, 溶液为黄色。为探究浓度对化学平衡的影响,某兴趣小组设计了如下实验方案。
溶液为黄色。为探究浓度对化学平衡的影响,某兴趣小组设计了如下实验方案。
Ⅰ.方案讨论
(1)ⅰ~ⅳ中依据减少生成物浓度可导致平衡移动的原理设计的是___________ (填序号)。
(2)已知 为黄色沉淀。某同学认为试剂X还可设计为
为黄色沉淀。某同学认为试剂X还可设计为 溶液,加入该试剂后,平衡向着
溶液,加入该试剂后,平衡向着___________ (填“正反应”或“逆反应”)方向移动,溶液颜色将___________ (填“变深”、“变浅”或“不变”)。
Ⅱ.实验分析
(3)实验ⅰ没有观察到预期现象的原因是___________ ,实验ⅱ的原因与其相似。
(4)通过实验ⅲ和ⅳ得出的结论为___________ 。
(5)某同学认为将ⅲ中浓盐酸替换为浓硫酸也可得出相应的实验结论。用浓硫酸替换浓盐酸___________ (填“能”或“不能”)达到预期目的,理由是___________ 。
(6)某同学查阅资料发现: 溶液与浓盐酸可发生氧化还原反应,但实验i中没有观察到明显现象,小组同学设计了两个实验,验证了该反应的发生。
溶液与浓盐酸可发生氧化还原反应,但实验i中没有观察到明显现象,小组同学设计了两个实验,验证了该反应的发生。
①方案一:取5mL浓盐酸,向其中加入15滴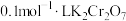 溶液,一段时间后,溶液变为绿色(
溶液,一段时间后,溶液变为绿色( 水溶液呈绿色),有黄绿色气体生成。写出发生反应的化学方程式
水溶液呈绿色),有黄绿色气体生成。写出发生反应的化学方程式___________ 。
②请你设计方案二:___________ 。
 溶液中存在平衡:
溶液中存在平衡:
 。
。 溶液为橙色,
溶液为橙色, 溶液为黄色。为探究浓度对化学平衡的影响,某兴趣小组设计了如下实验方案。
溶液为黄色。为探究浓度对化学平衡的影响,某兴趣小组设计了如下实验方案。 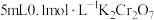 溶液 溶液 | 序号 | 试剂X |
| ⅰ | 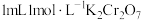 溶液 溶液 | |
| ⅱ | 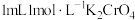 溶液 溶液 | |
| ⅲ | 5~15滴浓盐酸 | |
| ⅳ | 5~15滴 溶液 溶液 |
(1)ⅰ~ⅳ中依据减少生成物浓度可导致平衡移动的原理设计的是
(2)已知
 为黄色沉淀。某同学认为试剂X还可设计为
为黄色沉淀。某同学认为试剂X还可设计为 溶液,加入该试剂后,平衡向着
溶液,加入该试剂后,平衡向着Ⅱ.实验分析
| 序号 | 试剂X | 预期现象 | 实际现象 |
| ⅰ | 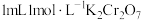 溶液 溶液 | 溶液变黄 | 溶液橙色加深 |
| ⅱ | 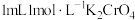 溶液 溶液 | 溶液橙色加深 | 溶液颜色变浅 |
| ⅲ | 5~15滴浓盐酸 | 溶液橙色加深 | 溶液橙色加深 |
| ⅳ | 5~15滴 溶液 溶液 | 溶液变黄 | 溶液变黄 |
(3)实验ⅰ没有观察到预期现象的原因是
(4)通过实验ⅲ和ⅳ得出的结论为
(5)某同学认为将ⅲ中浓盐酸替换为浓硫酸也可得出相应的实验结论。用浓硫酸替换浓盐酸
(6)某同学查阅资料发现:
 溶液与浓盐酸可发生氧化还原反应,但实验i中没有观察到明显现象,小组同学设计了两个实验,验证了该反应的发生。
溶液与浓盐酸可发生氧化还原反应,但实验i中没有观察到明显现象,小组同学设计了两个实验,验证了该反应的发生。①方案一:取5mL浓盐酸,向其中加入15滴
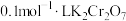 溶液,一段时间后,溶液变为绿色(
溶液,一段时间后,溶液变为绿色( 水溶液呈绿色),有黄绿色气体生成。写出发生反应的化学方程式
水溶液呈绿色),有黄绿色气体生成。写出发生反应的化学方程式②请你设计方案二:
您最近半年使用:0次



