研究人员开发新型Cu-Pd催化剂实现CO还原制备CH3COOH:2CO(g)+2H2(g) CH3COOH(g)△H。
CH3COOH(g)△H。
(1)已知:①CO(g)+ O2(g)=CO2(g)△H1
O2(g)=CO2(g)△H1
②H2(g)+ O2(g)=H2O(l)△H2
O2(g)=H2O(l)△H2
③CH3COOH(g)+2O2(g)=2CO2(g)+2H2O(l)△H3
上述反应中,△H=______ (用△H1、△H2、△H3的代数式表示)。
(2)一定温度下,在2L恒容密闭容器中充入4molCO和3molH2,发生上述反应。测得CH3COOH的物质的量(mol)与时间(min)的关系如表所示。
下列说法错误的是_____ (填标号)。
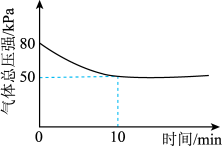
(3)在某温度下,向2L恒容密闭容器中充入2molCO和2molH2,发生上述反应,测得混合气体总压强变化如图所示。0~5min内v(H2)_____ (填“大于“小于”或“等于”)5~10min内v(H2)。该温度下,上述反应的平衡常数K=_____ (mol•L-1)-3。
(4)一定条件下CO2和H2可制得甲酸(HCOOH),又名蚁酸,是一种常见的弱酸,催化甲酸分解的一种反应机理和相对能量的变化情况如图所示。
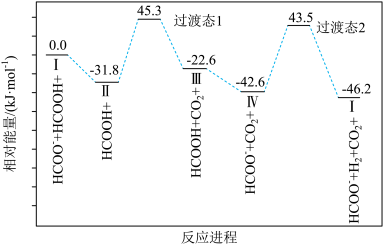
①已知催化剂“I”带一个正电荷,反应过程中的中间产物也带一个正电荷的是_____ (填“II”“III”或“IV”)。
②由反应进程可知甲酸分解的△H_____ (填“>”“=”或“<”)0,该历程中的决速步骤为_____ (填选项字母)
a.I转化为II的过程b.II转化为III的过程
c.III转化为IV的过程d.IV转化为I的过程
 CH3COOH(g)△H。
CH3COOH(g)△H。(1)已知:①CO(g)+
 O2(g)=CO2(g)△H1
O2(g)=CO2(g)△H1②H2(g)+
 O2(g)=H2O(l)△H2
O2(g)=H2O(l)△H2③CH3COOH(g)+2O2(g)=2CO2(g)+2H2O(l)△H3
上述反应中,△H=
(2)一定温度下,在2L恒容密闭容器中充入4molCO和3molH2,发生上述反应。测得CH3COOH的物质的量(mol)与时间(min)的关系如表所示。
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
| n(CH3COOH)/mol | 0.00 | 0.80 | 1.00 | 1.20 | 1.30 | 1.30 |
| A.15~20min时混合气体的密度不随时间变化 |
| B.CO消耗速率等于乙酸消耗速率的3倍时达到平衡状态 |
| C.0~10min内v(H2)=0.05mol•L-1•min-1 |
| D.上述条件下CO的平衡转化率为65% |

(4)一定条件下CO2和H2可制得甲酸(HCOOH),又名蚁酸,是一种常见的弱酸,催化甲酸分解的一种反应机理和相对能量的变化情况如图所示。

①已知催化剂“I”带一个正电荷,反应过程中的中间产物也带一个正电荷的是
②由反应进程可知甲酸分解的△H
a.I转化为II的过程b.II转化为III的过程
c.III转化为IV的过程d.IV转化为I的过程
更新时间:2023-03-19 13:25:01
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】按要求书写下列表达式。
(1)用次氯酸钠除去氨氮的原理如图所示。该图示的总反应化学方程式为_________ 。

(2)已知:
反应Ⅰ N2(g)+O2(g)=2NO(g) ΔH1=a kJ·mol-1
反应Ⅱ 2NO(g)+O2(g)=2NO2(g) ΔH2=b kJ·mol-1
反应Ⅲ 4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH3=c kJ·mol-1
写出NO2和NH3反应生成N2和液态水的热化学反应方程式_________ 。
(3)用压强传感器探究生铁在pH=2和pH=4的醋酸溶液中发生的腐蚀装置及得到的图象如图。


①溶液的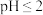 时,生铁发生电化学腐蚀的正极反应式为
时,生铁发生电化学腐蚀的正极反应式为_________ 。
②溶液的pH=4时,生铁发生_________ 腐蚀。
(4)用KOH做电解质的CO碱性燃料电池(如图)作电源,用惰性电极电解含CN-的酸性废水,将CN-彻底氧化为无害气体,以净化废水。该电池的负极反应式为_________ ;电解CN-废水的阳极反应式为_______ 。

(1)用次氯酸钠除去氨氮的原理如图所示。该图示的总反应化学方程式为

(2)已知:
反应Ⅰ N2(g)+O2(g)=2NO(g) ΔH1=a kJ·mol-1
反应Ⅱ 2NO(g)+O2(g)=2NO2(g) ΔH2=b kJ·mol-1
反应Ⅲ 4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH3=c kJ·mol-1
写出NO2和NH3反应生成N2和液态水的热化学反应方程式
(3)用压强传感器探究生铁在pH=2和pH=4的醋酸溶液中发生的腐蚀装置及得到的图象如图。


①溶液的
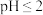 时,生铁发生电化学腐蚀的正极反应式为
时,生铁发生电化学腐蚀的正极反应式为②溶液的pH=4时,生铁发生
(4)用KOH做电解质的CO碱性燃料电池(如图)作电源,用惰性电极电解含CN-的酸性废水,将CN-彻底氧化为无害气体,以净化废水。该电池的负极反应式为

您最近一年使用:0次
【推荐2】I.据报道,我国在南海北部神狐海域进行的可燃冰(甲烷的水合物)试采获得成功。甲烷是一种重要的化工原料。
(1)甲烷重整是提高甲烷利用率的重要方式,除部分氧化外还有以下两种:
水蒸气重整:CH4(g)+H2O(g) CO(g)+3H2(g) △H1=+205.9kJ·mol-1①
CO(g)+3H2(g) △H1=+205.9kJ·mol-1①
CO(g)+H2O(g) CO2(g)+H2(g) △H2=-41.2kJ·mol-1②
CO2(g)+H2(g) △H2=-41.2kJ·mol-1②
二氧化碳重整:CH4(g)+CO2(g) 2CO(g)+2H2(g) △H3③
2CO(g)+2H2(g) △H3③
则反应①自发进行的条件是____ ,△H3=____ kJ·mol-1。
II.氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2(g)+3H2(g) 2NH3(g)。
2NH3(g)。
(2)在不同温度、压强和相同催化剂条件下,初始N2、H2分别为0.1mol、0.3mol时,平衡后混合物中氮的体积分数(φ)如图所示。
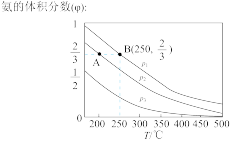
①其中,p1、p2和p3由大到小的顺序是____ ,其原因是____ 。
②若分别用VA(N2)和VB(N2)表示从反应开始至达平衡状态A、B时的化学反应速率,则VA(N2)____ VB(N2)(填“>”“<”或“=”)。
③若在250℃、p1为104Pa条件下,反应达到平衡时容器的体积为1L,则该条件下B点N2的分压p(N2)为_____ Pa(分压=总压×物质的量分效,保留一位小数)。
III.以连二硫酸根(S2O )为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
)为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
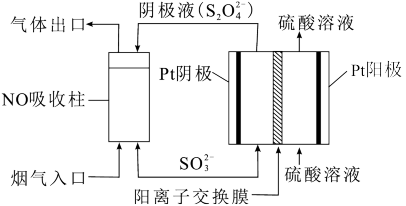
(3)①阴极区的电极反应式为____ 。
②NO吸收转化后的主要产物为NH ,若通电时电路中转移了0.3mole-,则此通电过程中理论上吸收的NO在标况下的体积为
,若通电时电路中转移了0.3mole-,则此通电过程中理论上吸收的NO在标况下的体积为____ mL。
(1)甲烷重整是提高甲烷利用率的重要方式,除部分氧化外还有以下两种:
水蒸气重整:CH4(g)+H2O(g)
 CO(g)+3H2(g) △H1=+205.9kJ·mol-1①
CO(g)+3H2(g) △H1=+205.9kJ·mol-1①CO(g)+H2O(g)
 CO2(g)+H2(g) △H2=-41.2kJ·mol-1②
CO2(g)+H2(g) △H2=-41.2kJ·mol-1②二氧化碳重整:CH4(g)+CO2(g)
 2CO(g)+2H2(g) △H3③
2CO(g)+2H2(g) △H3③则反应①自发进行的条件是
II.氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2(g)+3H2(g)
 2NH3(g)。
2NH3(g)。(2)在不同温度、压强和相同催化剂条件下,初始N2、H2分别为0.1mol、0.3mol时,平衡后混合物中氮的体积分数(φ)如图所示。

①其中,p1、p2和p3由大到小的顺序是
②若分别用VA(N2)和VB(N2)表示从反应开始至达平衡状态A、B时的化学反应速率,则VA(N2)
③若在250℃、p1为104Pa条件下,反应达到平衡时容器的体积为1L,则该条件下B点N2的分压p(N2)为
III.以连二硫酸根(S2O
 )为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
)为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
(3)①阴极区的电极反应式为
②NO吸收转化后的主要产物为NH
 ,若通电时电路中转移了0.3mole-,则此通电过程中理论上吸收的NO在标况下的体积为
,若通电时电路中转移了0.3mole-,则此通电过程中理论上吸收的NO在标况下的体积为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】CO2的资源化对于构建低碳社会具有重要意义。
(1)在太阳能的作用下,缺铁氧化物[如Fe0.9O]能分解CO2,其过程如图所示。过程①的化学方程式是_______ 。在过程②中每产生1 mol O2,转移电子____ mol。

(2)高温共电解CO2和H2O是一种制备清洁燃料的新技术,其原理如图所示。电极a上的电极反应式是H2O + 2e-= H2 + O2-和__________________ 。
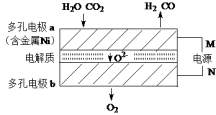
(3)利用CO2制备CH3OH的反应如下:
反应a:CO2(g)+H2(g) CO(g)+H2O(g) ΔH1 = + 41.19 kJ·mol-1
CO(g)+H2O(g) ΔH1 = + 41.19 kJ·mol-1
反应b:CO(g)+2H2(g) CH3OH(g) ΔH2 =-90.77 kJ·mol-1
CH3OH(g) ΔH2 =-90.77 kJ·mol-1
反应c:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH3
CH3OH(g)+H2O(g) ΔH3
①反应a在一定条件下能自发进行的原因是_______________ 。
②ΔH3 =________ kJ·mol-1,反应c的平衡常数表达式K=_______________ 。
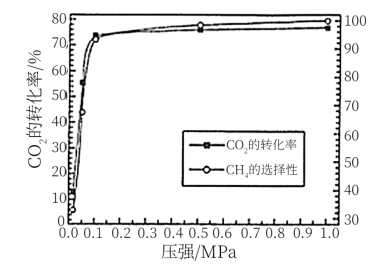
(4)CO2是廉价的碳资源,将其甲烷化具有重要意义。其原理为:CO2(g)+4H2(g) CH4(g)+2H2O(g) △H=-412.5 kJ·mol-1其他条件不变,压强对CO2的转化率及CH4的选择性的影响如图所示。CH4的选择性=
CH4(g)+2H2O(g) △H=-412.5 kJ·mol-1其他条件不变,压强对CO2的转化率及CH4的选择性的影响如图所示。CH4的选择性=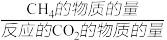 ×100%,CO2甲烷化反应选择0.1MPa (1个大气压)而不选择更高压强的原因是
×100%,CO2甲烷化反应选择0.1MPa (1个大气压)而不选择更高压强的原因是_______________ 。
(1)在太阳能的作用下,缺铁氧化物[如Fe0.9O]能分解CO2,其过程如图所示。过程①的化学方程式是

(2)高温共电解CO2和H2O是一种制备清洁燃料的新技术,其原理如图所示。电极a上的电极反应式是H2O + 2e-= H2 + O2-和
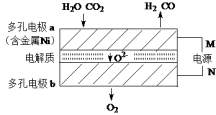
(3)利用CO2制备CH3OH的反应如下:
反应a:CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH1 = + 41.19 kJ·mol-1
CO(g)+H2O(g) ΔH1 = + 41.19 kJ·mol-1反应b:CO(g)+2H2(g)
 CH3OH(g) ΔH2 =-90.77 kJ·mol-1
CH3OH(g) ΔH2 =-90.77 kJ·mol-1反应c:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH3
CH3OH(g)+H2O(g) ΔH3①反应a在一定条件下能自发进行的原因是
②ΔH3 =
(4)CO2是廉价的碳资源,将其甲烷化具有重要意义。其原理为:CO2(g)+4H2(g)
 CH4(g)+2H2O(g) △H=-412.5 kJ·mol-1其他条件不变,压强对CO2的转化率及CH4的选择性的影响如图所示。CH4的选择性=
CH4(g)+2H2O(g) △H=-412.5 kJ·mol-1其他条件不变,压强对CO2的转化率及CH4的选择性的影响如图所示。CH4的选择性=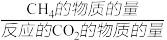 ×100%,CO2甲烷化反应选择0.1MPa (1个大气压)而不选择更高压强的原因是
×100%,CO2甲烷化反应选择0.1MPa (1个大气压)而不选择更高压强的原因是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】设计实验测定锌与硫酸反应的速率,按下列实验步骤完成实验:

①按图示安装置,加入锌粒,然后快速加入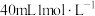 的硫酸溶液,测量收集
的硫酸溶液,测量收集 所用的时间。
所用的时间。
②按图示再安转一套装置,加入与前一套装置相同的锌粒,然后再快速加入 的硫酸溶液,测量收集
的硫酸溶液,测量收集 所用的时间。回答下列问题:
所用的时间。回答下列问题:
(1)实验所用仪器有:锥形瓶、双孔塞、分液漏斗、直角导气管、 注射器、铁架台、
注射器、铁架台、_____ 。
(2)收集 气体②所用时间比①所用时间
气体②所用时间比①所用时间_____ 。
(3)所能得出的实验结论是_____ 。
(4)利用硫代硫酸钠与上述稀硫酸反应也可判断反应速率的快慢,请书写这个反应的离子方程式_____ 。
(5)某温度下按上图装置进行实验,锥形瓶内盛有 锌粒(颗粒大小基本相同),通过分液漏斗加入
锌粒(颗粒大小基本相同),通过分液漏斗加入 的硫酸溶液,将产生的
的硫酸溶液,将产生的 收集在一个注射器中,用时
收集在一个注射器中,用时 时恰好收集到气体的体积为
时恰好收集到气体的体积为 (若折合成
(若折合成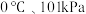 条件下的
条件下的 体积为
体积为 )。在该温度下,下列说法正确的是_____。
)。在该温度下,下列说法正确的是_____。
(6)水煤气变换 是重要的化工过程。我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用*标注。
是重要的化工过程。我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用*标注。

可知水煤气变换的
_____ 0(填“大于”“等于”或“小于”)。该历程中最大能垒(活化能)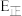 =
=_____  ,写出该步骤的化学方程式
,写出该步骤的化学方程式_____ 。

①按图示安装置,加入锌粒,然后快速加入
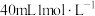 的硫酸溶液,测量收集
的硫酸溶液,测量收集 所用的时间。
所用的时间。②按图示再安转一套装置,加入与前一套装置相同的锌粒,然后再快速加入
 的硫酸溶液,测量收集
的硫酸溶液,测量收集 所用的时间。回答下列问题:
所用的时间。回答下列问题:(1)实验所用仪器有:锥形瓶、双孔塞、分液漏斗、直角导气管、
 注射器、铁架台、
注射器、铁架台、(2)收集
 气体②所用时间比①所用时间
气体②所用时间比①所用时间(3)所能得出的实验结论是
(4)利用硫代硫酸钠与上述稀硫酸反应也可判断反应速率的快慢,请书写这个反应的离子方程式
(5)某温度下按上图装置进行实验,锥形瓶内盛有
 锌粒(颗粒大小基本相同),通过分液漏斗加入
锌粒(颗粒大小基本相同),通过分液漏斗加入 的硫酸溶液,将产生的
的硫酸溶液,将产生的 收集在一个注射器中,用时
收集在一个注射器中,用时 时恰好收集到气体的体积为
时恰好收集到气体的体积为 (若折合成
(若折合成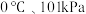 条件下的
条件下的 体积为
体积为 )。在该温度下,下列说法正确的是_____。
)。在该温度下,下列说法正确的是_____。A.用锌粒表示的 内该反应的速率为 内该反应的速率为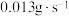 |
B.忽略锥形瓶内溶液体积的变化,用 表示的 表示的 内该反应的速率为 内该反应的速率为 |
C.忽略锥形瓶内溶液体积的变化,用 表示的 表示的 内该反应的速率为 内该反应的速率为 |
D.用 表示的 表示的 内该反应的速率为 内该反应的速率为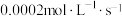 |
(6)水煤气变换
 是重要的化工过程。我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用*标注。
是重要的化工过程。我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用*标注。
可知水煤气变换的

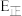 =
= ,写出该步骤的化学方程式
,写出该步骤的化学方程式
您最近一年使用:0次
【推荐2】氨是重要的无机化工产品,工业合成涉及到的主反应是N2(g)+3H2(g)⇌2NH3(g)。回答下列问题:
(1)已知1molN2中的共价键断裂吸收Q1kJ能量;1molH2中的共价键断裂吸收Q2kJ能量;形成1molN-H释放Q3kJ能量。
①N2(g)+3H2(g)⇌2NH3(g) △H=_______ kJ·mol-1。
②Fe3O4为该反应的催化剂,使用时常加入Al2O3与之生成合金FeO·Al2O3使Fe3O4分布均匀,其目的是_______ 。
(2)用平衡分压p(NH3)、p(N2)、p(H2)代替平衡浓度表示化学平衡常数。温度不变,将平衡时体系的总压强p1增加到原来的两倍,则此时Qp=_______ (用含Kp的代数式表示)。
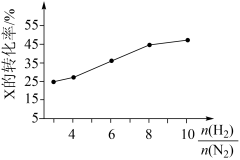
(3)T℃时,在有催化剂的恒容密闭容器只中充入N2和H2。如图所示为不同投料比[ ]时某反应物X的的平衡转化率的变化曲线。反应物X是
]时某反应物X的的平衡转化率的变化曲线。反应物X是_______ (填“N2”或“H2”),判断依据是______________ 。
(4)工业上可通过反应CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1制备原料气氢气。
①制备过程中一般采用较高的压强(3.0MPa),原因是_______ ;原料气在进入氨合成塔前需除去CO,原因是_______ 。
②在镍催化剂表面存在如下反应机理(*表示镍表面活性中心,上标*表示组分被活性中心吸附):
I.CH4+2*=CH3*+H*(慢)H2O+*=H2+O*
II.CH3*+*=CH2*+H*
III.CH2*+*=CH*+H*
IV.CH*+O*=CO*+H*
V.CO*=CO+*
甲烷在镍催化表面发生的五个基元反应中,活化能最大的是_______ (填标号)。若反应CH4(g)+H2O(g)=CO(g)+3H2(g)在任意温度下能自发进行,则ΔH1_______ 0(填“大于”或“小于”)。
(1)已知1molN2中的共价键断裂吸收Q1kJ能量;1molH2中的共价键断裂吸收Q2kJ能量;形成1molN-H释放Q3kJ能量。
①N2(g)+3H2(g)⇌2NH3(g) △H=
②Fe3O4为该反应的催化剂,使用时常加入Al2O3与之生成合金FeO·Al2O3使Fe3O4分布均匀,其目的是
(2)用平衡分压p(NH3)、p(N2)、p(H2)代替平衡浓度表示化学平衡常数。温度不变,将平衡时体系的总压强p1增加到原来的两倍,则此时Qp=
(3)T℃时,在有催化剂的恒容密闭容器只中充入N2和H2。如图所示为不同投料比[
 ]时某反应物X的的平衡转化率的变化曲线。反应物X是
]时某反应物X的的平衡转化率的变化曲线。反应物X是
(4)工业上可通过反应CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1制备原料气氢气。
①制备过程中一般采用较高的压强(3.0MPa),原因是
②在镍催化剂表面存在如下反应机理(*表示镍表面活性中心,上标*表示组分被活性中心吸附):
I.CH4+2*=CH3*+H*(慢)H2O+*=H2+O*
II.CH3*+*=CH2*+H*
III.CH2*+*=CH*+H*
IV.CH*+O*=CO*+H*
V.CO*=CO+*
甲烷在镍催化表面发生的五个基元反应中,活化能最大的是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】上饶市正在创建“全国文明城市”,对碳的化合物做广泛深入的研究并妥善处理具有重要意义。
I.CO2与H2合成甲醇:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。最近采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示:

(1)容易得到的副产物有CO和CH2O,其中相对较少的副产物为______ ;上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中______ (填字母)的能量变化。
A.•OCH3 •CH3OH B.•CO
•CH3OH B.•CO •OCH
•OCH
C. •OCH2 •OCH3 D.•CO + •OH
•OCH3 D.•CO + •OH •CO + •H2O
•CO + •H2O
II.天然气一个重要的用途是制取H2,其原理为CO2(g)+ CH4(g)⇌2CO(g)+2H2(g)。
(2)在密闭容器中通入物质的量均为 0.1 mol 的CH4和CO2,在一定条件下发生反应,CH4的平衡转化率与温度及压强(单位Pa)的关系如图所示。

y点:v(CO)正______ v(H2)逆(填“大于”“小于”或“等于”)。已知气体分压(p分)=气体总压(p总)×气体的物质的量分数。若平衡时气体的总压强为3×106Pa,求x点对应温度下反应的平衡常数Kp=______ Pa2。
(3)天然气中少量的杂质通常用氨水吸收,产物为硫氢化铵。一定条件下向硫氢化铵溶液中通入空气,得到单质硫并使吸收液再生。写出再生反应的化学方程式:______ 。
III.利用铜基配合1,10-phenanthroline-Cu催化剂电催化CO2还原制备碳基燃料(包括CO、烷烃和酸等)是减少CO2在大气中累积和实现可再生能源有效利用的关键手段,其装置原理如图所示。

(4)电池工作过程中,阴极的电极反应式为______ 。
(5)每转移0.2mol电子,阳极室溶液质量减少______ g。
I.CO2与H2合成甲醇:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。最近采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示:

(1)容易得到的副产物有CO和CH2O,其中相对较少的副产物为
A.•OCH3
 •CH3OH B.•CO
•CH3OH B.•CO •OCH
•OCHC. •OCH2
 •OCH3 D.•CO + •OH
•OCH3 D.•CO + •OH •CO + •H2O
•CO + •H2OII.天然气一个重要的用途是制取H2,其原理为CO2(g)+ CH4(g)⇌2CO(g)+2H2(g)。
(2)在密闭容器中通入物质的量均为 0.1 mol 的CH4和CO2,在一定条件下发生反应,CH4的平衡转化率与温度及压强(单位Pa)的关系如图所示。

y点:v(CO)正
(3)天然气中少量的杂质通常用氨水吸收,产物为硫氢化铵。一定条件下向硫氢化铵溶液中通入空气,得到单质硫并使吸收液再生。写出再生反应的化学方程式:
III.利用铜基配合1,10-phenanthroline-Cu催化剂电催化CO2还原制备碳基燃料(包括CO、烷烃和酸等)是减少CO2在大气中累积和实现可再生能源有效利用的关键手段,其装置原理如图所示。

(4)电池工作过程中,阴极的电极反应式为
(5)每转移0.2mol电子,阳极室溶液质量减少
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】工业上可用甲烷消除氮氧化物的污染。
(1)已知CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) ΔH=akJ·mol-1在温度T1和T2时,分别将0.50molCH4和xmolNO2充入体积为1L的密闭容器中,测得n(CH4)随时间变化数据如表,一定条件下反应时间t与α(NO2)的转化关系如图1:
N2(g)+CO2(g)+2H2O(g) ΔH=akJ·mol-1在温度T1和T2时,分别将0.50molCH4和xmolNO2充入体积为1L的密闭容器中,测得n(CH4)随时间变化数据如表,一定条件下反应时间t与α(NO2)的转化关系如图1:
保证反应体系状态的前提下,该反应___ 条件(填“高温”或“低温”或“任意温度”)下可以自发,请说明理由:____ 。
①请在时间t与α(NO2)的转化关系图中画出T2、P2(假设P2>P1)条件下的变化曲线。____
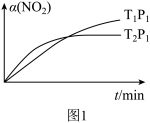
②已知:CH4(g)+4NO2(g) 4NO(g)+2H2O(g) ΔH=bkJ·mol-1
4NO(g)+2H2O(g) ΔH=bkJ·mol-1
CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) ΔH=akJ·mol-1
N2(g)+CO2(g)+2H2O(g) ΔH=akJ·mol-1
③试写出甲烷消除NO污染的热化学方程式(ΔH用字母a,b表示)___ 。
④试说明表中T2温度时,40min反应是否到达平衡并阐述理由___ 。
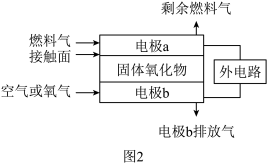
(2)固体氧化物燃料电池(SOFC)以固体氧化物作为电解质,O2-可以在其内部自由通过。其工作原理如图2所示。现以甲烷为燃料气,写出电极a的电极反应方程式:___ 。
(1)已知CH4(g)+2NO2(g)
 N2(g)+CO2(g)+2H2O(g) ΔH=akJ·mol-1在温度T1和T2时,分别将0.50molCH4和xmolNO2充入体积为1L的密闭容器中,测得n(CH4)随时间变化数据如表,一定条件下反应时间t与α(NO2)的转化关系如图1:
N2(g)+CO2(g)+2H2O(g) ΔH=akJ·mol-1在温度T1和T2时,分别将0.50molCH4和xmolNO2充入体积为1L的密闭容器中,测得n(CH4)随时间变化数据如表,一定条件下反应时间t与α(NO2)的转化关系如图1:| 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
| T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4) | 0.50 | 0.30 | 0.18 | …… | 0.15 |
①请在时间t与α(NO2)的转化关系图中画出T2、P2(假设P2>P1)条件下的变化曲线。

②已知:CH4(g)+4NO2(g)
 4NO(g)+2H2O(g) ΔH=bkJ·mol-1
4NO(g)+2H2O(g) ΔH=bkJ·mol-1CH4(g)+2NO2(g)
 N2(g)+CO2(g)+2H2O(g) ΔH=akJ·mol-1
N2(g)+CO2(g)+2H2O(g) ΔH=akJ·mol-1③试写出甲烷消除NO污染的热化学方程式(ΔH用字母a,b表示)
④试说明表中T2温度时,40min反应是否到达平衡并阐述理由
(2)固体氧化物燃料电池(SOFC)以固体氧化物作为电解质,O2-可以在其内部自由通过。其工作原理如图2所示。现以甲烷为燃料气,写出电极a的电极反应方程式:

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】甲烷在化学工业中应用广泛。回答下列问题:
(1) 捕集
捕集 合成
合成 涉及下列反应:
涉及下列反应:
Ⅰ.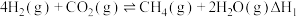 平衡常数
平衡常数
Ⅱ.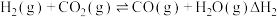 平衡常数
平衡常数
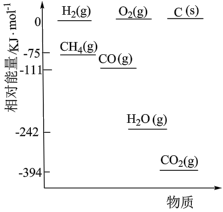
①相关物质相对能量大小如图所示,则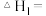
______ 
②起始物 时,反应在不同条件下达到平衡。240℃甲烷的物质的量分数
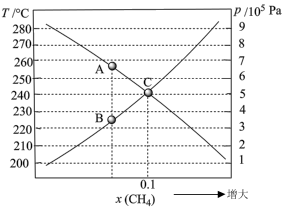
时,反应在不同条件下达到平衡。240℃甲烷的物质的量分数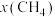 与压强p的变化关系、
与压强p的变化关系、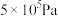 时
时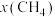 与温度T的变化关系如图所示。图中对应A、B两点的速率:
与温度T的变化关系如图所示。图中对应A、B两点的速率: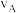 (正)
(正)______  (逆)(填“大于”、“小于”或“等于”);若C点
(逆)(填“大于”、“小于”或“等于”);若C点 与
与 的分压相同,则
的分压相同,则
______ Pa反应Ⅰ以物质的量分数表示的平衡常数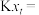
______ 。
(2) 还原
还原 是实现“双碳”经济的有效途径之一、恒压、750℃时,
是实现“双碳”经济的有效途径之一、恒压、750℃时, 和
和 反应经如下流程(主要产物已标出)可实现
反应经如下流程(主要产物已标出)可实现 高效转化。
高效转化。

其中过程Ⅱ主要发生如下反应:
i.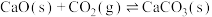
ii.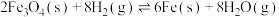
iii.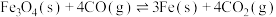
过程Ⅱ平衡后通入He,反应iii的化学平衡将______ (填“正向移动”“逆向移动”或“不移动”),重新平衡时,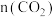
______ (填“增大”、“减小”或“不变”),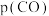
______ (填“增大”、“减小”或“不变”)。
(1)
 捕集
捕集 合成
合成 涉及下列反应:
涉及下列反应:Ⅰ.
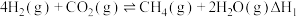 平衡常数
平衡常数
Ⅱ.
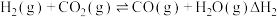 平衡常数
平衡常数
①相关物质相对能量大小如图所示,则
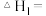


②起始物
 时,反应在不同条件下达到平衡。240℃甲烷的物质的量分数
时,反应在不同条件下达到平衡。240℃甲烷的物质的量分数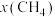 与压强p的变化关系、
与压强p的变化关系、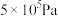 时
时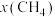 与温度T的变化关系如图所示。图中对应A、B两点的速率:
与温度T的变化关系如图所示。图中对应A、B两点的速率: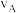 (正)
(正) (逆)(填“大于”、“小于”或“等于”);若C点
(逆)(填“大于”、“小于”或“等于”);若C点 与
与 的分压相同,则
的分压相同,则
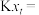

(2)
 还原
还原 是实现“双碳”经济的有效途径之一、恒压、750℃时,
是实现“双碳”经济的有效途径之一、恒压、750℃时, 和
和 反应经如下流程(主要产物已标出)可实现
反应经如下流程(主要产物已标出)可实现 高效转化。
高效转化。
其中过程Ⅱ主要发生如下反应:
i.
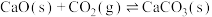
ii.
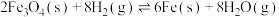
iii.
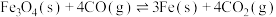
过程Ⅱ平衡后通入He,反应iii的化学平衡将
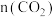
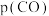
您最近一年使用:0次
【推荐3】汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NOx等有毒气体,其污染问题也成为当今社会急需解决的问题。
(1)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图:

则该反应的热化学方程式为_____________________________ 。
(2)对汽车加装尾气净化装置,可使CO、NOx有毒气体相互反应转化为无毒气体。
2xCO+2NOx ="=" 2xCO2+N2,当转移电子物质的量为0.4x mol时,该反应生成标准状况下的N2体积_____________________ L。
(3)一氧化碳是一种用途相当广泛的化工基础原料。可以还原金属氧化物,还可以用来合成很多有机物如甲醇等。在压强为0.1 MPa条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下反应生成甲醇: CO(g)+2H2(g) CH3OH(g);△H= -b kJ•mol-1
CH3OH(g);△H= -b kJ•mol-1
①该反应的平衡常数表达式为_____________________________ 。
②若容器容积不变,下列措施可增加甲醇产率的是______________
③经测定不同温度下该反应的平衡常数如下:
若某时刻、250℃测得该反应的反应物与生成物的浓度为c(CO) =0.4 mol/L、c(H2)=0.4 mol/L、c(CH3OH)=0.8 mol·L-1, 则此时v正___________ v逆(填>、<或=)。
(4)甲醇是重要的基础化工原料,又是一种新型的燃料,最近有人制造了一种燃料电池,一个电极通入空气,另一个电极加入甲醇,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子。该电池的正极反应式为_____________________________ 。电池工作时,固体电解质里的O2-向_______ 极移动。
(1)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图:

则该反应的热化学方程式为
(2)对汽车加装尾气净化装置,可使CO、NOx有毒气体相互反应转化为无毒气体。
2xCO+2NOx ="=" 2xCO2+N2,当转移电子物质的量为0.4x mol时,该反应生成标准状况下的N2体积
(3)一氧化碳是一种用途相当广泛的化工基础原料。可以还原金属氧化物,还可以用来合成很多有机物如甲醇等。在压强为0.1 MPa条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下反应生成甲醇: CO(g)+2H2(g)
 CH3OH(g);△H= -b kJ•mol-1
CH3OH(g);△H= -b kJ•mol-1①该反应的平衡常数表达式为
②若容器容积不变,下列措施可增加甲醇产率的是
| A.升高温度 | B.将CH3OH(g)从体系中分离 |
| C.充入He,使体系总压强增大 | D.再充入1 mol CO和3 mol H2 |
③经测定不同温度下该反应的平衡常数如下:
| 温度(℃) | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
若某时刻、250℃测得该反应的反应物与生成物的浓度为c(CO) =0.4 mol/L、c(H2)=0.4 mol/L、c(CH3OH)=0.8 mol·L-1, 则此时v正
(4)甲醇是重要的基础化工原料,又是一种新型的燃料,最近有人制造了一种燃料电池,一个电极通入空气,另一个电极加入甲醇,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子。该电池的正极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】我国科学家开发新催化剂,高选择性实现丙烷脱氢制备丙烯。
反应原理:
Ⅰ.
 ;
;
Ⅱ.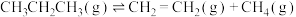
 。
。
(1)几种共价键的键能数据如下:
反应Ⅰ在__________ (填“高温”“低温”或“任意温度”)条件下自发进行,
__________  。
。
(2)一定温度下,在恒容密闭容器中充入 ,发生上述反应Ⅰ和反应Ⅱ。下列叙述正确的是__________(填字母)。
,发生上述反应Ⅰ和反应Ⅱ。下列叙述正确的是__________(填字母)。
(3)在恒压密闭反应器中充入一定量的丙烷和不同量的Ar,发生上述反应Ⅰ和反应Ⅱ,丙烷平衡转化率与温度、投料比[ ]关系如图所示。
]关系如图所示。__________ n(填“>”“<”或“=”)。
②相同温度时,随着投料比( )增大,丙烷平衡转化率增大的原因是
)增大,丙烷平衡转化率增大的原因是__________ 。
(4)在1L恒容密闭容器中充入 和适量催化剂M发生反应Ⅰ和反应Ⅱ,测得相同时间内丙烷的转化率、丙烯的选择性与温度关系如图所示。
和适量催化剂M发生反应Ⅰ和反应Ⅱ,测得相同时间内丙烷的转化率、丙烯的选择性与温度关系如图所示。
__________ 。(已知:丙烯的选择性 )
)
(5)以熔融 为电解质,丙烷-空气燃料电池的装置如图所示。该电池放电时,负极反应式为
为电解质,丙烷-空气燃料电池的装置如图所示。该电池放电时,负极反应式为__________ 。为了使电池长时间稳定运行且确保电解质组成不变,则还应在通入的空气中添加的物质是__________ (填化学式)。
反应原理:
Ⅰ.

 ;
;Ⅱ.
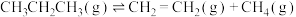
 。
。(1)几种共价键的键能数据如下:
共价键 | H-C | H-H | C-C | C=C |
键能 | 413 | 436 | 347 | 614 |

 。
。(2)一定温度下,在恒容密闭容器中充入
 ,发生上述反应Ⅰ和反应Ⅱ。下列叙述正确的是__________(填字母)。
,发生上述反应Ⅰ和反应Ⅱ。下列叙述正确的是__________(填字母)。| A.混合气体平均摩尔质量不变时达到平衡状态 |
B.达到平衡时 体积分数最大为50% 体积分数最大为50% |
| C.平衡后,再充入少量的丙烷,丙烷的平衡转化率减小 |
| D.升高温度,反应Ⅰ和Ⅱ的平衡常数都减小 |
(3)在恒压密闭反应器中充入一定量的丙烷和不同量的Ar,发生上述反应Ⅰ和反应Ⅱ,丙烷平衡转化率与温度、投料比[
 ]关系如图所示。
]关系如图所示。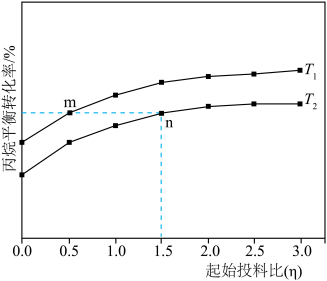
②相同温度时,随着投料比(
 )增大,丙烷平衡转化率增大的原因是
)增大,丙烷平衡转化率增大的原因是(4)在1L恒容密闭容器中充入
 和适量催化剂M发生反应Ⅰ和反应Ⅱ,测得相同时间内丙烷的转化率、丙烯的选择性与温度关系如图所示。
和适量催化剂M发生反应Ⅰ和反应Ⅱ,测得相同时间内丙烷的转化率、丙烯的选择性与温度关系如图所示。

 )
)(5)以熔融
 为电解质,丙烷-空气燃料电池的装置如图所示。该电池放电时,负极反应式为
为电解质,丙烷-空气燃料电池的装置如图所示。该电池放电时,负极反应式为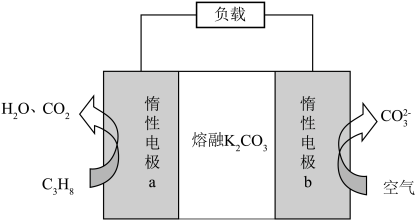
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】乙烯工业是石油化工的核心,能合成很多的有机物,请回答下列问题:
(1)在实验室中,常以乙醇为原料,在加热和浓硫酸催化下脱水生成乙烯。
已知:①CH3CH2OH(l) CH3CH2OH(g) ΔH1=+41.50 kJ·mol−1
CH3CH2OH(g) ΔH1=+41.50 kJ·mol−1
②H2O(l) H2O(g) ΔH2=+44 kJ·mol−1
H2O(g) ΔH2=+44 kJ·mol−1
③在标准大气压和25 ℃下,把1 mol气态的AB分子分离成气态的A和B原子要吸收的能量(kJ/mol),叫做键能,相关化学键的键能如下:
则实验室制备乙烯的热化学反应方程式为_______________ 。
(2)利用CO2合成乙烯已成为研究的热点,反应原理为:2CO2(g) + 6H2(g) C2H4(g) + 4H2O(g) ΔH。在两个体积均为1 L的密闭容器中以投料比n(H2)/n(CO2)分别为2∶1和3∶1进行投料,保证初始压强相同,进行上述反应,CO2的平衡转化率随温度变化关系如图1所示:
C2H4(g) + 4H2O(g) ΔH。在两个体积均为1 L的密闭容器中以投料比n(H2)/n(CO2)分别为2∶1和3∶1进行投料,保证初始压强相同,进行上述反应,CO2的平衡转化率随温度变化关系如图1所示:

①该反应的ΔH______ 0(填“>”“<”或“=”)。
②曲线X对应的投料比为______ ,判断理由是________________________ 。
③已知R点的投料与P相同,则R、P两点对应的正反应速率:υ(R)______ υ(P)(填“>”“<”或“=”)。
(3)一定温度下,在1 L恒容密闭容器中充入一定量C2H4(g)和H2O(g),发生如下反应:C2H4(g)+ H2O(g) CH3CH2OH(g) ΔH,测得C2H4(g)的转化率(α)与时间(t)的关系如图2所示。其中T1、T2表示温度,速率方程:υ正=k正·c(C2H4)·c(H2O),υ逆=k逆·c(CH3CH2OH)(k是速率常数,只与温度有关)。
CH3CH2OH(g) ΔH,测得C2H4(g)的转化率(α)与时间(t)的关系如图2所示。其中T1、T2表示温度,速率方程:υ正=k正·c(C2H4)·c(H2O),υ逆=k逆·c(CH3CH2OH)(k是速率常数,只与温度有关)。
①N点:k正/k逆___ c(CH3CH2OH)/c(C2H4)∙c(H2O)(填“>”“<”或“=”),升高温度,k正增大的倍数______ k逆增大的倍数(填“>”“<”或“=”)。
②温度为T1时,测定平衡体系中c(H2O)=0.25 mol·L−1,则:k正/k逆=_______ L·mol−1。
(1)在实验室中,常以乙醇为原料,在加热和浓硫酸催化下脱水生成乙烯。
已知:①CH3CH2OH(l)
 CH3CH2OH(g) ΔH1=+41.50 kJ·mol−1
CH3CH2OH(g) ΔH1=+41.50 kJ·mol−1②H2O(l)
 H2O(g) ΔH2=+44 kJ·mol−1
H2O(g) ΔH2=+44 kJ·mol−1③在标准大气压和25 ℃下,把1 mol气态的AB分子分离成气态的A和B原子要吸收的能量(kJ/mol),叫做键能,相关化学键的键能如下:
| 化学键 | C−H | C−C | O−H | C=C | C−O |
| 键能E/kJ·mol−1 | 415 | 332 | 462.8 | 611 | 433 |
则实验室制备乙烯的热化学反应方程式为
(2)利用CO2合成乙烯已成为研究的热点,反应原理为:2CO2(g) + 6H2(g)
 C2H4(g) + 4H2O(g) ΔH。在两个体积均为1 L的密闭容器中以投料比n(H2)/n(CO2)分别为2∶1和3∶1进行投料,保证初始压强相同,进行上述反应,CO2的平衡转化率随温度变化关系如图1所示:
C2H4(g) + 4H2O(g) ΔH。在两个体积均为1 L的密闭容器中以投料比n(H2)/n(CO2)分别为2∶1和3∶1进行投料,保证初始压强相同,进行上述反应,CO2的平衡转化率随温度变化关系如图1所示:
①该反应的ΔH
②曲线X对应的投料比为
③已知R点的投料与P相同,则R、P两点对应的正反应速率:υ(R)
(3)一定温度下,在1 L恒容密闭容器中充入一定量C2H4(g)和H2O(g),发生如下反应:C2H4(g)+ H2O(g)
 CH3CH2OH(g) ΔH,测得C2H4(g)的转化率(α)与时间(t)的关系如图2所示。其中T1、T2表示温度,速率方程:υ正=k正·c(C2H4)·c(H2O),υ逆=k逆·c(CH3CH2OH)(k是速率常数,只与温度有关)。
CH3CH2OH(g) ΔH,测得C2H4(g)的转化率(α)与时间(t)的关系如图2所示。其中T1、T2表示温度,速率方程:υ正=k正·c(C2H4)·c(H2O),υ逆=k逆·c(CH3CH2OH)(k是速率常数,只与温度有关)。①N点:k正/k逆
②温度为T1时,测定平衡体系中c(H2O)=0.25 mol·L−1,则:k正/k逆=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】对以 为主要成分的雾霾进行综合治理是当前重要的研究课题.
为主要成分的雾霾进行综合治理是当前重要的研究课题.
(1)已知:


则
___________ (用含a、b、c的代数式表示) .
.
(2)NO和CO均为汽车尾气的成分,在催化转换器中二者可发生反应减少尾气污染.
已知: .
.
①已知该反应为自发反应,则该反应的反应热
__________ 0(填“>”、“<”或“=”).
②在500℃时,向恒容密闭体系中通入1mol的NO和1mol的CO进行反应时,下列描述能说明反应达到平衡状态的是__________ .
A.体系中NO、CO的浓度相等
B.单位时间内消耗nmol的NO同时消耗 的
的
C.
D.体系中混合气体密度不变
E.混合气体的平均相对分子质量不变
③向1L密闭容器中通入 和
和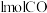 气体,在不同温度下反应达到平衡时,NO的平衡转化率随压强变化曲线如图所示:
气体,在不同温度下反应达到平衡时,NO的平衡转化率随压强变化曲线如图所示:


_________  (填“>”或“<”),反应经过5min达到平衡M,该反应的化学平衡常数表达式为
(填“>”或“<”),反应经过5min达到平衡M,该反应的化学平衡常数表达式为
_________ ,平衡时混合气体中CO的体积分数为__________ (结果保留两位小数).
(3)某研究小组探究催化剂Ⅰ、Ⅱ对CO、NO转化的影响.将CO和NO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中 的含量,从而确定尾气脱氮率(即NO的转化率),结果如图所示:
的含量,从而确定尾气脱氮率(即NO的转化率),结果如图所示:

①由图可知:要达到最大脱氮率,该反应应采取的最佳实验条件为___________ 。
②温度低于200℃时,图中曲线Ⅰ脱氮率随温度升高变化不大的主要原因是______________ 。
 为主要成分的雾霾进行综合治理是当前重要的研究课题.
为主要成分的雾霾进行综合治理是当前重要的研究课题.(1)已知:



则

 .
.(2)NO和CO均为汽车尾气的成分,在催化转换器中二者可发生反应减少尾气污染.
已知:
 .
.①已知该反应为自发反应,则该反应的反应热

②在500℃时,向恒容密闭体系中通入1mol的NO和1mol的CO进行反应时,下列描述能说明反应达到平衡状态的是
A.体系中NO、CO的浓度相等
B.单位时间内消耗nmol的NO同时消耗
 的
的
C.

D.体系中混合气体密度不变
E.混合气体的平均相对分子质量不变
③向1L密闭容器中通入
 和
和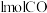 气体,在不同温度下反应达到平衡时,NO的平衡转化率随压强变化曲线如图所示:
气体,在不同温度下反应达到平衡时,NO的平衡转化率随压强变化曲线如图所示:

 (填“>”或“<”),反应经过5min达到平衡M,该反应的化学平衡常数表达式为
(填“>”或“<”),反应经过5min达到平衡M,该反应的化学平衡常数表达式为
(3)某研究小组探究催化剂Ⅰ、Ⅱ对CO、NO转化的影响.将CO和NO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中
 的含量,从而确定尾气脱氮率(即NO的转化率),结果如图所示:
的含量,从而确定尾气脱氮率(即NO的转化率),结果如图所示:
①由图可知:要达到最大脱氮率,该反应应采取的最佳实验条件为
②温度低于200℃时,图中曲线Ⅰ脱氮率随温度升高变化不大的主要原因是
您最近一年使用:0次




