我国科学家开发新催化剂,高选择性实现丙烷脱氢制备丙烯。
反应原理:
Ⅰ.
 ;
;
Ⅱ.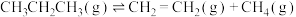
 。
。
(1)几种共价键的键能数据如下:
反应Ⅰ在__________ (填“高温”“低温”或“任意温度”)条件下自发进行,
__________  。
。
(2)一定温度下,在恒容密闭容器中充入 ,发生上述反应Ⅰ和反应Ⅱ。下列叙述正确的是__________(填字母)。
,发生上述反应Ⅰ和反应Ⅱ。下列叙述正确的是__________(填字母)。
(3)在恒压密闭反应器中充入一定量的丙烷和不同量的Ar,发生上述反应Ⅰ和反应Ⅱ,丙烷平衡转化率与温度、投料比[ ]关系如图所示。
]关系如图所示。__________ n(填“>”“<”或“=”)。
②相同温度时,随着投料比( )增大,丙烷平衡转化率增大的原因是
)增大,丙烷平衡转化率增大的原因是__________ 。
(4)在1L恒容密闭容器中充入 和适量催化剂M发生反应Ⅰ和反应Ⅱ,测得相同时间内丙烷的转化率、丙烯的选择性与温度关系如图所示。
和适量催化剂M发生反应Ⅰ和反应Ⅱ,测得相同时间内丙烷的转化率、丙烯的选择性与温度关系如图所示。
__________ 。(已知:丙烯的选择性 )
)
(5)以熔融 为电解质,丙烷-空气燃料电池的装置如图所示。该电池放电时,负极反应式为
为电解质,丙烷-空气燃料电池的装置如图所示。该电池放电时,负极反应式为__________ 。为了使电池长时间稳定运行且确保电解质组成不变,则还应在通入的空气中添加的物质是__________ (填化学式)。
反应原理:
Ⅰ.

 ;
;Ⅱ.
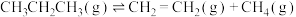
 。
。(1)几种共价键的键能数据如下:
共价键 | H-C | H-H | C-C | C=C |
键能 | 413 | 436 | 347 | 614 |

 。
。(2)一定温度下,在恒容密闭容器中充入
 ,发生上述反应Ⅰ和反应Ⅱ。下列叙述正确的是__________(填字母)。
,发生上述反应Ⅰ和反应Ⅱ。下列叙述正确的是__________(填字母)。| A.混合气体平均摩尔质量不变时达到平衡状态 |
B.达到平衡时 体积分数最大为50% 体积分数最大为50% |
| C.平衡后,再充入少量的丙烷,丙烷的平衡转化率减小 |
| D.升高温度,反应Ⅰ和Ⅱ的平衡常数都减小 |
(3)在恒压密闭反应器中充入一定量的丙烷和不同量的Ar,发生上述反应Ⅰ和反应Ⅱ,丙烷平衡转化率与温度、投料比[
 ]关系如图所示。
]关系如图所示。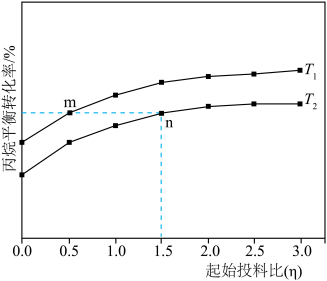
②相同温度时,随着投料比(
 )增大,丙烷平衡转化率增大的原因是
)增大,丙烷平衡转化率增大的原因是(4)在1L恒容密闭容器中充入
 和适量催化剂M发生反应Ⅰ和反应Ⅱ,测得相同时间内丙烷的转化率、丙烯的选择性与温度关系如图所示。
和适量催化剂M发生反应Ⅰ和反应Ⅱ,测得相同时间内丙烷的转化率、丙烯的选择性与温度关系如图所示。

 )
)(5)以熔融
 为电解质,丙烷-空气燃料电池的装置如图所示。该电池放电时,负极反应式为
为电解质,丙烷-空气燃料电池的装置如图所示。该电池放电时,负极反应式为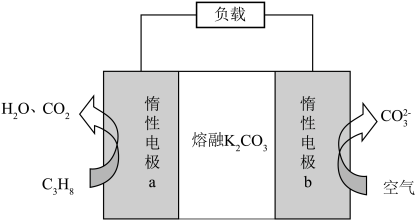
更新时间:2024-05-11 12:52:13
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】回答下列问题:
(1)拆开 键、
键、 键、
键、 键分别需要吸收的能量为
键分别需要吸收的能量为 、
、 、
、 。则理论上
。则理论上 生成
生成 时
时 _______ (填“吸收”或“放出)_______ kJ热量;事实上所求值即理论值总大于实际值,理由是 _______ 。
(2)在 的密闭容器中放入
的密闭容器中放入 ,发生如下反应:
,发生如下反应: 。反应
。反应 时,测得
时,测得 转化了
转化了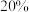 ,则
,则 在混合气体中的体积分数是
在混合气体中的体积分数是_______ (保留三位有效数字)
(3)某温度时,在一个 的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:
的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:

①该反应的化学方程式为_______ 。
②若X、Y、Z均为气体, 时反应达到平衡,此时体系内压强与开始时的压强之比为
时反应达到平衡,此时体系内压强与开始时的压强之比为_______ 。
(1)拆开
 键、
键、 键、
键、 键分别需要吸收的能量为
键分别需要吸收的能量为 、
、 、
、 。则理论上
。则理论上 生成
生成 时
时 (2)在
 的密闭容器中放入
的密闭容器中放入 ,发生如下反应:
,发生如下反应: 。反应
。反应 时,测得
时,测得 转化了
转化了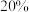 ,则
,则 在混合气体中的体积分数是
在混合气体中的体积分数是(3)某温度时,在一个
 的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:
的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:
①该反应的化学方程式为
②若X、Y、Z均为气体,
 时反应达到平衡,此时体系内压强与开始时的压强之比为
时反应达到平衡,此时体系内压强与开始时的压强之比为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】苯乙烯是生产塑料与合成橡胶的重要原料,目前生产苯乙烯的方法主要为 氧化乙苯脱氢制苯乙烯,其反应如下:
氧化乙苯脱氢制苯乙烯,其反应如下:

(1)下列关于反应Ⅰ~Ⅲ的说法正确的是_______(填序号)。
(2)常压下,乙苯和 经催化剂吸附后才能发生反应Ⅰ.控制投料比[
经催化剂吸附后才能发生反应Ⅰ.控制投料比[ ]分别为1∶1、5∶1和10∶1,并在催化剂的作用下发生反应,乙苯的平衡转化率与反应温度的关系如图所示。
]分别为1∶1、5∶1和10∶1,并在催化剂的作用下发生反应,乙苯的平衡转化率与反应温度的关系如图所示。_______ (填“高”或“低”)。
②850K时,反应经t min达到图中P点所示状态,若初始时乙苯的物质的量为n mol,则v(苯乙烯)=_______ mol/min。
(3)一定温度下,向恒容密闭容器中充入2mol乙苯和2mol ,起始压强为
,起始压强为 kPa,若容器中只发生反应Ⅰ,平衡时容器内气体的总物质的量为5mol,乙苯的转化率为
kPa,若容器中只发生反应Ⅰ,平衡时容器内气体的总物质的量为5mol,乙苯的转化率为_______ ,用平衡分压代替平衡浓度表示的化学平衡常数
_______ kPa。
(4)若在生产过程中只发生反应Ⅱ,向乙苯中混入氮气( 不参与反应),保持体系总压为100kPa下进行反应,不同投料比m下乙苯的平衡转化率随反应温度的变化关系如图所示(其中投料比m为原料气中乙苯和
不参与反应),保持体系总压为100kPa下进行反应,不同投料比m下乙苯的平衡转化率随反应温度的变化关系如图所示(其中投料比m为原料气中乙苯和 的物质的量之比,取值分别为1∶0、1∶1、1∶5、1∶9)。
的物质的量之比,取值分别为1∶0、1∶1、1∶5、1∶9)。_______ (填“ ”“
”“ ”“
”“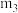 ”或“
”或“ ”),图中A与B两点相比,乙苯的活化分子百分数A
”),图中A与B两点相比,乙苯的活化分子百分数A_______ (填“>”“=”或“<”)B。
 氧化乙苯脱氢制苯乙烯,其反应如下:
氧化乙苯脱氢制苯乙烯,其反应如下:反应Ⅰ: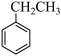 (g)+CO2(g)
(g)+CO2(g)
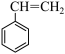 (g)+H2O(g)+CO(g)
(g)+H2O(g)+CO(g) 
反应Ⅱ: (g)
(g)
 (g)+H2(g)
(g)+H2(g) 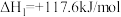


(1)下列关于反应Ⅰ~Ⅲ的说法正确的是_______(填序号)。
| A.及时分离出水蒸气,有利于提高平衡混合物中苯乙烯的含量 |
B.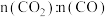 保持恒定时,说明反应Ⅰ达到化学平衡状态 保持恒定时,说明反应Ⅰ达到化学平衡状态 |
| C.其他条件相同,反应Ⅱ分别在恒容和恒压的条件下进行,前者乙苯的平衡转化率更高 |
| D.对于基元反应Ⅲ,正反应的活化能小于逆反应的活化能 |
(2)常压下,乙苯和
 经催化剂吸附后才能发生反应Ⅰ.控制投料比[
经催化剂吸附后才能发生反应Ⅰ.控制投料比[ ]分别为1∶1、5∶1和10∶1,并在催化剂的作用下发生反应,乙苯的平衡转化率与反应温度的关系如图所示。
]分别为1∶1、5∶1和10∶1,并在催化剂的作用下发生反应,乙苯的平衡转化率与反应温度的关系如图所示。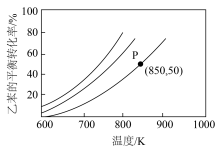
②850K时,反应经t min达到图中P点所示状态,若初始时乙苯的物质的量为n mol,则v(苯乙烯)=
(3)一定温度下,向恒容密闭容器中充入2mol乙苯和2mol
 ,起始压强为
,起始压强为 kPa,若容器中只发生反应Ⅰ,平衡时容器内气体的总物质的量为5mol,乙苯的转化率为
kPa,若容器中只发生反应Ⅰ,平衡时容器内气体的总物质的量为5mol,乙苯的转化率为
(4)若在生产过程中只发生反应Ⅱ,向乙苯中混入氮气(
 不参与反应),保持体系总压为100kPa下进行反应,不同投料比m下乙苯的平衡转化率随反应温度的变化关系如图所示(其中投料比m为原料气中乙苯和
不参与反应),保持体系总压为100kPa下进行反应,不同投料比m下乙苯的平衡转化率随反应温度的变化关系如图所示(其中投料比m为原料气中乙苯和 的物质的量之比,取值分别为1∶0、1∶1、1∶5、1∶9)。
的物质的量之比,取值分别为1∶0、1∶1、1∶5、1∶9)。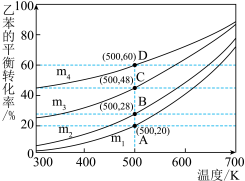
 ”“
”“ ”“
”“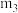 ”或“
”或“ ”),图中A与B两点相比,乙苯的活化分子百分数A
”),图中A与B两点相比,乙苯的活化分子百分数A
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】I.研究和深度开发 CO,CO2的应用对构建生态文明社会具有重要的意义。
(1)CO 可用于炼铁。
已知:a.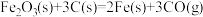 △H1=+489.0kJ·mol-1
△H1=+489.0kJ·mol-1
b.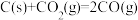 △H2=+172.5 kJ·mol-1
△H2=+172.5 kJ·mol-1
则 △H=
△H=______ 。
(2)CO2和 H2充入一定体积的密闭容器中,在两种温度下发生反应: △H,测得 CH3OH 的物质的量随时间的变化如图所示。
△H,测得 CH3OH 的物质的量随时间的变化如图所示。

①T1______ T2,△H______ 0(填“>”“=”或“<”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则 c的取值范围为______ 。
Ⅱ.固体氧化物电解池(SOEC)用于高温共电解 CO2/H2O,既可高效制备合成气(CO+H2),又可实现 CO2的减排,其工作原理如图所示。
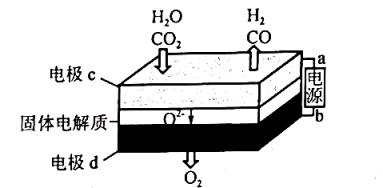
(1)a为电源的______ (填“正极”或“负极”);
(2)该电池是将电能转化为______ 能;请写出电极 c 发生的电极反应式:______ 、______ 。
(1)CO 可用于炼铁。
已知:a.
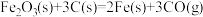 △H1=+489.0kJ·mol-1
△H1=+489.0kJ·mol-1 b.
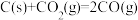 △H2=+172.5 kJ·mol-1
△H2=+172.5 kJ·mol-1则
 △H=
△H=(2)CO2和 H2充入一定体积的密闭容器中,在两种温度下发生反应:
 △H,测得 CH3OH 的物质的量随时间的变化如图所示。
△H,测得 CH3OH 的物质的量随时间的变化如图所示。
①T1
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1 mol CO2 、2 mol H2 | a mol CO2、b mol H2、c mol CH3OH(g)、c mol H2O(g) |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则 c的取值范围为
Ⅱ.固体氧化物电解池(SOEC)用于高温共电解 CO2/H2O,既可高效制备合成气(CO+H2),又可实现 CO2的减排,其工作原理如图所示。

(1)a为电源的
(2)该电池是将电能转化为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】当今,世界各国相继规划了碳达峰、碳中和的时间节点。因此,研发 利用技术、降低空气中
利用技术、降低空气中 含量成为了研究热点。为减少
含量成为了研究热点。为减少 对环境造成的影响,可采用以下方法将其资源化利用。
对环境造成的影响,可采用以下方法将其资源化利用。
(1) 催化加氢制甲醇
催化加氢制甲醇
一定温度下,在某恒容密闭容器中充入一定量的 和
和 ,发生反应:
,发生反应: 。下列叙述能说明该反应已达到平衡状态的是___________(填标号)
。下列叙述能说明该反应已达到平衡状态的是___________(填标号)
(2) 催化加氢合成乙烯
催化加氢合成乙烯
在10 L某恒容密闭容器中,充入1.4mol 和4.2mol
和4.2mol  发生反应:
发生反应:
 。反应达到平衡时,四种组分的物质的量分数
。反应达到平衡时,四种组分的物质的量分数 随温度
随温度 的变化如图所示。
的变化如图所示。

①该反应的
___________ (填“>”或“<”)0,曲线Ⅰ和曲线Ⅱ分别表示___________ (填化学式,下同)和___________ 的变化曲线。
②根据图中a点,计算该温度时的
___________ mol,
___________  ,
, 的平衡转化率为
的平衡转化率为___________ %(保留三位有效数字)。
③若平衡时a点的压强为0.25 MPa,则该反应的平衡常数
___________  (列出计算式,用分压表示,分压=总压×物质的量分数)
(列出计算式,用分压表示,分压=总压×物质的量分数)
(3) 用途广泛,写出其基于物理性质的一种用途:
用途广泛,写出其基于物理性质的一种用途:___________ 。
 利用技术、降低空气中
利用技术、降低空气中 含量成为了研究热点。为减少
含量成为了研究热点。为减少 对环境造成的影响,可采用以下方法将其资源化利用。
对环境造成的影响,可采用以下方法将其资源化利用。(1)
 催化加氢制甲醇
催化加氢制甲醇一定温度下,在某恒容密闭容器中充入一定量的
 和
和 ,发生反应:
,发生反应: 。下列叙述能说明该反应已达到平衡状态的是___________(填标号)
。下列叙述能说明该反应已达到平衡状态的是___________(填标号)| A.混合气体的密度不再随时间变化而改变 |
| B.气体的压强不再随时间变化而改变 |
C. 的物质的量分数不再随时间变化而改变 的物质的量分数不再随时间变化而改变 |
| D.单位时间内每形成1.5mol H-H键,同时形成1mol C-H键 |
 催化加氢合成乙烯
催化加氢合成乙烯在10 L某恒容密闭容器中,充入1.4mol
 和4.2mol
和4.2mol  发生反应:
发生反应:
 。反应达到平衡时,四种组分的物质的量分数
。反应达到平衡时,四种组分的物质的量分数 随温度
随温度 的变化如图所示。
的变化如图所示。
①该反应的

②根据图中a点,计算该温度时的


 ,
, 的平衡转化率为
的平衡转化率为③若平衡时a点的压强为0.25 MPa,则该反应的平衡常数

 (列出计算式,用分压表示,分压=总压×物质的量分数)
(列出计算式,用分压表示,分压=总压×物质的量分数)(3)
 用途广泛,写出其基于物理性质的一种用途:
用途广泛,写出其基于物理性质的一种用途:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】乙烯是合成食品外包装材料聚乙烯的单体,可以由丁烷裂解制备。
主反应:C4H10(g,正丁烷) C2H4(g)+C2H6(g) △H1
C2H4(g)+C2H6(g) △H1
副反应:C4H10(g,正丁烷) CH4(g)+C3H6(g) △H2
CH4(g)+C3H6(g) △H2
回答下列问题:
(1)化学上,将稳定单质的能量定为0,生成稳定化合物时释放或吸收的能量叫做生成热,生成热可表示该物质相对能量。下表为25℃、101kPa下几种有机物的生成热:
①书写热化学方程式时,要标明“同分异构体名称”,其理由是_______________________ 。
②上述反应中,△H1=______ kJ/mol。
(2)一定温度下,在恒容密闭容器中投入一定量正丁烷发生反应生成乙烯。
①下列情况表明该反应达到平衡状态的是_______ (填代号)。
A.气体密度保持不变 B. [c(C2H4)·c(C2H6)]/ c(C4H10)保持不变
C.反应热不变 D.正丁烷分解速率和乙烷消耗速率相等
②为了同时提高反应速率和转化率,可采用的措施是________________ 。
(3)向密闭容器中充入丁烷,在一定条件(浓度、催化剂及压强等) 下发生反应,测得乙烯产率与温度关系如图所示。温度高于600℃时,随若温度升高,乙烯产率降低,可能的原因是__________ (填代号)。

A.平衡常数降低 B.活化能降低
C.催化剂活性降低 D.副产物增多
(4)在一定温度下向1L恒容密闭容器中充入2mol正丁烷,反应生成乙烯和乙烷,经过10min 达到平衡状态,测得平衡时气体压强是原来的1.75倍。
①0~10min内乙烯的生成速率v(C2H4)为________ mol·L-1·min-1。
②上述条件下,该反应的平衡常数K为____________ 。
(5)丁烷-空气燃料电池以熔融的K2CO3为电解质,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池的负极反应式为______________________________ 。
(6)K2CO3可由二氧化碳和氢氧化钾溶液反应制得。常温下,向1 L pH=10的KOH溶液中持续通入CO2,通入CO2的体积(V)与溶液中水电离出的OH-浓度的关系如图所示。C点溶液中各离子浓度大小关系为_________________________________________ 。

主反应:C4H10(g,正丁烷)
 C2H4(g)+C2H6(g) △H1
C2H4(g)+C2H6(g) △H1副反应:C4H10(g,正丁烷)
 CH4(g)+C3H6(g) △H2
CH4(g)+C3H6(g) △H2回答下列问题:
(1)化学上,将稳定单质的能量定为0,生成稳定化合物时释放或吸收的能量叫做生成热,生成热可表示该物质相对能量。下表为25℃、101kPa下几种有机物的生成热:
| 物质 | 甲烷 | 乙烷 | 乙烯 | 丙烯 | 正丁烷 | 异丁烷 |
| 生成热/kJ·mol-1 | -75 | -85 | 52 | 20 | -125 | -132 |
①书写热化学方程式时,要标明“同分异构体名称”,其理由是
②上述反应中,△H1=
(2)一定温度下,在恒容密闭容器中投入一定量正丁烷发生反应生成乙烯。
①下列情况表明该反应达到平衡状态的是
A.气体密度保持不变 B. [c(C2H4)·c(C2H6)]/ c(C4H10)保持不变
C.反应热不变 D.正丁烷分解速率和乙烷消耗速率相等
②为了同时提高反应速率和转化率,可采用的措施是
(3)向密闭容器中充入丁烷,在一定条件(浓度、催化剂及压强等) 下发生反应,测得乙烯产率与温度关系如图所示。温度高于600℃时,随若温度升高,乙烯产率降低,可能的原因是

A.平衡常数降低 B.活化能降低
C.催化剂活性降低 D.副产物增多
(4)在一定温度下向1L恒容密闭容器中充入2mol正丁烷,反应生成乙烯和乙烷,经过10min 达到平衡状态,测得平衡时气体压强是原来的1.75倍。
①0~10min内乙烯的生成速率v(C2H4)为
②上述条件下,该反应的平衡常数K为
(5)丁烷-空气燃料电池以熔融的K2CO3为电解质,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池的负极反应式为
(6)K2CO3可由二氧化碳和氢氧化钾溶液反应制得。常温下,向1 L pH=10的KOH溶液中持续通入CO2,通入CO2的体积(V)与溶液中水电离出的OH-浓度的关系如图所示。C点溶液中各离子浓度大小关系为

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】Ⅰ.运用化学反应原理研究合成氨反应有重要意义,请完成下列探究。
(1)生产氢气:将水蒸气通过红热的炭即产生水煤气。C(s)+H2O(g) H2(g)+CO(g) ΔH=+131.3kJ·mol-1,ΔS=+133.7J·mol-1·K-1。
H2(g)+CO(g) ΔH=+131.3kJ·mol-1,ΔS=+133.7J·mol-1·K-1。
①该反应在低温下___ (填“能”或“不能”)自发进行。
②写出该反应的平衡常数表达式:____ 。
Ⅱ.甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
(2)在一容积为2L的密闭容器内,充入0.2molCO与0.4molH2发生反应:CO(g)+2H2(g) CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示。
CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示。

①A、B两点对应的压强大小关系是pA___ pB(填“>”“<”或“=”)。
②A、B、C三点的平衡常数KA、KB、KC的大小关系是___ 。
③下列叙述能说明上述反应能达到化学平衡状态的是___ (填字母)。
a.H2的消耗速率是CH3OH生成速率的2倍
b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变
d.CO和CH3OH的物质的量之和保持不变
(3)在p1压强、T1℃时,该反应的平衡常数K=___ ,再加入1.0molCO后重新到达平衡,则CO的转化率___ (填“增大”“不变”或“减小”)。
(4)T1℃、1L的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下,n(CO):0.1mol、n(H2):0.2mol、n(CH3OH):0.2mol,此时v正___ v逆(填“>”“<”或“=”)。
(1)生产氢气:将水蒸气通过红热的炭即产生水煤气。C(s)+H2O(g)
 H2(g)+CO(g) ΔH=+131.3kJ·mol-1,ΔS=+133.7J·mol-1·K-1。
H2(g)+CO(g) ΔH=+131.3kJ·mol-1,ΔS=+133.7J·mol-1·K-1。①该反应在低温下
②写出该反应的平衡常数表达式:
Ⅱ.甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
(2)在一容积为2L的密闭容器内,充入0.2molCO与0.4molH2发生反应:CO(g)+2H2(g)
 CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示。
CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示。
①A、B两点对应的压强大小关系是pA
②A、B、C三点的平衡常数KA、KB、KC的大小关系是
③下列叙述能说明上述反应能达到化学平衡状态的是
a.H2的消耗速率是CH3OH生成速率的2倍
b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变
d.CO和CH3OH的物质的量之和保持不变
(3)在p1压强、T1℃时,该反应的平衡常数K=
(4)T1℃、1L的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下,n(CO):0.1mol、n(H2):0.2mol、n(CH3OH):0.2mol,此时v正
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】在2L密闭容器中,使2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g) 2NH3(g) ΔH<0。
2NH3(g) ΔH<0。
(1)该反应是_______ (填“吸热”或“放热”)反应;
(2)当反应达到平衡时,N2和H2的浓度比是_______ ;N2和H2的转化率之比是_______ ;
(3)若平衡时体系中H2的浓度为2mol/L,则N2的转化率是_______ ,该温度下平衡常数K=_______ ;
(4)当达到平衡时,充入氩气,并保持压强不变,平衡将_______ (填“正向”“逆向”或“不”)移动;
(5)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将_______ (填“向左移动”“向右移动”或“不移动”)。达到新平衡后,容器内温度_______ (填“大于”“小于”或“等于”)原来的2倍。
 2NH3(g) ΔH<0。
2NH3(g) ΔH<0。(1)该反应是
(2)当反应达到平衡时,N2和H2的浓度比是
(3)若平衡时体系中H2的浓度为2mol/L,则N2的转化率是
(4)当达到平衡时,充入氩气,并保持压强不变,平衡将
(5)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】(1)严重雾霾天气的产生与汽车排放的NO2(N2O4)、CO、NO等气体有关。回答下列问题:用活性炭处理尾气时还可发生反应:
 ,借助传感器在T1℃测得不同时间点上NO和N2的浓度如下:
,借助传感器在T1℃测得不同时间点上NO和N2的浓度如下:
15 min后,只改变某一条件,反应重新达到平衡;根据上表数据判断改变的条件可能是____ (填字母)。
a.适当缩小容器的体积 b.加入适量的活性炭
c.通入适量的NO d.适当升高温度
(2)750K下,在恒容密闭容器中,充入一定量的甲醇,发生反应 ,若起始压强为101kPa,达到平衡转化率为50.0%,则反应的平衡常数Kp=
,若起始压强为101kPa,达到平衡转化率为50.0%,则反应的平衡常数Kp=______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,忽略其它反应)。
(3)某温度,将2 mol CO与5 mol H2的混合气体充入容积为2 L的密闭容器中,在催化剂的作用下发生反应: 。经过5 min后,反应达到平衡,此时转移电子6 mol。
。经过5 min后,反应达到平衡,此时转移电子6 mol。
①若保持体积不变,再充入2 mol CO和1.5 mol CH3OH,此时v(正)________ v(逆)(填“>”“<”或“=”)。在其他条件不变的情况下,再增加2 mol CO与5 mol H2,达到新平衡时,CO的转化率________ (填“增大”“减小”或“不变”)。
②下列不能说明该反应已达到平衡状态的是________ 。
a.CH3OH的质量不变 b.混合气体的平均相对分子质量不再改变
c.v逆(CO)=2v正(H2) d.混合气体的密度不再发生改变
③在一定压强下,容积为V L的容器充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示。则p1________ p2(填“大于”“小于”或“等于”,下同),ΔH________ 0。


 ,借助传感器在T1℃测得不同时间点上NO和N2的浓度如下:
,借助传感器在T1℃测得不同时间点上NO和N2的浓度如下:| 时间/min 浓度/mol·L−1 | 0 | 5 | 10 | 15 | 20 | 25 |
| NO | 1.20 | 0.74 | 0.56 | 0.56 | 0.63 | 0.63 |
| N2 | 0 | 0.23 | 0.32 | 0.32 | 0.36 | 0.36 |
a.适当缩小容器的体积 b.加入适量的活性炭
c.通入适量的NO d.适当升高温度
(2)750K下,在恒容密闭容器中,充入一定量的甲醇,发生反应
 ,若起始压强为101kPa,达到平衡转化率为50.0%,则反应的平衡常数Kp=
,若起始压强为101kPa,达到平衡转化率为50.0%,则反应的平衡常数Kp=(3)某温度,将2 mol CO与5 mol H2的混合气体充入容积为2 L的密闭容器中,在催化剂的作用下发生反应:
 。经过5 min后,反应达到平衡,此时转移电子6 mol。
。经过5 min后,反应达到平衡,此时转移电子6 mol。①若保持体积不变,再充入2 mol CO和1.5 mol CH3OH,此时v(正)
②下列不能说明该反应已达到平衡状态的是
a.CH3OH的质量不变 b.混合气体的平均相对分子质量不再改变
c.v逆(CO)=2v正(H2) d.混合气体的密度不再发生改变
③在一定压强下,容积为V L的容器充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示。则p1

您最近一年使用:0次
【推荐3】可利用干法热分解法和湿法催化氧化法高效脱除沼气中的 。
。
(1)已知:部分键能数据为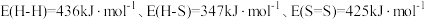 。
。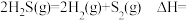
___________  。
。
(2)干法热分解法原理为 。向体积为
。向体积为 恒容容器中充入
恒容容器中充入 ,初始压强为
,初始压强为 ,平衡时体系中各物质
,平衡时体系中各物质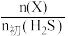 随温度t的变化如图。
随温度t的变化如图。 对应图中的曲线是
对应图中的曲线是___________ (填字母),结合平衡移动原理说明理由。___________
②t1℃时, 的平衡转化率为
的平衡转化率为___________ ,分压平衡常数
___________ (以分压表示,分压=总压×物质的量分数,列计算式即可)。
(3)湿法催化氧化法高效脱除 的过程如下。
的过程如下。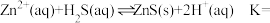
___________ 。(已知:25℃时, 的
的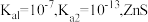 的
的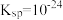 )
)
②“氧化沉硫”中发生反应的离子方程式有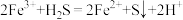 、
、___________ 。
③ 对脱硫效率影响如图。随着
对脱硫效率影响如图。随着 增大,脱硫效率趋于平缓的原因是
增大,脱硫效率趋于平缓的原因是___________ 。___________ (填化学式)。
(4)相比湿法催化氧化法,干法热分解法的优点是___________ ,缺点是___________ 。
 。
。(1)已知:部分键能数据为
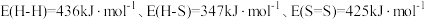 。
。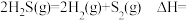
 。
。(2)干法热分解法原理为
 。向体积为
。向体积为 恒容容器中充入
恒容容器中充入 ,初始压强为
,初始压强为 ,平衡时体系中各物质
,平衡时体系中各物质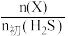 随温度t的变化如图。
随温度t的变化如图。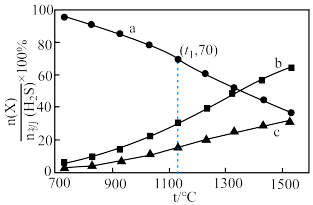
 对应图中的曲线是
对应图中的曲线是②t1℃时,
 的平衡转化率为
的平衡转化率为
(3)湿法催化氧化法高效脱除
 的过程如下。
的过程如下。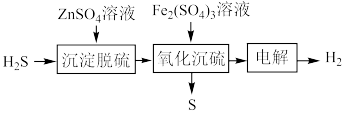
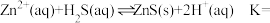
 的
的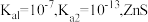 的
的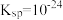 )
)②“氧化沉硫”中发生反应的离子方程式有
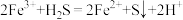 、
、③
 对脱硫效率影响如图。随着
对脱硫效率影响如图。随着 增大,脱硫效率趋于平缓的原因是
增大,脱硫效率趋于平缓的原因是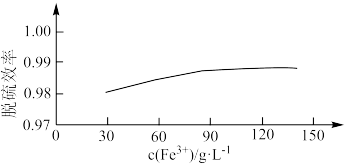
(4)相比湿法催化氧化法,干法热分解法的优点是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】研究光盘金属层含有的Ag(其它金属微量忽略不计)、丢弃电池中的Ag2O等废旧资源的回收利用意义重大。下图为从光盘中提取Ag的工业流程。请回答下列问题。
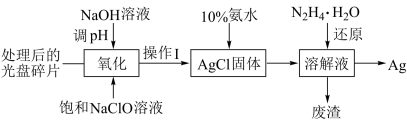
(1)NaClO溶液在受热或酸性条件下易分解,“氧化”阶段需在80℃条件下进行,适宜的加热方式为________ 。
(2)NaClO溶液与Ag反应的产物为AgCl、NaOH和O2,该反应的化学方程式为________ 。有人提出以HNO3代替NaClO氧化Ag,从反应产物的角度分析,其缺点是________ 。
(3)操作Ⅰ的名称为____ ,简述利用“操作Ⅰ”的装置洗涤难溶物的实验操作________ 。
(4)化学上常用10%的氨水溶解AgCl固体,AgCl与NH3·H2O按1︰2反应可生成Cl-和一种阳离子________ 的溶液(填阳离子的化学式)。实际反应中,即使氨水过量也不能将AgCl固体全部溶解,可能的原因是________ 。
(5)常温时N2H4·H2O(水合肼)在碱性条件下能还原(4)中生成的阳离子,自身转化为无害气体N2,理论上消耗0.1 mol的水合肼可提取到________ g的单质Ag。
(6)废旧电池中Ag2O能将有毒气体甲醛(HCHO)氧化成CO2,科学家据此原理将上述过程设计为原电池回收电极材料Ag并有效去除毒气甲醛。则此电池的正极反应式为________ ,负极的产物有________ 。

(1)NaClO溶液在受热或酸性条件下易分解,“氧化”阶段需在80℃条件下进行,适宜的加热方式为
(2)NaClO溶液与Ag反应的产物为AgCl、NaOH和O2,该反应的化学方程式为
(3)操作Ⅰ的名称为
(4)化学上常用10%的氨水溶解AgCl固体,AgCl与NH3·H2O按1︰2反应可生成Cl-和一种阳离子
(5)常温时N2H4·H2O(水合肼)在碱性条件下能还原(4)中生成的阳离子,自身转化为无害气体N2,理论上消耗0.1 mol的水合肼可提取到
(6)废旧电池中Ag2O能将有毒气体甲醛(HCHO)氧化成CO2,科学家据此原理将上述过程设计为原电池回收电极材料Ag并有效去除毒气甲醛。则此电池的正极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】电化学知识给人类的生活和工业生产带来极大的方便。回答下列问题:
(1)新型Na-CO2电池工作原理为:4Na+3CO2 2Na2CO3+C,原电池以熔融的Na2CO3为电解质,正极的电极反应式为
2Na2CO3+C,原电池以熔融的Na2CO3为电解质,正极的电极反应式为_______ 。
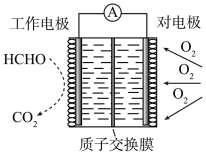
(2)一种检测空气中甲醛含量的电化学传感器的工作原理如图所示,工作电极的电极反应式为_______ ,工作时对电极附近电解质溶液的pH_______ (填“增大”“减小”或“不变”),当进入传感器反应的甲醛为9 g时,有_______ mol H+移向_______ (填“工作电极”或“对电极”)。
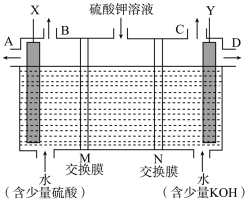
(3)用如图装置电解硫酸钾溶液,可获得H2、O2、硫酸和氢氧化钾溶液。X电极与电源的_______ 极相连,H2从_______ 口导出(填“B”或“C”),M、N交换膜中属于阳离子交换膜的是_______ 。
(1)新型Na-CO2电池工作原理为:4Na+3CO2
 2Na2CO3+C,原电池以熔融的Na2CO3为电解质,正极的电极反应式为
2Na2CO3+C,原电池以熔融的Na2CO3为电解质,正极的电极反应式为(2)一种检测空气中甲醛含量的电化学传感器的工作原理如图所示,工作电极的电极反应式为

(3)用如图装置电解硫酸钾溶液,可获得H2、O2、硫酸和氢氧化钾溶液。X电极与电源的

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】KMnO4常作氧化剂、防腐剂、消毒剂、漂白剂和水处理剂等。
(1)向K2MnO4溶液中通入足量CO2可制得KMnO4,副产物是黑色沉淀M。该反应中氧化剂与还原剂的质量之比为_____ 。在锂离子有机高聚物中锂与M构成原电池,消耗8.7 g M时转移 0.1 mol电子。该电池正极的电极反应式为_____________ 。
(2)实验室用KMnO4制备O2和Cl2。取0.4 mol KMnO4固体加热一段时间后,收集到a mol O2,在反应后的残留固体中加入足量浓盐酸,加热又收集到b mol Cl2。设锰元素全部转化成Mn2+存在于溶液中,当a+b=0.8时,在标准状况下生成Cl2的体积为____ L。
(3)电解K2MnO4溶液可以制备KMnO4。工业上,通常以软锰矿(主要成分是MnO2)与KOH的混合物在铁坩埚中混合均匀,小火加热至熔融,即可得到绿色的K2MnO4,该反应的化学方程式为____________ 。用镍片(不参与反应)作阳极,铁板作阴极,电解K2MnO4溶液可制备KMnO4。上述过程用流程图表示如下:

则D的化学式为____ ;阳极的电极反应式为___________ ;阳离子的迁移方向是____________ 。
(4)废液中c(Mn2+)较大时会污染水体。实验室可用过二硫酸铵[(NH4)2S2O8]溶液检验废水中的Mn2+,实验现象是溶液变紫红色(还原产物为 )。过二硫酸可以看成是H2O2的衍生物,过二硫酸铵中含有过氧键(—O—O—)。写出检验Mn2+时发生反应的离子方程式:
)。过二硫酸可以看成是H2O2的衍生物,过二硫酸铵中含有过氧键(—O—O—)。写出检验Mn2+时发生反应的离子方程式:____________ ;如果将这个反应设计成双液(或双桶)电池,盐桥中的溶液用____ (填“饱和KCl溶液”、“饱和K2SO4溶液”或“饱和NH4Cl溶液”)。
(1)向K2MnO4溶液中通入足量CO2可制得KMnO4,副产物是黑色沉淀M。该反应中氧化剂与还原剂的质量之比为
(2)实验室用KMnO4制备O2和Cl2。取0.4 mol KMnO4固体加热一段时间后,收集到a mol O2,在反应后的残留固体中加入足量浓盐酸,加热又收集到b mol Cl2。设锰元素全部转化成Mn2+存在于溶液中,当a+b=0.8时,在标准状况下生成Cl2的体积为
(3)电解K2MnO4溶液可以制备KMnO4。工业上,通常以软锰矿(主要成分是MnO2)与KOH的混合物在铁坩埚中混合均匀,小火加热至熔融,即可得到绿色的K2MnO4,该反应的化学方程式为

则D的化学式为
(4)废液中c(Mn2+)较大时会污染水体。实验室可用过二硫酸铵[(NH4)2S2O8]溶液检验废水中的Mn2+,实验现象是溶液变紫红色(还原产物为
 )。过二硫酸可以看成是H2O2的衍生物,过二硫酸铵中含有过氧键(—O—O—)。写出检验Mn2+时发生反应的离子方程式:
)。过二硫酸可以看成是H2O2的衍生物,过二硫酸铵中含有过氧键(—O—O—)。写出检验Mn2+时发生反应的离子方程式:
您最近一年使用:0次




