由 键构建
键构建 键是有机化学的热点研究领域。我国科学家利用
键是有机化学的热点研究领域。我国科学家利用 苯基甘氨酸中的
苯基甘氨酸中的 键在
键在 作用下构建
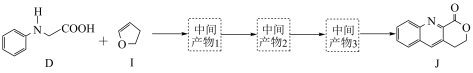
作用下构建 键,实现了喹啉并内酯的高选择性制备。合成路线如图。
键,实现了喹啉并内酯的高选择性制备。合成路线如图。
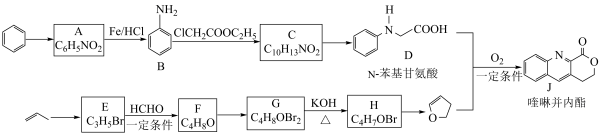
已知:i.
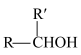
ii.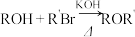
(1) 的反应类型是
的反应类型是___________ 。
(2)B具有碱性, 转化为
转化为 的反应中,使
的反应中,使 过量可以提高
过量可以提高 的平衡转化率,
的平衡转化率, 的作用是
的作用是___________ (写出一条即可)。
(3)C转化为 的化学方程式为
的化学方程式为___________ 。
(4) 转化为
转化为 的化学方程式为
的化学方程式为___________ ; 生成
生成 的过程中会得到少量的聚合物,写出其中一种的结构简式:
的过程中会得到少量的聚合物,写出其中一种的结构简式:___________ 。
(5)已知:
i.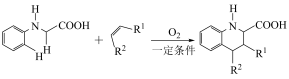
ii.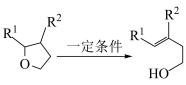
①D和 在
在 作用下得到
作用下得到 的4步反应如图(无机试剂及条件已略去),中间产物1中有两个六元环和一个五元环,中间产物3中有三个六元环。结合已知反应信息,写出结构简式:中间产物1
的4步反应如图(无机试剂及条件已略去),中间产物1中有两个六元环和一个五元环,中间产物3中有三个六元环。结合已知反应信息,写出结构简式:中间产物1___________ ,中间产物3___________ 。
②D和 转化成
转化成 的过程中还生成水,理论上该过程中消耗的
的过程中还生成水,理论上该过程中消耗的 与生成的
与生成的 的物质的量之比为
的物质的量之比为___________ 。
 键构建
键构建 键是有机化学的热点研究领域。我国科学家利用
键是有机化学的热点研究领域。我国科学家利用 苯基甘氨酸中的
苯基甘氨酸中的 键在
键在 作用下构建
作用下构建 键,实现了喹啉并内酯的高选择性制备。合成路线如图。
键,实现了喹啉并内酯的高选择性制备。合成路线如图。
已知:i.

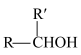
ii.
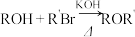
(1)
 的反应类型是
的反应类型是(2)B具有碱性,
 转化为
转化为 的反应中,使
的反应中,使 过量可以提高
过量可以提高 的平衡转化率,
的平衡转化率, 的作用是
的作用是(3)C转化为
 的化学方程式为
的化学方程式为(4)
 转化为
转化为 的化学方程式为
的化学方程式为 生成
生成 的过程中会得到少量的聚合物,写出其中一种的结构简式:
的过程中会得到少量的聚合物,写出其中一种的结构简式:(5)已知:
i.

ii.

①D和
 在
在 作用下得到
作用下得到 的4步反应如图(无机试剂及条件已略去),中间产物1中有两个六元环和一个五元环,中间产物3中有三个六元环。结合已知反应信息,写出结构简式:中间产物1
的4步反应如图(无机试剂及条件已略去),中间产物1中有两个六元环和一个五元环,中间产物3中有三个六元环。结合已知反应信息,写出结构简式:中间产物1
②D和
 转化成
转化成 的过程中还生成水,理论上该过程中消耗的
的过程中还生成水,理论上该过程中消耗的 与生成的
与生成的 的物质的量之比为
的物质的量之比为
更新时间:2024-04-04 10:44:56
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
【推荐1】硫化氢的转化是资源利用和环境保护的重要研究课题。
(1) 通过电化学循环法可将H2S转化为H2SO4和H2(如图所示)。其中氧化过程发生如下两步反应:H2S+H2SO4=SO2↑+S↓+2H2O、S+O2=SO2。
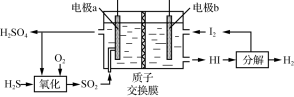
①电极a上发生反应的电极反应式为______ 。
②理论上1 mol H2S参加反应可产生H2的物质的量为______ 。
(2) 表面喷淋水的活性炭可用于吸附氧化H2S,其原理可用下图表示。其它条件不变时,水膜的酸碱性与厚度会影响H2S的去除率。
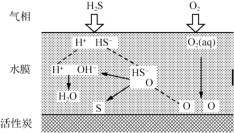
①适当增大活性炭表面的水膜pH,H2S的氧化去除率增大的原因是______ 。
②若水膜过厚,H2S的氧化去除率减小的原因是______ 。
(3)Fe2O3可用作脱除H2S气体的脱硫剂。H2S首先与表面的Fe2O3产生疏松多孔的产物FeS,随着反应的进行,Fe2O3不断减少,产物层不断加厚,可用如图所示。失效的脱硫剂可在氧气中加热重新转化为Fe2O3实现“再生”。
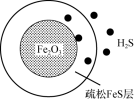
①实验表明用Fe2O3脱除纯H2S反应一段时间后,因为产生的S单质将疏松FeS堵塞,反应速率明显减小。Fe2O3与H2S反应的化学方程式为______ 。
②“再生”时若O2浓度过大、反应温度过高,“再生”后的脱硫剂脱硫效果明显变差的原因可能是______ 。
(1) 通过电化学循环法可将H2S转化为H2SO4和H2(如图所示)。其中氧化过程发生如下两步反应:H2S+H2SO4=SO2↑+S↓+2H2O、S+O2=SO2。

①电极a上发生反应的电极反应式为
②理论上1 mol H2S参加反应可产生H2的物质的量为
(2) 表面喷淋水的活性炭可用于吸附氧化H2S,其原理可用下图表示。其它条件不变时,水膜的酸碱性与厚度会影响H2S的去除率。

①适当增大活性炭表面的水膜pH,H2S的氧化去除率增大的原因是
②若水膜过厚,H2S的氧化去除率减小的原因是
(3)Fe2O3可用作脱除H2S气体的脱硫剂。H2S首先与表面的Fe2O3产生疏松多孔的产物FeS,随着反应的进行,Fe2O3不断减少,产物层不断加厚,可用如图所示。失效的脱硫剂可在氧气中加热重新转化为Fe2O3实现“再生”。

①实验表明用Fe2O3脱除纯H2S反应一段时间后,因为产生的S单质将疏松FeS堵塞,反应速率明显减小。Fe2O3与H2S反应的化学方程式为
②“再生”时若O2浓度过大、反应温度过高,“再生”后的脱硫剂脱硫效果明显变差的原因可能是
您最近半年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
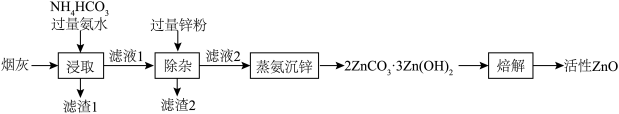
【推荐2】活性ZnO俗名锌白,用作白色颜料,也广泛用于生产玻璃、橡胶、油漆、塑料等。利用化工厂产生的烟灰(ZnO,还含有少量CuO、MnO2、FeO等杂质)制备活性ZnO的工艺流程如图。
(1)Zn的基态价电子排布式为___________ ,烟灰中的主要成分ZnO发生反应的化学方程式为___________ ,滤渣1的主要成分为___________ 。
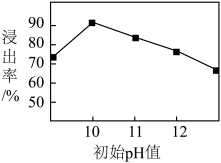
(2)锌元素的浸出率随浸出液初始pH的变化关系如图所示,当浸出液初始pH大于10时,浸出率随pH增大而减小的原因是___________ 。 也能与氨水形成配合物存在于浸出后的滤液中,加入Zn粉可将它置换除去,写出Zn粉和铜氨配合物反应的离子方程式
也能与氨水形成配合物存在于浸出后的滤液中,加入Zn粉可将它置换除去,写出Zn粉和铜氨配合物反应的离子方程式___________ 。
(4)“蒸氨”时会出现白色固体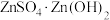 ,运用平衡移动原理解释原因:
,运用平衡移动原理解释原因:___________ 。
(5)从m kg烟灰中得到活性ZnO akg,则ZnO的回收率___________ (填“小于”、“大于”或“等于”)100%。
(6)已知 和
和 的分解温度分别为125℃、300℃。实验室加热碱式碳酸锌
的分解温度分别为125℃、300℃。实验室加热碱式碳酸锌 时测得的固体残留率随温度的变化关系如图所示。
时测得的固体残留率随温度的变化关系如图所示。___________ (填化学式)。
②经焙解得到的活性ZnO晶胞结构如图所示。该晶胞中Zn原子的配位数为___________ 。
(1)Zn的基态价电子排布式为
(2)锌元素的浸出率随浸出液初始pH的变化关系如图所示,当浸出液初始pH大于10时,浸出率随pH增大而减小的原因是
 也能与氨水形成配合物存在于浸出后的滤液中,加入Zn粉可将它置换除去,写出Zn粉和铜氨配合物反应的离子方程式
也能与氨水形成配合物存在于浸出后的滤液中,加入Zn粉可将它置换除去,写出Zn粉和铜氨配合物反应的离子方程式(4)“蒸氨”时会出现白色固体
 ,运用平衡移动原理解释原因:
,运用平衡移动原理解释原因:(5)从m kg烟灰中得到活性ZnO akg,则ZnO的回收率
(6)已知
 和
和 的分解温度分别为125℃、300℃。实验室加热碱式碳酸锌
的分解温度分别为125℃、300℃。实验室加热碱式碳酸锌 时测得的固体残留率随温度的变化关系如图所示。
时测得的固体残留率随温度的变化关系如图所示。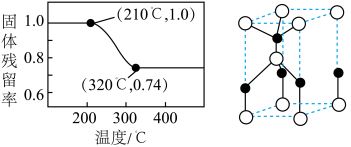
②经焙解得到的活性ZnO晶胞结构如图所示。该晶胞中Zn原子的配位数为
您最近半年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐3】某实验小组从电极反应角度探究银镜反应中物质氧化性和还原性的变化。
资料:ⅰ.[Ag(NH3)2]+⇌ [Ag(NH3)]++NH3K1=10−3.81
[Ag(NH3)]+⇌ Ag++NH3K2=10−3.24
ⅱ.AgOH不稳定,极易分解为黑色Ag2O,Ag2O溶于氨水
(1)实验发现:乙醛和AgNO3溶液水浴加热无明显现象;银氨溶液水浴加热无明显现象;滴加乙醛的银氨溶液水浴加热,试管壁逐渐出现一层光亮的银镜。
①有研究表明:配制银氨溶液时,AgNO3和氨水生成Ag(NH3)2NO3,写出生成Ag(NH3)2NO3的化学方程式_______ 。
②从氧化还原角度分析:发生银镜反应时,氧化性微粒可能是Ag+、_______ 。
(2)甲同学查阅资料:银镜反应时,Ag+被还原成Ag。
①电极反应式:
ⅰ.还原反应:Ag++e−=Ag
ⅱ.氧化反应:_______ 。(碱性条件下)
②从电极反应角度分析物质氧化性和还原性的变化:
ⅰ.随c(Ag+)降低,Ag+氧化性减弱。
ⅱ.随c(OH−)增大,乙醛还原性增强。
③补充实验验证②中的分析。
乙同学认为实验Ⅲ不能证明“随c(Ag+)降低,Ag+氧化性减弱”,理由是_______ 。
(3)设计实验进一步验证。
①乙同学认为通过实验Ⅳ能证明“随c(Ag+)降低,Ag+氧化性减弱”,你认为是否合理并说明原因_______ 。
②分析实验Ⅴ中“立即出现银镜的原因”,提出假设:随c(OH−)增大,可能是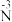 也参与了还原
也参与了还原 。经检验该假设成立,实验方案及现象是
。经检验该假设成立,实验方案及现象是_______ 。
(4)总结:ⅰ.银氨溶液和乙醛发生银镜反应时,氧化剂主要是Ag+,还原剂主要是乙醛;ⅱ.银氨溶液中滴加较浓的NaOH溶液能促进银镜反应的发生,此法不适用于检验醛基,请解释原因_______ 。
资料:ⅰ.[Ag(NH3)2]+⇌ [Ag(NH3)]++NH3K1=10−3.81
[Ag(NH3)]+⇌ Ag++NH3K2=10−3.24
ⅱ.AgOH不稳定,极易分解为黑色Ag2O,Ag2O溶于氨水
(1)实验发现:乙醛和AgNO3溶液水浴加热无明显现象;银氨溶液水浴加热无明显现象;滴加乙醛的银氨溶液水浴加热,试管壁逐渐出现一层光亮的银镜。
①有研究表明:配制银氨溶液时,AgNO3和氨水生成Ag(NH3)2NO3,写出生成Ag(NH3)2NO3的化学方程式
②从氧化还原角度分析:发生银镜反应时,氧化性微粒可能是Ag+、
(2)甲同学查阅资料:银镜反应时,Ag+被还原成Ag。
①电极反应式:
ⅰ.还原反应:Ag++e−=Ag
ⅱ.氧化反应:
②从电极反应角度分析物质氧化性和还原性的变化:
ⅰ.随c(Ag+)降低,Ag+氧化性减弱。
ⅱ.随c(OH−)增大,乙醛还原性增强。
③补充实验验证②中的分析。
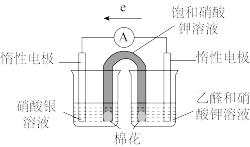
| 实验操作及现象: 实验Ⅰ.插入“饱和KNO3溶液”盐桥,电流表指针偏转; 实验Ⅱ.电流稳定后向右侧烧杯滴加NaOH溶液,指针偏转幅度增大; 实验Ⅲ.电流再次稳定后向左侧烧杯滴加氨水,指针偏转幅度减小 |
(3)设计实验进一步验证。
| 实验 | 实验操作 | 实验现象 |
| Ⅳ | 往盛有银氨溶液的试管中滴加浓氨水,无明显现象,加入3滴乙醛,振荡,水浴加热 | 闻到刺激性气味,溶液略显灰色,试管壁未见银镜 |
| Ⅴ | 往盛有银氨溶液的试管中滴加较浓的NaOH溶液至pH与实验Ⅳ相同,振荡,溶液变浑浊,加入3滴乙醛,振荡,水浴加热 | 试管壁 |
②分析实验Ⅴ中“立即出现银镜的原因”,提出假设:随c(OH−)增大,可能是
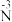 也参与了还原
也参与了还原 。经检验该假设成立,实验方案及现象是
。经检验该假设成立,实验方案及现象是(4)总结:ⅰ.银氨溶液和乙醛发生银镜反应时,氧化剂主要是Ag+,还原剂主要是乙醛;ⅱ.银氨溶液中滴加较浓的NaOH溶液能促进银镜反应的发生,此法不适用于检验醛基,请解释原因
您最近半年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐1】化学实验装置的科学设计是实验是否取得预期效果的关键。请回答下列有关实验装置的相关问题:
Ⅰ.下图A为“人教版”教材制备乙酸乙酯的实验装置,甲同学认为下图B装置进行酯化反应效果比A 要好,他的理由是______________________________ ;乙同学经查阅资料认为下图C装置进行酯化反应效果更好,他的理由是 ________________________________ 。

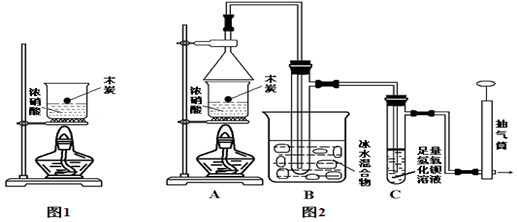
Ⅱ.某实验小组欲探究碳与浓硝酸反应的情况。甲同学设计了图1装置,认为若有红棕色气体产生就说明碳与浓硝酸发生了反应。(已知:C+4HNO3 (浓) 4NO2↑+CO2↑+2H2O)
4NO2↑+CO2↑+2H2O)
(1)甲同学的实验应该在___________ 中进行,才符合化学实验安全性的要求。
(2)乙同学认为红棕色气体不一定是碳与浓硝酸发生反应而得,所以他认为甲同学观点是错误的,他的理由是___________________________ (用化学方程式表示),为此乙同学查阅相关资料得知“0℃时四氧化二氮为液体”,从而改进了实验装置如图2所示。
(3)常温下存在:2NO2 N2O4请用平衡移动原理解释B装置的作用
N2O4请用平衡移动原理解释B装置的作用_______________________________________________________ (用文字表述)。
(4)C装置中出现的现象是_________________ ,经检测C的溶液中还含有少量氮元素,只以NO3-形式存在,写出生成该离子的离子方程式 ___________________________ 。
Ⅰ.下图A为“人教版”教材制备乙酸乙酯的实验装置,甲同学认为下图B装置进行酯化反应效果比A 要好,他的理由是

Ⅱ.某实验小组欲探究碳与浓硝酸反应的情况。甲同学设计了图1装置,认为若有红棕色气体产生就说明碳与浓硝酸发生了反应。(已知:C+4HNO3 (浓)
 4NO2↑+CO2↑+2H2O)
4NO2↑+CO2↑+2H2O)(1)甲同学的实验应该在
(2)乙同学认为红棕色气体不一定是碳与浓硝酸发生反应而得,所以他认为甲同学观点是错误的,他的理由是
(3)常温下存在:2NO2
 N2O4请用平衡移动原理解释B装置的作用
N2O4请用平衡移动原理解释B装置的作用(4)C装置中出现的现象是
您最近半年使用:0次
解答题-有机推断题
|
较难
(0.4)
解题方法
【推荐2】维拉帕米是一种用于治疗高血压的药物,其人工合成路线如图:

(1)A分子中采取 杂化的碳原子数目是
杂化的碳原子数目是_______ 。
(2)C的分子式为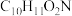 ,则C的结构简式为
,则C的结构简式为_______ 。
(3)B的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:_______ 。
①与 溶液显紫色;
溶液显紫色;
②能发生水解反应,水解产物之一是α-氨基酸,两种水解产物的分子中均含有3种不同化学环境的氢原子。
(4)D+G→维拉帕米,该反应条件是_______ ,该反应类型为_______ 。
(5)已知: ,写出以
,写出以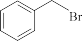 和
和 、
、 为原料制备
为原料制备 的合成路线流程图
的合成路线流程图_______ (无机试剂任用,合成路线流程图示例见本题题干)。

(1)A分子中采取
 杂化的碳原子数目是
杂化的碳原子数目是(2)C的分子式为
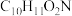 ,则C的结构简式为
,则C的结构简式为(3)B的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:
①与
 溶液显紫色;
溶液显紫色;②能发生水解反应,水解产物之一是α-氨基酸,两种水解产物的分子中均含有3种不同化学环境的氢原子。
(4)D+G→维拉帕米,该反应条件是
(5)已知:
 ,写出以
,写出以 和
和 、
、 为原料制备
为原料制备 的合成路线流程图
的合成路线流程图
您最近半年使用:0次
解答题-有机推断题
|
较难
(0.4)
名校
解题方法
【推荐3】以A为原料可制备C(丹皮酚)和D(树脂),其合成路线如下:
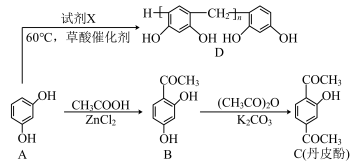
(1)A在空气中会缓慢变成粉红色,其原因是_____________________________________ 。
(2)A→B的反应类型为______________________ ;A生成D的反应中,试剂X(烃的含氧衍生物)为____________________ (写结构简式)。
(3)只含有两个取代基的芳香化合物E是C的同分异构体,E既能与FeCl3溶液发生显色反应又能发生银镜反应和水解反应,则E共有________ 种(不考虑立体结构),其中核磁共振氢谱为六组峰且峰面积比为1:1:2:2:2:2 的结构简式为_______________ 。

(1)A在空气中会缓慢变成粉红色,其原因是
(2)A→B的反应类型为
(3)只含有两个取代基的芳香化合物E是C的同分异构体,E既能与FeCl3溶液发生显色反应又能发生银镜反应和水解反应,则E共有
您最近半年使用:0次
解答题-有机推断题
|
较难
(0.4)
名校
解题方法
【推荐1】氯维地平是治疗高血压的药物,有机物I是合成该药物的一种重要中间体,其一种合成路线如下图所示: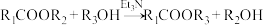
(1)若以乙酰基( )为取代基,化合物F的名称为
)为取代基,化合物F的名称为______ 。
(2)化合物D中含氮官能团名称为______ 、______ 。
(3)由E生成G分两步进行:①E+F→M;②M→G+N。则②的反应类型为______ 。
(4)酮式和烯醇式存在互变异构: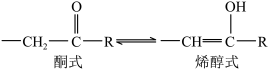 (R为烃基或氢),但大多数情况下酮式是主要存在形式。则化合物C的结构简式为
(R为烃基或氢),但大多数情况下酮式是主要存在形式。则化合物C的结构简式为______ 。
(5)G与足量 在Ni催化下反应的化学方程式为
在Ni催化下反应的化学方程式为______ 。
(6)胺类化合物K与D互为同分异构体,则符合下列条件的K有______ 种。
①只含两种官能团,且同种官能团的氢原子化学环境完全相同;
②遇 溶液显紫色
溶液显紫色
(7) 键迁移重排是有机反应中一类重要反应,有机物X→Y的
键迁移重排是有机反应中一类重要反应,有机物X→Y的 键迁移重排异构化反应如图所示,
键迁移重排异构化反应如图所示,
(1)若以乙酰基(
 )为取代基,化合物F的名称为
)为取代基,化合物F的名称为(2)化合物D中含氮官能团名称为
(3)由E生成G分两步进行:①E+F→M;②M→G+N。则②的反应类型为
(4)酮式和烯醇式存在互变异构:
 (R为烃基或氢),但大多数情况下酮式是主要存在形式。则化合物C的结构简式为
(R为烃基或氢),但大多数情况下酮式是主要存在形式。则化合物C的结构简式为(5)G与足量
 在Ni催化下反应的化学方程式为
在Ni催化下反应的化学方程式为(6)胺类化合物K与D互为同分异构体,则符合下列条件的K有
①只含两种官能团,且同种官能团的氢原子化学环境完全相同;
②遇
 溶液显紫色
溶液显紫色(7)
 键迁移重排是有机反应中一类重要反应,有机物X→Y的
键迁移重排是有机反应中一类重要反应,有机物X→Y的 键迁移重排异构化反应如图所示,
键迁移重排异构化反应如图所示,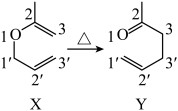
据此推测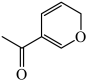 的异构化反应产物的结构简式为
的异构化反应产物的结构简式为
您最近半年使用:0次
解答题-有机推断题
|
较难
(0.4)
名校
解题方法
【推荐2】尼龙-66广泛用于制造机械、汽车、化学与电气装置的零件,亦可制成薄膜用作包装材料,其合成路线如图所示(中间产物E给出了两条合成路线)。
已知:R—Cl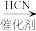 R—CN
R—CN R—CH2NH2
R—CH2NH2

完成下列填空:
(1)写出反应类型:反应②________ ;反应③________ 。
(2)写出化合物D的结构简式:_____________________ 。
(3)写出一种与C互为同分异构体,且能发生银镜反应的化合物的结构简式:________ 。
(4)写出反应①的化学方程式:___________ 。
(5)下列化合物中能与E发生化学反应的是___ 。
a.NaOH b.Na2CO3 c.NaCl d.HCl
(6)用化学方程式表示化合物B的另一种制备方法(原料任选):_______ 。
已知:R—Cl
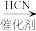 R—CN
R—CN R—CH2NH2
R—CH2NH2
完成下列填空:
(1)写出反应类型:反应②
(2)写出化合物D的结构简式:
(3)写出一种与C互为同分异构体,且能发生银镜反应的化合物的结构简式:
(4)写出反应①的化学方程式:
(5)下列化合物中能与E发生化学反应的是
a.NaOH b.Na2CO3 c.NaCl d.HCl
(6)用化学方程式表示化合物B的另一种制备方法(原料任选):
您最近半年使用:0次
解答题-有机推断题
|
较难
(0.4)
解题方法
【推荐3】抗肿瘤药物博舒替尼(J)的一种合成路线如下:

已知: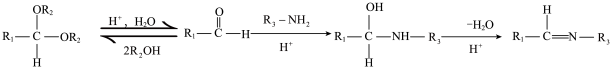
请回答:
(1)A中官能团的名称为______________________ 。
(2)反应②的化学方程式是__________________ 。
(3)E→F的反应可以看作两步反应发生,这两步反应的类型依次为加成反应、________ ,中间体的结构简式为_______________ 。
(4)反应⑥的化学方程式为_____________ 。
(5)H的结构简式为_________ 。
(6)I的分子式为____________________ 。
(7)K是A的同分异构体,满足下列条件的K的结构有___ 种 (不考虑立体异构)。
a.分子结构中含有苯环,不含有甲基
B.苯环上只有两个取代基
C.1molK分别能与3molNa、2molNaOH、1molNaHCO3反应

已知:

请回答:
(1)A中官能团的名称为
(2)反应②的化学方程式是
(3)E→F的反应可以看作两步反应发生,这两步反应的类型依次为加成反应、
(4)反应⑥的化学方程式为
(5)H的结构简式为
(6)I的分子式为
(7)K是A的同分异构体,满足下列条件的K的结构有
a.分子结构中含有苯环,不含有甲基
B.苯环上只有两个取代基
C.1molK分别能与3molNa、2molNaOH、1molNaHCO3反应
您最近半年使用:0次
解答题-有机推断题
|
较难
(0.4)
名校
【推荐1】化合物H是一种合成精神类药物盐酸舍曲林的中间体,其合成路线如图:___________ , 的反应类型是
的反应类型是___________ ,C中含氧官能团的名称是___________ 。
(2) 反应的化学方程式为
反应的化学方程式为___________ 。
(3)G中含有11种不同化学环境的氢原子,则G的结构简式为___________ 。
(4)符合下列条件的D的同分异构体有___________ 种。
①苯环上有4个取代基 ②遇 溶液显紫色
溶液显紫色
③与 溶液反应放出气体 ④核磁共振氢谱显示四组峰,且峰面积比为
溶液反应放出气体 ④核磁共振氢谱显示四组峰,且峰面积比为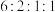
(5)设计以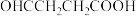 和苯为原料制备
和苯为原料制备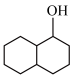 的合成路线(无机试剂任选):
的合成路线(无机试剂任选):___________ 。
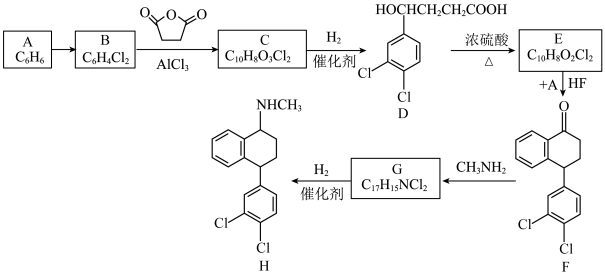
已知:①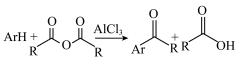 (ArH指芳香化合物)
(ArH指芳香化合物)
②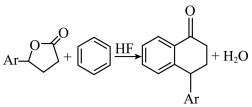
 的反应类型是
的反应类型是(2)
 反应的化学方程式为
反应的化学方程式为(3)G中含有11种不同化学环境的氢原子,则G的结构简式为
(4)符合下列条件的D的同分异构体有
①苯环上有4个取代基 ②遇
 溶液显紫色
溶液显紫色③与
 溶液反应放出气体 ④核磁共振氢谱显示四组峰,且峰面积比为
溶液反应放出气体 ④核磁共振氢谱显示四组峰,且峰面积比为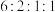
(5)设计以
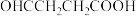 和苯为原料制备
和苯为原料制备 的合成路线(无机试剂任选):
的合成路线(无机试剂任选):
您最近半年使用:0次
解答题-有机推断题
|
较难
(0.4)
名校
【推荐2】有机物G是合成某种耐热聚合物的单体,其合成方法如下:

已知:R1COOR2+R3OH RCOOR3+R2OH
RCOOR3+R2OH
(1)根据系统命名法,A的名称为___ .
(2)上述流程中的取代反应除②、③外还有___ (填序号).第⑤步反应中,可使用含有18O的F,将之与C反应,并检测产物中18O的分布情况,从而推断反应机理,这种研究方法称为___ .
(3)化合物E的核磁共振氢谱图中共有多个吸收峰,各峰的峰面积比为___ .
(4)按下列合成路线可得到F的同分异构体H,则可鉴别H与F的试剂是___ .
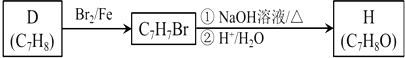
(5)C与足量NaOH溶液反应的化学方程式为___ .
(6)J与C互为同分异构体,其具有如下性质.符合要求的有机物有___ 种(不考虑立体异构)
①能与NaOH溶液反应,且1mol J完全反应消耗4mol NaOH
②能发生银镜反应,且1mol J与足量的银氨溶液反应生成4mol Ag
③分子中苯环上的一氯取代物只有一种.

已知:R1COOR2+R3OH
 RCOOR3+R2OH
RCOOR3+R2OH(1)根据系统命名法,A的名称为
(2)上述流程中的取代反应除②、③外还有
(3)化合物E的核磁共振氢谱图中共有多个吸收峰,各峰的峰面积比为
(4)按下列合成路线可得到F的同分异构体H,则可鉴别H与F的试剂是
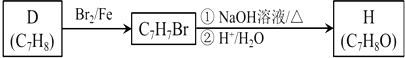
(5)C与足量NaOH溶液反应的化学方程式为
(6)J与C互为同分异构体,其具有如下性质.符合要求的有机物有
①能与NaOH溶液反应,且1mol J完全反应消耗4mol NaOH
②能发生银镜反应,且1mol J与足量的银氨溶液反应生成4mol Ag
③分子中苯环上的一氯取代物只有一种.
您最近半年使用:0次
解答题-有机推断题
|
较难
(0.4)
解题方法
【推荐3】环扁桃酯又名安脉生,在临床上主要用于治疗脑动脉硬化。环扁桃酯的一种合成路线如下所示:
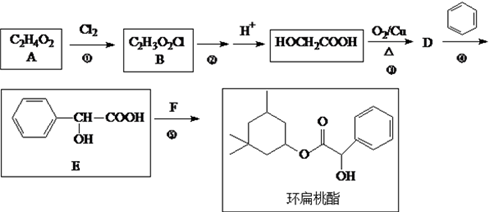
完成下列填空:
(1)写出反应类型:①_______________ ⑤_______________ 。
(2)写出反应②的化学方程式。___________________
(3)反应⑤中另一反应物F的结构简式为__________________ 。
(4)检验D是否已经完全转化E的操作是_________________________ 。
(5)写出一种满足下列条件E的同分异构体的结构简式。________________
i. 能发生水解反应 ii. 苯环上的一溴代物只有两种
(6)苯乙酮(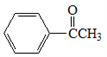 )是工业上合成E的原料之一。设计一条由苯乙酮为原料合成聚苯乙烯(
)是工业上合成E的原料之一。设计一条由苯乙酮为原料合成聚苯乙烯( )的合成路线。(合成路线常用的表示方式为:A
)的合成路线。(合成路线常用的表示方式为:A B
B )
)______________________
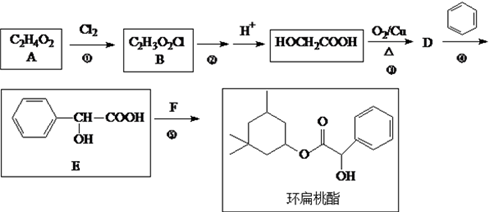
完成下列填空:
(1)写出反应类型:①
(2)写出反应②的化学方程式。
(3)反应⑤中另一反应物F的结构简式为
(4)检验D是否已经完全转化E的操作是
(5)写出一种满足下列条件E的同分异构体的结构简式。
i. 能发生水解反应 ii. 苯环上的一溴代物只有两种
(6)苯乙酮(
 )是工业上合成E的原料之一。设计一条由苯乙酮为原料合成聚苯乙烯(
)是工业上合成E的原料之一。设计一条由苯乙酮为原料合成聚苯乙烯( )的合成路线。(合成路线常用的表示方式为:A
)的合成路线。(合成路线常用的表示方式为:A B
B )
)
您最近半年使用:0次



