2011·山西太原·三模
解题方法
1 . 已知A~N分别代表一种物质,它们之间的转化关系如图所示(部分反应的反应条件和生成物已略去)。A、B、C分别是由短周期元素组成的单质,A是金属,D是无色液体。F是一种离子化含物,其阴阳离子的个数比为1:3,且能与水反应得到两种碱。反应①是实验室检验某离子的方法,反应②是工业、生产N的重要反应。请回答下列问题:
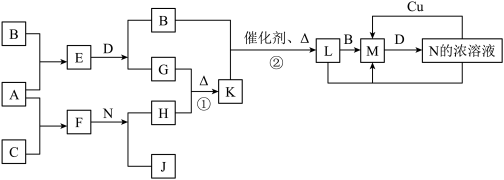
(1)B元素在元素周期表中的位置是__________ ,F的电子式是_____________ 。
(2)写出反应①的离子方程式:___________ ;
(3)Cu与足量的N的浓溶液反应得到的产物主要是M不是L,其原因是__________ (请用上图所示关系中反应的化学方程式回答)。
(4)选择性催化还原(SCR)是在有催化剂的条件下将M转变为无毒的物质,这是目前国外进行尾气治理遍采用的一种方法。亚铬酸铜(Adkin偿化剂)是极好的M催化还原的催化剂,是铜和铬的复合氧化物,成分不固定,如:aCuO·bCr2O3等,统称为亚铬酸铜。其中:CuNH4(OH)CrO4在295℃分解生成复合的氧化物(催化剂)、氮气及水,写出该反应的化学方程式:______________________ 。
(5)已知一定温度(>100℃)下,反应②的平衡常数为1。将0.8molK和1.1molB放入容积为1L的封闭容器中,发生反应②,一段时间后L的浓度为0.4mol/L,此时反应v正_____ v逆(填“>”、“<”或“=”)。当反应到达平衡后,保持温度不变,再加入一定物质的量的B,重新达到平衡,则L的平衡浓度__________ (填“增大”、“不变”或“减小”),B的转化率_________ 。(填“升高”、“不变”或“降低”),L的体积分数___________ (填“增大”、“不变”、“减小”或“无法确定”)。

(1)B元素在元素周期表中的位置是
(2)写出反应①的离子方程式:
(3)Cu与足量的N的浓溶液反应得到的产物主要是M不是L,其原因是
(4)选择性催化还原(SCR)是在有催化剂的条件下将M转变为无毒的物质,这是目前国外进行尾气治理遍采用的一种方法。亚铬酸铜(Adkin偿化剂)是极好的M催化还原的催化剂,是铜和铬的复合氧化物,成分不固定,如:aCuO·bCr2O3等,统称为亚铬酸铜。其中:CuNH4(OH)CrO4在295℃分解生成复合的氧化物(催化剂)、氮气及水,写出该反应的化学方程式:
(5)已知一定温度(>100℃)下,反应②的平衡常数为1。将0.8molK和1.1molB放入容积为1L的封闭容器中,发生反应②,一段时间后L的浓度为0.4mol/L,此时反应v正
您最近半年使用:0次
名校
解题方法
2 .  为淡绿色或蓝白色固体,难溶于水和乙醇,潮湿时易被氧化,常用于染料、医药中间体的生产。以废弃铁铜合金制备
为淡绿色或蓝白色固体,难溶于水和乙醇,潮湿时易被氧化,常用于染料、医药中间体的生产。以废弃铁铜合金制备 的流程如下:
的流程如下:
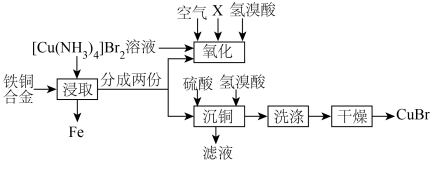
已知:“氧化”阶段存在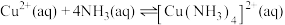 平衡。
平衡。
请回答下列问题:
(1) 在元素周期表中的位置为第
在元素周期表中的位置为第_______ 周期第_______ 族。
(2)“浸取”阶段的产物为 。
。
① 中含有
中含有_______  键。
键。
②其他条件不变, 浸出率与温度关系如图所示。
浸出率与温度关系如图所示。

请解释 以前随温度升高,
以前随温度升高, 浸出率增大的原因:
浸出率增大的原因:_______ 。
③该阶段被氧化的铜元素与被还原的铜元素质量之比为_______ 。
(3)“氧化”阶段试剂X选用_______ (填“液氨”“浓氨水”或“稀氨水”)更好,试从平衡移动角度解释其原因:_______ 。
(4)补全“沉铜”阶段的离子方程式:_______  。
。
(5)洗涤时宜选用_______ (填“冷水”或“乙醇”)。
 为淡绿色或蓝白色固体,难溶于水和乙醇,潮湿时易被氧化,常用于染料、医药中间体的生产。以废弃铁铜合金制备
为淡绿色或蓝白色固体,难溶于水和乙醇,潮湿时易被氧化,常用于染料、医药中间体的生产。以废弃铁铜合金制备 的流程如下:
的流程如下:
已知:“氧化”阶段存在
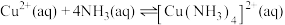 平衡。
平衡。请回答下列问题:
(1)
 在元素周期表中的位置为第
在元素周期表中的位置为第(2)“浸取”阶段的产物为
 。
。①
 中含有
中含有 键。
键。②其他条件不变,
 浸出率与温度关系如图所示。
浸出率与温度关系如图所示。
请解释
 以前随温度升高,
以前随温度升高, 浸出率增大的原因:
浸出率增大的原因:③该阶段被氧化的铜元素与被还原的铜元素质量之比为
(3)“氧化”阶段试剂X选用
(4)补全“沉铜”阶段的离子方程式:
 。
。(5)洗涤时宜选用
您最近半年使用:0次
名校
解题方法
3 . 氢燃料电池汽车所用的有机物液体储氢技术应用前景广阔。该技术的化学反应原理是在一定条件下,环己烷发生气相脱氢反应释放出氢气(反向即为储氢过程):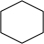 (g)⇌
(g)⇌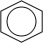 (g)+3H2(g),已知该反应平衡常数与温度的关系如下表:
(g)+3H2(g),已知该反应平衡常数与温度的关系如下表:
140℃时,在体积为2L的密闭容器中充入1mol环己烷(g),发生上述反应。完成下列填空:
(1)元素周期表中,碳元素的位置是_______ 。列举一个能说明硫元素非金属性比碳元素强的事实_______ 。
(2)该反应的化学平衡常数表达式_______ ,正反应是_______ (填“吸热”或“放热”)反应。
(3)若5min时,容器中气体的物质的量增大为原来的2.2倍,此时环己烷的转化率为_______ ,v(正)_______ v(逆)(填“>”、“=”或“<”)。
(4)恒压下,环己烷起始浓度相同时,该反应在有、无分子筛膜时环己烷的平衡转化率随温度的变化如下图所示,其中分子筛膜能选择性分离出H2。

用化学平衡移动原理解释分子筛膜对环己烷平衡转化率的影响_______ 。
 (g)⇌
(g)⇌ (g)+3H2(g),已知该反应平衡常数与温度的关系如下表:
(g)+3H2(g),已知该反应平衡常数与温度的关系如下表:| 温度/℃ | 120 | 140 | 160 |
| 平衡常数 | 5.343×10-2 | 1.152 | 18.70 |
140℃时,在体积为2L的密闭容器中充入1mol环己烷(g),发生上述反应。完成下列填空:
(1)元素周期表中,碳元素的位置是
(2)该反应的化学平衡常数表达式
(3)若5min时,容器中气体的物质的量增大为原来的2.2倍,此时环己烷的转化率为
(4)恒压下,环己烷起始浓度相同时,该反应在有、无分子筛膜时环己烷的平衡转化率随温度的变化如下图所示,其中分子筛膜能选择性分离出H2。

用化学平衡移动原理解释分子筛膜对环己烷平衡转化率的影响
您最近半年使用:0次



