名校
解题方法
1 . 苯甲酸甲酯是一种重要的工业原料,某化学小组采用如图装置,以苯甲酸(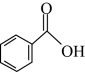 )、甲醇为原料制取苯甲酸甲酯。
)、甲醇为原料制取苯甲酸甲酯。
| 项目 | 苯甲酸 | 甲醇 | 苯甲酸甲酯 |
| 熔点/℃ | 122.4 | -97 | -12.3 |
| 沸点/℃ | 249 | 64.3 | 199.6 |
| 水溶性 | 微溶 | 互溶 | 难溶 |
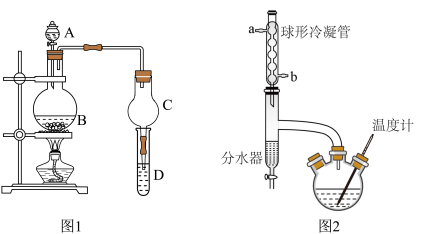
(1)合成苯甲酸甲酯粗产品,在图1烧瓶中加入0.4mol甲醇和0.1mol苯甲酸,混匀后,投入几粒沸石,再加入A中3 mL浓硫酸,小心加热使反应完全,得苯甲酸甲酯粗产品。
①装置A的名称是
②写出该反应的化学方程式
③球形干燥管C的主要作用是
④为提高苯甲酸的转化率,实验中加入过量的甲醇,并改用图2的装置,其中图2能提高转化率的原因是
(2)粗产品的精制。
苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程进行精制:
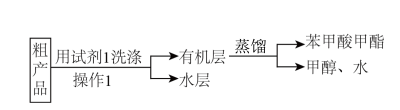
A.饱和食盐水 B.饱和碳酸钠溶液 C.乙醇 D.NaOH稀溶液
②实验制得的苯甲酸甲酯质量为10.2g,则苯甲酸甲酯的产率为
 )
)
您最近一年使用:0次
名校
2 . Ⅰ.将CO2转化为CO、CH3OH等燃料,可以有效的缓解能源危机,同时可以减少温室气体,实现“双碳目标”。
800℃时,H2还原CO2反应的热化学方程式及其平衡常数如下:
ⅰ:CO2(g)+H2(g) CO(g)+H2O(g) ΔH1=+41kJ·mol-1 K1=104
CO(g)+H2O(g) ΔH1=+41kJ·mol-1 K1=104
ⅱ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2=-49.5kJ·mol-1 K2=10-3
CH3OH(g)+H2O(g) ΔH2=-49.5kJ·mol-1 K2=10-3
(1)反应CO(g)+2H2(g) CH3OH(g) ΔH3=
CH3OH(g) ΔH3=___________ kJ·mol-1,K3=___________ 。
Ⅱ.为了减少CO的排放,某环境研究小组以CO和H2为原料合成清洁能源二甲醚(DME),反应如下:4H2(g)+2CO(g) CH3OCH3(g)+H2O(g) ΔH=-198kJ·mol-1。
CH3OCH3(g)+H2O(g) ΔH=-198kJ·mol-1。
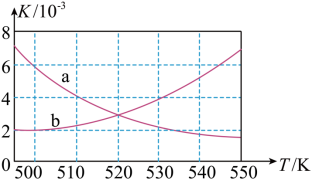
(2)如图所示能正确反映平衡常数K随温度变化关系的曲线为___________ (填曲线标记字母),其判断理由是___________ 。
(3)在一定温度下,向2.0L固定容积的密闭容器中充入2mol H2和1mol CO,经过一段时间后,反应4H2(g)+2CO(g) CH3OCH3(g)+H2O(g)达到平衡。反应过程中测得的部分数据见下表:
CH3OCH3(g)+H2O(g)达到平衡。反应过程中测得的部分数据见下表:
①0~20min的平均反应速率v(CO)=___________ mol·L−1·min−1。
②达到平衡时,H2的转化率为___________ 。
③能表明该反应达到平衡状态的是___________ (填字母)。
A.容器中二甲醚的浓度不变 B.混合气体的平均相对分子质量不变
C.v(CO)与v(H2)的比值不变 D.混合气体的密度不变
800℃时,H2还原CO2反应的热化学方程式及其平衡常数如下:
ⅰ:CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH1=+41kJ·mol-1 K1=104
CO(g)+H2O(g) ΔH1=+41kJ·mol-1 K1=104ⅱ:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH2=-49.5kJ·mol-1 K2=10-3
CH3OH(g)+H2O(g) ΔH2=-49.5kJ·mol-1 K2=10-3(1)反应CO(g)+2H2(g)
 CH3OH(g) ΔH3=
CH3OH(g) ΔH3=Ⅱ.为了减少CO的排放,某环境研究小组以CO和H2为原料合成清洁能源二甲醚(DME),反应如下:4H2(g)+2CO(g)
 CH3OCH3(g)+H2O(g) ΔH=-198kJ·mol-1。
CH3OCH3(g)+H2O(g) ΔH=-198kJ·mol-1。(2)如图所示能正确反映平衡常数K随温度变化关系的曲线为

(3)在一定温度下,向2.0L固定容积的密闭容器中充入2mol H2和1mol CO,经过一段时间后,反应4H2(g)+2CO(g)
 CH3OCH3(g)+H2O(g)达到平衡。反应过程中测得的部分数据见下表:
CH3OCH3(g)+H2O(g)达到平衡。反应过程中测得的部分数据见下表:| 时间/min | 0 | 20 | 40 | 80 | 100 |
| n(H2)/mol | 2.0 | 1.4 | 0.85 | 0.4 | — |
| n(CO)/mol | 1.0 | — | 0.425 | 0.2 | 0.2 |
| n(CH3OCH3)/mol | 0 | 0.15 | — | — | 0.4 |
| n(H2O)/mol | 0 | 0.15 | 0.2875 | 0.4 | 0.4 |
②达到平衡时,H2的转化率为
③能表明该反应达到平衡状态的是
A.容器中二甲醚的浓度不变 B.混合气体的平均相对分子质量不变
C.v(CO)与v(H2)的比值不变 D.混合气体的密度不变
您最近一年使用:0次
解题方法
3 . 我国 加氢制甲醇技术取得了大突破,对解决能源紧缺和环境问题具有重要意义。
加氢制甲醇技术取得了大突破,对解决能源紧缺和环境问题具有重要意义。
(1)铜基催化剂制甲醇其主要反应如下:
Ⅰ. 合成甲醇:
合成甲醇: ;
; ;
;
Ⅱ.逆水煤气反应: ;
; ;
;
Ⅲ.成气合成甲醇: ;
; ;
;
回答下列问题:
①基态 的3d电子轨道表示式为
的3d电子轨道表示式为___________ 。
②
___________  ,
,
___________ (用 ,
, 表示)。
表示)。
(2)若 时将6mol
时将6mol  和8mol
和8mol  充入容积为2L的密闭容器中只发生反应Ⅰ:
充入容积为2L的密闭容器中只发生反应Ⅰ: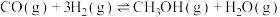 ,
, 的物质的量变化如上表所示。
的物质的量变化如上表所示。
①在 ℃条件下5-10min内,以
℃条件下5-10min内,以 表示的该反应速率
表示的该反应速率
___________ ,该条件下的平衡常数K=___________ 。
②下列说法正确的是___________ 。
A.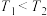
B.混合气体的密度保持不变时,说明反应Ⅰ已达到平衡
C.平衡时向容器中充入惰性气体,反应Ⅰ的平衡正向移动
D.加入适当催化剂,可加快反应速率
(3)某研究小组对催化剂材料进行了研究。下列四组实验,控制 和
和 初始投料比均为1∶2.2,经过相同反应时间(
初始投料比均为1∶2.2,经过相同反应时间( min)
min)
由表格中的数据可知,相同温度下不同的催化剂对 的转化为
的转化为 的选择性有显著影响,根据上表所给数据结合反应原理,所得最优选项为
的选择性有显著影响,根据上表所给数据结合反应原理,所得最优选项为___________ (填字母符号)。
(4)在p=4.00MPa、原料气 、合适催化剂的条件下发生反应,温度对
、合适催化剂的条件下发生反应,温度对 转化率、
转化率、 产率、
产率、 选择性的影响如图所示。已知:
选择性的影响如图所示。已知: 的选择性
的选择性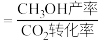 。
。

① 转化率随温度升高而增大的原因可能是
转化率随温度升高而增大的原因可能是___________ 。
② 选择性随温度升高而减小的原因可能是
选择性随温度升高而减小的原因可能是___________ 。
 加氢制甲醇技术取得了大突破,对解决能源紧缺和环境问题具有重要意义。
加氢制甲醇技术取得了大突破,对解决能源紧缺和环境问题具有重要意义。(1)铜基催化剂制甲醇其主要反应如下:
Ⅰ.
 合成甲醇:
合成甲醇: ;
; ;
;
Ⅱ.逆水煤气反应:
 ;
; ;
;
Ⅲ.成气合成甲醇:
 ;
; ;
;
回答下列问题:
①基态
 的3d电子轨道表示式为
的3d电子轨道表示式为②

 ,
,
 ,
, 表示)。
表示)。(2)若
 时将6mol
时将6mol  和8mol
和8mol  充入容积为2L的密闭容器中只发生反应Ⅰ:
充入容积为2L的密闭容器中只发生反应Ⅰ: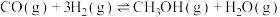 ,
, 的物质的量变化如上表所示。
的物质的量变化如上表所示。| 物质的量/mol |  /℃ /℃ |  /℃ /℃ | |||||
| 0 | 5min | 10min | 15min | 20min | 25min | 30min | |
 | 8.0 | 3.5 | 2.0 | 2.0 | 1.7 | 1.5 | 1.5 |
 ℃条件下5-10min内,以
℃条件下5-10min内,以 表示的该反应速率
表示的该反应速率
②下列说法正确的是
A.
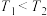
B.混合气体的密度保持不变时,说明反应Ⅰ已达到平衡
C.平衡时向容器中充入惰性气体,反应Ⅰ的平衡正向移动
D.加入适当催化剂,可加快反应速率
(3)某研究小组对催化剂材料进行了研究。下列四组实验,控制
 和
和 初始投料比均为1∶2.2,经过相同反应时间(
初始投料比均为1∶2.2,经过相同反应时间( min)
min)| 温度(K) | 催化剂 |  转化率(%) 转化率(%) | 甲醇选择性(%) | 综合选项 |
| 543 | Cu/ZnO纳米棒材料 | 12.3 | 42.3 | A |
| 543 | Cu/ZnO纳米片材料 | 11.9 | 72.7 | B |
| 553 | Cu/ZnO纳米棒材料 | 15.3 | 39.1 | C |
| 553 | Cu/ZnO纳米片材料 | 12.0 | 71.6 | D |
 的转化为
的转化为 的选择性有显著影响,根据上表所给数据结合反应原理,所得最优选项为
的选择性有显著影响,根据上表所给数据结合反应原理,所得最优选项为(4)在p=4.00MPa、原料气
 、合适催化剂的条件下发生反应,温度对
、合适催化剂的条件下发生反应,温度对 转化率、
转化率、 产率、
产率、 选择性的影响如图所示。已知:
选择性的影响如图所示。已知: 的选择性
的选择性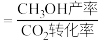 。
。
①
 转化率随温度升高而增大的原因可能是
转化率随温度升高而增大的原因可能是②
 选择性随温度升高而减小的原因可能是
选择性随温度升高而减小的原因可能是
您最近一年使用:0次
名校
4 . 当今世界多国相继规划了碳达峰、碳中和的时间节点。因此,研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。其中用 、
、 为原料合成甲醇(
为原料合成甲醇( )过程主要涉及以下反应:
)过程主要涉及以下反应:
反应Ⅰ:

反应Ⅱ:

反应Ⅲ:
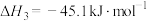
(1)根据盖斯定律,反应Ⅰ的
_______ 。
(2)我国学者结合实验与计算机模拟结果,研究了 与
与 在
在 /Cu催化剂表面生成
/Cu催化剂表面生成 和
和 的部分反应历程,如图所示,其中吸附在催化剂表面的物种用*标注。
的部分反应历程,如图所示,其中吸附在催化剂表面的物种用*标注。
_______ eV。并写出该历程的化学方程式_______ 。
(3)上述反应体系在一定条件下建立平衡后,下列说法正确的有_______(填字母)。
(4)加压,甲醇产率将_______ (填“升高”“不变”“降低”或“无法确定”);若原料二氧化碳中掺混一氧化碳,随一氧化碳含量的增加,甲醇产率将_______ (填“升高”“不变”“降低”或“无法确定”)。
(5)加入新催化剂使1mol 和3mol
和3mol  在1L密闭容器中只发生反应Ⅰ、Ⅱ,
在1L密闭容器中只发生反应Ⅰ、Ⅱ, 平衡转化率和甲醇选择率(甲醇选择率是指转化生成甲醇的
平衡转化率和甲醇选择率(甲醇选择率是指转化生成甲醇的 物质的量分数)与温度的变化趋势如图所示。
物质的量分数)与温度的变化趋势如图所示。_______ (填“473K”“513K”或“553K”)。
②553K时,若反应后体系的总压为p,反应Ⅰ的
_______ (列出计算式)。( 为压强平衡常数,其表达式写法:在浓度平衡常数表达式中用气体分压代替浓度,气体的分压等于总压乘以物质的量分数。)
为压强平衡常数,其表达式写法:在浓度平衡常数表达式中用气体分压代替浓度,气体的分压等于总压乘以物质的量分数。)
 、
、 为原料合成甲醇(
为原料合成甲醇( )过程主要涉及以下反应:
)过程主要涉及以下反应:反应Ⅰ:


反应Ⅱ:


反应Ⅲ:

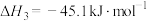
(1)根据盖斯定律,反应Ⅰ的

(2)我国学者结合实验与计算机模拟结果,研究了
 与
与 在
在 /Cu催化剂表面生成
/Cu催化剂表面生成 和
和 的部分反应历程,如图所示,其中吸附在催化剂表面的物种用*标注。
的部分反应历程,如图所示,其中吸附在催化剂表面的物种用*标注。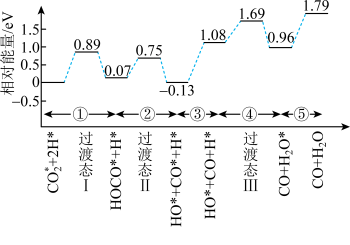

(3)上述反应体系在一定条件下建立平衡后,下列说法正确的有_______(填字母)。
| A.升高温度,反应Ⅱ正向移动,反应Ⅲ逆向移动 |
| B.加入反应Ⅰ的催化剂,可以降低反应的活化能及反应热 |
C.增大 的浓度,有利于提高 的浓度,有利于提高 的平衡转化率 的平衡转化率 |
D.及时分离出 ,可以使得反应Ⅰ的正反应速率增大 ,可以使得反应Ⅰ的正反应速率增大 |
(4)加压,甲醇产率将
(5)加入新催化剂使1mol
 和3mol
和3mol  在1L密闭容器中只发生反应Ⅰ、Ⅱ,
在1L密闭容器中只发生反应Ⅰ、Ⅱ, 平衡转化率和甲醇选择率(甲醇选择率是指转化生成甲醇的
平衡转化率和甲醇选择率(甲醇选择率是指转化生成甲醇的 物质的量分数)与温度的变化趋势如图所示。
物质的量分数)与温度的变化趋势如图所示。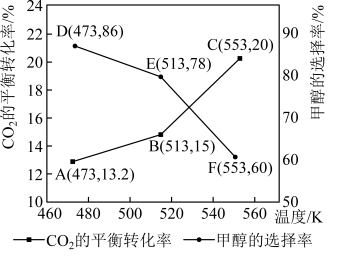
②553K时,若反应后体系的总压为p,反应Ⅰ的

 为压强平衡常数,其表达式写法:在浓度平衡常数表达式中用气体分压代替浓度,气体的分压等于总压乘以物质的量分数。)
为压强平衡常数,其表达式写法:在浓度平衡常数表达式中用气体分压代替浓度,气体的分压等于总压乘以物质的量分数。)
您最近一年使用:0次
2023-09-30更新
|
260次组卷
|
5卷引用:广东省河源中学2023-2024学年上学期高三年级一调考试化学试题



