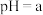名校
1 . 回答下列问题:
(1)在 和
和 溶液中存在如下平衡:
溶液中存在如下平衡: (黄色)
(黄色) (无色)
(无色)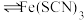 (红色)。将上述溶液均分置于两支试管中;向其中一支试管中加入饱和
(红色)。将上述溶液均分置于两支试管中;向其中一支试管中加入饱和 溶液,溶液颜色变
溶液,溶液颜色变___________ (填“深”或“浅”);向另一支试管中滴加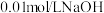 溶液,平衡向
溶液,平衡向___________ (填“正”或“逆”)方向移动。
(2)已知: (
( ,橙色)
,橙色) (
( ,黄色)
,黄色)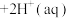
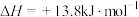 某同学利用以上可逆反应研究浓度对化学平衡的影响,现象如下:
某同学利用以上可逆反应研究浓度对化学平衡的影响,现象如下: 中颜色不变后与试管
中颜色不变后与试管 比较,溶液颜色变浅;②快速滴入浓硫酸,试管
比较,溶液颜色变浅;②快速滴入浓硫酸,试管 温度略有升高,溶液颜色与试管
温度略有升高,溶液颜色与试管 相比溶液颜色变深。下列说法正确的是___________。
相比溶液颜色变深。下列说法正确的是___________。
(3)某同学进行了硫代硫酸钠与硫酸反应的有关实验,实验过程的数据记录如表(见表格),请结合表中信息,回答有关问题:
已知:该反应的化学方程式:
①写出上述反应的离子方程式___________ 。
②根据你所掌握的知识判断,在上述实验中,反应速率最快的可能是___________ (填实验序号)。
③在比较某一因素对实验产生的影响时,必须排除其他因素的变动和干扰,即需要控制好与实验有关的各项反应条件,其中:1和2、1和3的组合比较,所研究的问题是___________ 。找出哪种组合是温度对化学反应速率的影响___________ 。
④教材中利用了出现黄色沉淀的快慢来比较反应速率的快慢,请你分析为何不采用排水法测量单位时间内气体体积的大小进行比较:___________ 。
(1)在
 和
和 溶液中存在如下平衡:
溶液中存在如下平衡: (黄色)
(黄色) (无色)
(无色)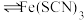 (红色)。将上述溶液均分置于两支试管中;向其中一支试管中加入饱和
(红色)。将上述溶液均分置于两支试管中;向其中一支试管中加入饱和 溶液,溶液颜色变
溶液,溶液颜色变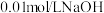 溶液,平衡向
溶液,平衡向(2)已知:
 (
( ,橙色)
,橙色) (
( ,黄色)
,黄色)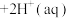
 某同学利用以上可逆反应研究浓度对化学平衡的影响,现象如下:
某同学利用以上可逆反应研究浓度对化学平衡的影响,现象如下: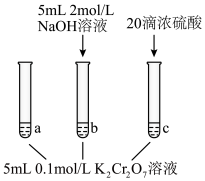
 中颜色不变后与试管
中颜色不变后与试管 比较,溶液颜色变浅;②快速滴入浓硫酸,试管
比较,溶液颜色变浅;②快速滴入浓硫酸,试管 温度略有升高,溶液颜色与试管
温度略有升高,溶液颜色与试管 相比溶液颜色变深。下列说法正确的是___________。
相比溶液颜色变深。下列说法正确的是___________。| A.该反应为氧化还原反应 |
B.待试管 中溶液颜色不变的目的是使 中溶液颜色不变的目的是使 完全反应 完全反应 |
C.试管 中的现象说明影响平衡的主要因素是温度 中的现象说明影响平衡的主要因素是温度 |
| D.该实验不能证明减小生成物浓度,平衡正向移动 |
(3)某同学进行了硫代硫酸钠与硫酸反应的有关实验,实验过程的数据记录如表(见表格),请结合表中信息,回答有关问题:
| 实验编号 | 实验温度 | 参加反应的物质 | ||||
 |  |  | ||||
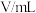 |  | 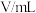 |  | 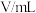 | ||
| 1 | 20 | 10 | 0.1 | 10 | 0.1 | 0 |
| 2 | 20 | 5 | 0.1 | 10 | 0.1 | 5 |
| 3 | 20 | 10 | 0.1 | 5 | 0.1 | 5 |
| 4 | 40 | 5 | 0.1 | 10 | 0.1 | 5 |

①写出上述反应的离子方程式
②根据你所掌握的知识判断,在上述实验中,反应速率最快的可能是
③在比较某一因素对实验产生的影响时,必须排除其他因素的变动和干扰,即需要控制好与实验有关的各项反应条件,其中:1和2、1和3的组合比较,所研究的问题是
④教材中利用了出现黄色沉淀的快慢来比较反应速率的快慢,请你分析为何不采用排水法测量单位时间内气体体积的大小进行比较:
您最近一年使用:0次
解题方法
2 . 某小组同学探究铁离子与苯酚的反应。
已知: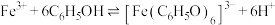 ;
;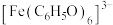 为紫色配合物。
为紫色配合物。
(1)配制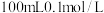 苯酚溶液,需要用到的玻璃仪器有:烧杯、胶头滴管、玻璃棒、
苯酚溶液,需要用到的玻璃仪器有:烧杯、胶头滴管、玻璃棒、__________ 。
(2)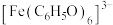 中,提供空轨道用以形成配位键的微粒是
中,提供空轨道用以形成配位键的微粒是__________ ,配位数为__________ 。
(3)探究铁盐种类和pH对苯酚与 显色反应的影响。
显色反应的影响。
查阅资料:
ⅰ. 对苯酚与
对苯酚与 的显色反应无影响;
的显色反应无影响;
ⅱ.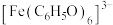 对特定波长光的吸收程度(用吸光度A表示)与
对特定波长光的吸收程度(用吸光度A表示)与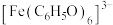 浓度在一定范围内成正比。
浓度在一定范围内成正比。
提出猜想:猜想1: 对苯酚与
对苯酚与 的显色反应有影响
的显色反应有影响
猜想2: 对苯酚与
对苯酚与 的显色反应有影响
的显色反应有影响
猜想3: 对苯酚与
对苯酚与 的显色反应有影响
的显色反应有影响
进行实验:
常温下,用盐酸调节pH,配制得到pH分别为a和b的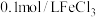 溶液(
溶液( );用硫酸调节pH,配制得到pH分别为a和b的
);用硫酸调节pH,配制得到pH分别为a和b的 溶液。取4支试管各加入
溶液。取4支试管各加入 苯酚溶液,按实验1~4分别再加入0.1mL含
苯酚溶液,按实验1~4分别再加入0.1mL含 的试剂,显色10min后用紫外一可见分光光度计测定该溶液的吸光度(本实验条件下,pH改变对
的试剂,显色10min后用紫外一可见分光光度计测定该溶液的吸光度(本实验条件下,pH改变对 水解程度的影响可忽略)。
水解程度的影响可忽略)。
结果讨论:实验结果为
①根据实验结果,小组同学认为此结果不足以证明猜想3成立的理由是__________________ 。
②为进一步验证猜想,小组同学设计了实验5和6,补充下表中试剂M为__________________ 。(限选试剂:NaCl溶液、 溶液、NaCl固体、
溶液、NaCl固体、 固体)。
固体)。
③根据实验1~6的结果,小组同学得出猜想1不成立,猜想2成立,且 对苯酚与
对苯酚与 的显色反应起抑制作用,得出此结论的依据是:
的显色反应起抑制作用,得出此结论的依据是: 、A1
、A1__________ A6(填“>”“<”或者“=”)。
④根据实验1~6的结果,小组同学得出猜想3成立,且 对
对 与苯酚的显色反应有抑制作用,从化学平衡角度解释其原因是
与苯酚的显色反应有抑制作用,从化学平衡角度解释其原因是______________________________ 。
(4)通过以上实验结论分析:与苯酚相比,对羟基苯甲酸(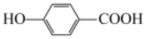 )与
)与 溶液发生显色反应
溶液发生显色反应__________ (填“容易”或“更难”)。
(5)实验室中常用某些配合物的性质进行物质的检验,请举一例子并说明现象____________ 。
已知:
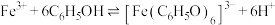 ;
;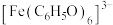 为紫色配合物。
为紫色配合物。(1)配制
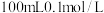 苯酚溶液,需要用到的玻璃仪器有:烧杯、胶头滴管、玻璃棒、
苯酚溶液,需要用到的玻璃仪器有:烧杯、胶头滴管、玻璃棒、(2)
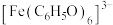 中,提供空轨道用以形成配位键的微粒是
中,提供空轨道用以形成配位键的微粒是(3)探究铁盐种类和pH对苯酚与
 显色反应的影响。
显色反应的影响。查阅资料:
ⅰ.
 对苯酚与
对苯酚与 的显色反应无影响;
的显色反应无影响;ⅱ.
 对特定波长光的吸收程度(用吸光度A表示)与
对特定波长光的吸收程度(用吸光度A表示)与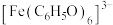 浓度在一定范围内成正比。
浓度在一定范围内成正比。提出猜想:猜想1:
 对苯酚与
对苯酚与 的显色反应有影响
的显色反应有影响猜想2:
 对苯酚与
对苯酚与 的显色反应有影响
的显色反应有影响猜想3:
 对苯酚与
对苯酚与 的显色反应有影响
的显色反应有影响进行实验:
常温下,用盐酸调节pH,配制得到pH分别为a和b的
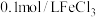 溶液(
溶液( );用硫酸调节pH,配制得到pH分别为a和b的
);用硫酸调节pH,配制得到pH分别为a和b的 溶液。取4支试管各加入
溶液。取4支试管各加入 苯酚溶液,按实验1~4分别再加入0.1mL含
苯酚溶液,按实验1~4分别再加入0.1mL含 的试剂,显色10min后用紫外一可见分光光度计测定该溶液的吸光度(本实验条件下,pH改变对
的试剂,显色10min后用紫外一可见分光光度计测定该溶液的吸光度(本实验条件下,pH改变对 水解程度的影响可忽略)。
水解程度的影响可忽略)。
| 序号 | 含 | 吸光度 | |
|
| |||
1 |
| / | A1 | |
2 |
| / | A2 | |
3 | / |
| A3 | |
4 | / |
| A4 | |

①根据实验结果,小组同学认为此结果不足以证明猜想3成立的理由是
②为进一步验证猜想,小组同学设计了实验5和6,补充下表中试剂M为
 溶液、NaCl固体、
溶液、NaCl固体、 固体)。
固体)。
| 序号 | 含 | 再加入的试剂 | 吸光度 | |
|
| ||||
5 | / |
| NaCl固体 | A5 | |
6 |
| / | 试剂M | A6 | |
 对苯酚与
对苯酚与 的显色反应起抑制作用,得出此结论的依据是:
的显色反应起抑制作用,得出此结论的依据是: 、A1
、A1④根据实验1~6的结果,小组同学得出猜想3成立,且
 对
对 与苯酚的显色反应有抑制作用,从化学平衡角度解释其原因是
与苯酚的显色反应有抑制作用,从化学平衡角度解释其原因是(4)通过以上实验结论分析:与苯酚相比,对羟基苯甲酸(
 )与
)与 溶液发生显色反应
溶液发生显色反应(5)实验室中常用某些配合物的性质进行物质的检验,请举一例子并说明现象
您最近一年使用:0次
名校
3 . 一定条件下,某容积为 的密闭容器中发生反应:
的密闭容器中发生反应: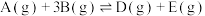
 ,反应过程中正、逆反应速率随着时间的变化如图所示,下列说法正确的是
,反应过程中正、逆反应速率随着时间的变化如图所示,下列说法正确的是
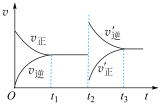
A. 时间段内, 时间段内, |
| B.若容器内气体的密度不再发生变化,则说明达到平衡状态 |
C. 时间段内平衡向正反应方向移动 时间段内平衡向正反应方向移动 |
D. 时刻改变的条件为向容器中加入生成物的同时分离出反应物 时刻改变的条件为向容器中加入生成物的同时分离出反应物 |
您最近一年使用:0次
4 . 下列叙述中,不能用勒夏特列原理解释的是
| A.用饱和食盐水洗气除去氯气中的氯化氢 |
B.将 的乙酸溶液稀释10倍后溶液 的乙酸溶液稀释10倍后溶液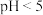 |
| C.合成氨反应常在高压条件下进行 |
D.对 平衡体系压缩容器体积后可使气体颜色变深 平衡体系压缩容器体积后可使气体颜色变深 |
您最近一年使用:0次
23-24高二上·广东深圳·期末
名校
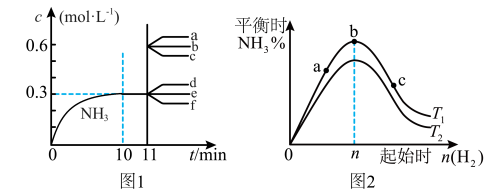
5 . 合成氨反应:N2(g)+3H2(g) 2NH3(g) ΔH<0。图1表示在2L恒容密闭容器中NH3的物质的量浓度随时间的变化曲线。图2表示在其他条件不变时,平衡时NH3的体积分数随起始时H2的物质的量的变化曲线。下列说法正确的是
2NH3(g) ΔH<0。图1表示在2L恒容密闭容器中NH3的物质的量浓度随时间的变化曲线。图2表示在其他条件不变时,平衡时NH3的体积分数随起始时H2的物质的量的变化曲线。下列说法正确的是
 2NH3(g) ΔH<0。图1表示在2L恒容密闭容器中NH3的物质的量浓度随时间的变化曲线。图2表示在其他条件不变时,平衡时NH3的体积分数随起始时H2的物质的量的变化曲线。下列说法正确的是
2NH3(g) ΔH<0。图1表示在2L恒容密闭容器中NH3的物质的量浓度随时间的变化曲线。图2表示在其他条件不变时,平衡时NH3的体积分数随起始时H2的物质的量的变化曲线。下列说法正确的是
| A.图1中,其他条件不变,第11min改用更为高效的催化剂,则c(NH3)-t的变化趋势为曲线b所示 |
| B.图1中,其他条件不变,第11min迅速压缩容器体积为1L,则c(NH3)-t的变化趋势为曲线a所示 |
| C.图2中,反应物N2的平衡转化率:b>a>c |
| D.图2中,T1、T2表示温度,则T1>T2 |
您最近一年使用:0次
名校
解题方法
6 . 实验小组探究酸对Fe3++3SCN- Fe(SCN)3平衡的影响。将0.005mol∙L−1FeCl3溶液(接近无色)和0.01mol∙L−1KSCN溶液等体积混合,得到红色溶液。取两等份红色溶液,进行如下操作并记录现象。
Fe(SCN)3平衡的影响。将0.005mol∙L−1FeCl3溶液(接近无色)和0.01mol∙L−1KSCN溶液等体积混合,得到红色溶液。取两等份红色溶液,进行如下操作并记录现象。
(1)FeCl3水解显酸性的原因是_____ (用离子方程式表示)。
(2)甲同学认为加入酸后,会使Fe3++3SCN- Fe(SCN)3体系中
Fe(SCN)3体系中_____ 浓度改变,导致该平衡正向移动,溶液颜色加深。
【设计并实施实验】
【查阅资料】
Fe3+和Cl-、SO 均能发生络合反应:
均能发生络合反应:
Fe3++4Cl- [FeCl4]-(黄色);Fe3++2SO
[FeCl4]-(黄色);Fe3++2SO
 [Fe(SO4)2]-(无色)。
[Fe(SO4)2]-(无色)。
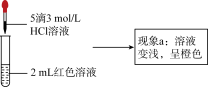
实验Ⅰ、探究现象a中溶液颜色变化的原因
(3)实验①的目的是_____ 。
(4)根据实验①和实验②的结果,从平衡移动角度解释现象a:_____ 。
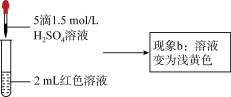
实验Ⅱ、探究现象b中溶液呈浅黄色的原因
(5)结合实验③可推测现象b中使溶液呈浅黄色的微粒可能有两种,分别是_____ 。
(6)乙同学进一步补充了实验④,确证了现象b中使溶液呈浅黄色的微粒只是(5)中的一种,请将实验④的操作及现象补充完整:_____ ,_____ 。
 Fe(SCN)3平衡的影响。将0.005mol∙L−1FeCl3溶液(接近无色)和0.01mol∙L−1KSCN溶液等体积混合,得到红色溶液。取两等份红色溶液,进行如下操作并记录现象。
Fe(SCN)3平衡的影响。将0.005mol∙L−1FeCl3溶液(接近无色)和0.01mol∙L−1KSCN溶液等体积混合,得到红色溶液。取两等份红色溶液,进行如下操作并记录现象。(1)FeCl3水解显酸性的原因是
(2)甲同学认为加入酸后,会使Fe3++3SCN-
 Fe(SCN)3体系中
Fe(SCN)3体系中【设计并实施实验】
 |  |
Fe3+和Cl-、SO
 均能发生络合反应:
均能发生络合反应:Fe3++4Cl-
 [FeCl4]-(黄色);Fe3++2SO
[FeCl4]-(黄色);Fe3++2SO
 [Fe(SO4)2]-(无色)。
[Fe(SO4)2]-(无色)。实验Ⅰ、探究现象a中溶液颜色变化的原因
| 编号 | 操作 | 现象 |
| ① | 向2mL红色溶液中滴加5滴水 | 溶液颜色无明显变化 |
| ② | 向2mL红色溶液中滴加5滴3mol∙L−1KCl溶液 | 溶液颜色变浅,呈橙色 |
(3)实验①的目的是
(4)根据实验①和实验②的结果,从平衡移动角度解释现象a:
实验Ⅱ、探究现象b中溶液呈浅黄色的原因
| 编号 | 操作 | 现象 |
| ③ | 取1mL0.0025mol∙L−1Fe2(SO4)3溶液(无色),加入1mL0.01mol∙L−1KSCN溶液,再加入5滴1.5mol∙L−1H2SO4溶液 | 溶液先变红,加硫酸后变为浅黄色 |
| ④ | 取1mL0.005mol∙L−1FeCl3溶液,_____ | _____ |
(5)结合实验③可推测现象b中使溶液呈浅黄色的微粒可能有两种,分别是
(6)乙同学进一步补充了实验④,确证了现象b中使溶液呈浅黄色的微粒只是(5)中的一种,请将实验④的操作及现象补充完整:
您最近一年使用:0次
名校
7 . 下列实验方法或方案能达到目的的是
| 目的 | 实验方法或方案 | |
| A | 探究压强对化学平衡的影响 | 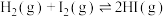  |
| B | 证明碳酸钠水解能力比碳酸氢钠强 | 分别向盛有 饱和 饱和 溶液和饱和 溶液和饱和 溶液的试管中滴加3滴酚酞溶液,观察颜色变化 溶液的试管中滴加3滴酚酞溶液,观察颜色变化 |
| C | 探究浓度对化学平衡移动的影响 | 向两支盛有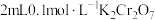 溶液的试管中分别滴入3滴浓硫酸和3滴浓 溶液的试管中分别滴入3滴浓硫酸和3滴浓 溶液,观察溶液颜色的变化 溶液,观察溶液颜色的变化 |
| D | 探究浓度对反应速率的影响 | 分别向两支盛有 溶液的试管中分别加入 溶液的试管中分别加入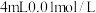 和 和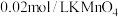 溶液,比较溶液褪色快慢 溶液,比较溶液褪色快慢 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
8 . 痛风病与关节滑液中形成的尿酸钠(NaUr)有关(NaUr增多,病情加重),其化学原理为:
 。下列说法
。下列说法
| A.饮食中摄入过多食盐,会加重痛风病病情 | B.大量饮水会增大痛风病发作的可能性 |
| C.寒冷季节更易诱发关节疼痛 | D.患痛风病的人应少吃能代谢产生更多尿酸的食物 |
您最近一年使用:0次
2024-02-21更新
|
148次组卷
|
41卷引用:广东省信宜市第二中学2022-2023学年高二上学期11月月考化学试题
广东省信宜市第二中学2022-2023学年高二上学期11月月考化学试题广东省珠海市实验中学2022-2023学年高二上学期第一次段考化学试题广东省汕头市聿怀中学2022-2023学年高二上学期期末线上考试化学试题广东省河源市龙川县第一中学2022-2023学年高二上学期期末考试化学试题北京市西城区2019-2020学年度高二上学期期末考试化学试题上海市奉贤区2020届高三5月教学质量调研(二模)化学试题湖北省黄冈市麻城市实验高中2020-2021学年高二上学期10月月考化学试题江西省赣州市南康中学2020-2021学年高二上学期第二次大考化学试题内蒙古阿荣旗第一中学2020-2021学年高二上学期期中考试化学试题山西省朔州市怀仁县大地学校2020-2021学年高二上学期第三次月考化学试题北京市第四十三中学2020-2021学年高二上学期12月月考化学试题辽宁省葫芦岛市2020-2021学年高二上学期期末考试化学试题北京市房山区2020-2021学年高二上学期期末考试化学试题河南省焦作市县级重点中学2021-2022学年高二上学期期中考试化学试题吉林省长白山第二高级中学校2021-2022学年高三上学期第二次月考化学试题北京市第四十四中学2021-2022学年高二上学期期中考试化学试题北京市顺义区杨镇第一中学2021-2022学年高二上学期期中考试化学试题 北京市房山区2022-2023学年高二上学期期中质量检测化学试题北京市第七中学2022-2023学年高二上学期期中化学试题北京市顺义区杨镇第一中学2022-2023学年高二上学期期中检测化学试题北京市顺义区2023届高三第一次统练化学试题安徽省宣城市2022-2023学年高二上学期期末调研考试化学试题(已下线)专题15 化学反应速率和化学平衡新疆乌鲁木齐市第四中学2022-2023学年高二下学期期中阶段诊断测试化学试题(已下线)第05讲 影响化学平衡的因素-【暑假自学课】2023年新高二化学暑假精品课(人教版2019选择性必修1)云南省玉溪师范学院附属中学2022-2023学年高二下学期期末考试化学试题北京市顺义牛栏山第一中学2023-2024学年高二上学期期中考试化学试题黑龙江省齐齐哈尔市恒昌中学校2022-2023学年高二上学期11月期中检测化学试题北京市清华大学附属中学2023-2024学年高二上学期期中考试化学试题北京市第六十六中学2023-2024学年高二上学期期中质量检测化学试题黑龙江省哈尔滨市第三十二中学校2023-2024学年高二上学期11月期中考试化学试题北京市大兴区兴华中学2023-2024学年高二上学期期中考试化学试题北京师范大学附属中学2023-2024学年高二上学期期中考试化学试卷北京市第一六六中学2022-2023学年高二上学期期中考试化学试卷北京师范大学第二附属中学2023-2024学年高二上学期期中考试化学试题浙江省宁波三锋教研联盟2023-2024学年高二上学期期中联考化学试题河南省信阳市淮滨县2022-2023学年高二上学期11月期中考试化学试题甘肃省平凉市第二中学2022-2023学年高二上学期期末考试(延考)化学试题四川省内江市2025届第三中学高二上学期化学试卷北京市北京师范大学附属中学平谷第一分校2023-2024学年高二上学期期中考试化学试题北京市顺义区2022-2023学年高三上学期第一次统练化学试卷
9 . 一定温度下,向2L恒温密闭容器中加入足量活性炭和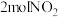 ,发生反应
,发生反应 ,部分物质的物质的量随反应时间t的变化曲线如图所示,下列说法正确的是
,部分物质的物质的量随反应时间t的变化曲线如图所示,下列说法正确的是
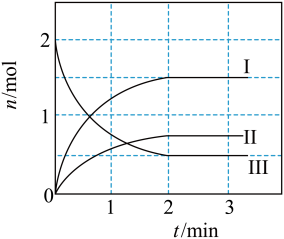
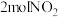 ,发生反应
,发生反应 ,部分物质的物质的量随反应时间t的变化曲线如图所示,下列说法正确的是
,部分物质的物质的量随反应时间t的变化曲线如图所示,下列说法正确的是
A.曲线I表示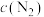 随t的变化 随t的变化 |
B.0~2min内, |
C.3min时,加入催化剂可提高 的平衡转化率 的平衡转化率 |
D.3min时,充入 增大压强,该容器的气体颜色不变 增大压强,该容器的气体颜色不变 |
您最近一年使用:0次
名校
10 . Ⅰ.将CO2转化为CO、CH3OH等燃料,可以有效的缓解能源危机,同时可以减少温室气体,实现“双碳目标”。
800℃时,H2还原CO2反应的热化学方程式及其平衡常数如下:
ⅰ:CO2(g)+H2(g) CO(g)+H2O(g) ΔH1=+41kJ·mol-1 K1=104
CO(g)+H2O(g) ΔH1=+41kJ·mol-1 K1=104
ⅱ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2=-49.5kJ·mol-1 K2=10-3
CH3OH(g)+H2O(g) ΔH2=-49.5kJ·mol-1 K2=10-3
(1)反应CO(g)+2H2(g) CH3OH(g) ΔH3=
CH3OH(g) ΔH3=___________ kJ·mol-1,K3=___________ 。
Ⅱ.为了减少CO的排放,某环境研究小组以CO和H2为原料合成清洁能源二甲醚(DME),反应如下:4H2(g)+2CO(g) CH3OCH3(g)+H2O(g) ΔH=-198kJ·mol-1。
CH3OCH3(g)+H2O(g) ΔH=-198kJ·mol-1。
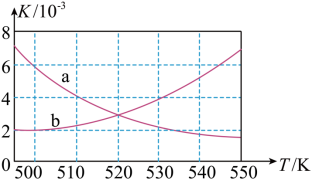
(2)如图所示能正确反映平衡常数K随温度变化关系的曲线为___________ (填曲线标记字母),其判断理由是___________ 。
(3)在一定温度下,向2.0L固定容积的密闭容器中充入2mol H2和1mol CO,经过一段时间后,反应4H2(g)+2CO(g) CH3OCH3(g)+H2O(g)达到平衡。反应过程中测得的部分数据见下表:
CH3OCH3(g)+H2O(g)达到平衡。反应过程中测得的部分数据见下表:
①0~20min的平均反应速率v(CO)=___________ mol·L−1·min−1。
②达到平衡时,H2的转化率为___________ 。
③能表明该反应达到平衡状态的是___________ (填字母)。
A.容器中二甲醚的浓度不变 B.混合气体的平均相对分子质量不变
C.v(CO)与v(H2)的比值不变 D.混合气体的密度不变
800℃时,H2还原CO2反应的热化学方程式及其平衡常数如下:
ⅰ:CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH1=+41kJ·mol-1 K1=104
CO(g)+H2O(g) ΔH1=+41kJ·mol-1 K1=104ⅱ:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH2=-49.5kJ·mol-1 K2=10-3
CH3OH(g)+H2O(g) ΔH2=-49.5kJ·mol-1 K2=10-3(1)反应CO(g)+2H2(g)
 CH3OH(g) ΔH3=
CH3OH(g) ΔH3=Ⅱ.为了减少CO的排放,某环境研究小组以CO和H2为原料合成清洁能源二甲醚(DME),反应如下:4H2(g)+2CO(g)
 CH3OCH3(g)+H2O(g) ΔH=-198kJ·mol-1。
CH3OCH3(g)+H2O(g) ΔH=-198kJ·mol-1。(2)如图所示能正确反映平衡常数K随温度变化关系的曲线为

(3)在一定温度下,向2.0L固定容积的密闭容器中充入2mol H2和1mol CO,经过一段时间后,反应4H2(g)+2CO(g)
 CH3OCH3(g)+H2O(g)达到平衡。反应过程中测得的部分数据见下表:
CH3OCH3(g)+H2O(g)达到平衡。反应过程中测得的部分数据见下表:| 时间/min | 0 | 20 | 40 | 80 | 100 |
| n(H2)/mol | 2.0 | 1.4 | 0.85 | 0.4 | — |
| n(CO)/mol | 1.0 | — | 0.425 | 0.2 | 0.2 |
| n(CH3OCH3)/mol | 0 | 0.15 | — | — | 0.4 |
| n(H2O)/mol | 0 | 0.15 | 0.2875 | 0.4 | 0.4 |
②达到平衡时,H2的转化率为
③能表明该反应达到平衡状态的是
A.容器中二甲醚的浓度不变 B.混合气体的平均相对分子质量不变
C.v(CO)与v(H2)的比值不变 D.混合气体的密度不变
您最近一年使用:0次