19-20高三·江苏苏州·期末
名校
1 . 铁及其化合物在处理工业废水、废气过程中发挥着重要作用。
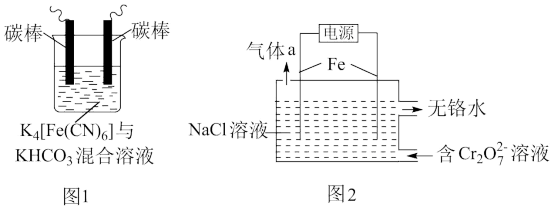
(1)用铁的化合物除硫化氢:2[Fe(CN)6]3-+ 2 +HS- =2[Fe(CN)6]4-+ 2
+HS- =2[Fe(CN)6]4-+ 2 +S↓,可通过图1使[Fe(CN)6]3-再生,电解时,阳极的电极反应式为
+S↓,可通过图1使[Fe(CN)6]3-再生,电解时,阳极的电极反应式为_______ ;电解过程中阴极区溶液的pH_______ (填“变大”、 “变小”或“不变")。
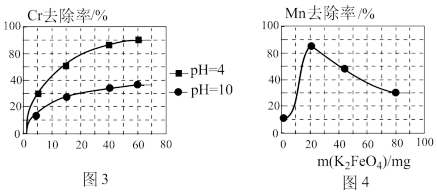
(2)以铁为电极电解除铬,如图2
已知: + H2O=2
+ H2O=2 +2H+
+2H+
氧化性: >
>
①电解过程中主要反应之一: +6Fe2++17H2O= 2Cr(OH)3↓+6Fe(OH)3↓+10H+;气体a主要成分是
+6Fe2++17H2O= 2Cr(OH)3↓+6Fe(OH)3↓+10H+;气体a主要成分是_______ 。
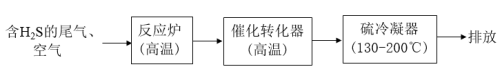
②电解过程中,不同pH时,通电时间与Cr元素的去除率关系如图3所示,pH=10相比pH=4,Cr元素的去除率偏低的原因可能是_______ 。
(3)高铁酸钾(K2FeO4)除锰
已知:K2FeO4具有强氧化性,极易溶于水
①在酸性条件下,能与废水中的Mn2+反应生成Fe(OH)3和MnO2沉淀来除锰,该反应的离子方程式_______ 。
②用K2FeO4处理1L 50 mg/L的含Mn2+废水,Mn元素的去除率与K2FeO4量的关系如图4所示,当K2FeO4超过20 mg时,Mn元素的去除率下降的原因可能是_______ 。

(1)用铁的化合物除硫化氢:2[Fe(CN)6]3-+ 2
 +HS- =2[Fe(CN)6]4-+ 2
+HS- =2[Fe(CN)6]4-+ 2 +S↓,可通过图1使[Fe(CN)6]3-再生,电解时,阳极的电极反应式为
+S↓,可通过图1使[Fe(CN)6]3-再生,电解时,阳极的电极反应式为(2)以铁为电极电解除铬,如图2
已知:
 + H2O=2
+ H2O=2 +2H+
+2H+氧化性:
 >
>
①电解过程中主要反应之一:
 +6Fe2++17H2O= 2Cr(OH)3↓+6Fe(OH)3↓+10H+;气体a主要成分是
+6Fe2++17H2O= 2Cr(OH)3↓+6Fe(OH)3↓+10H+;气体a主要成分是②电解过程中,不同pH时,通电时间与Cr元素的去除率关系如图3所示,pH=10相比pH=4,Cr元素的去除率偏低的原因可能是

(3)高铁酸钾(K2FeO4)除锰
已知:K2FeO4具有强氧化性,极易溶于水
①在酸性条件下,能与废水中的Mn2+反应生成Fe(OH)3和MnO2沉淀来除锰,该反应的离子方程式
②用K2FeO4处理1L 50 mg/L的含Mn2+废水,Mn元素的去除率与K2FeO4量的关系如图4所示,当K2FeO4超过20 mg时,Mn元素的去除率下降的原因可能是
您最近一年使用:0次
2021-03-25更新
|
449次组卷
|
5卷引用:【苏州新东方】化学试卷
(已下线)【苏州新东方】化学试卷湖北省武汉市蔡甸区汉阳一中2021-2022学年高二上学期12月月考化学试题湖北省武汉市部分重点中学2021-2022学年高二上学期12月联考化学试题(已下线)2.3.1 浓度变化对化学平衡的影响-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)江苏省常州市第一中学2023-2024学年高二上学期11月期中考试化学试题
2 . 天然气净化过程中产生有毒的 ,直接排放会污染空气,通过下列方法可以进行处理。
,直接排放会污染空气,通过下列方法可以进行处理。
(1)工业上用克劳斯工艺处理含 的尾气获得硫黄,流程如图:
的尾气获得硫黄,流程如图:
反应炉中的反应: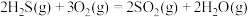 △H=-1035.6kJ∙mol-1
△H=-1035.6kJ∙mol-1
催化转化器中的反应: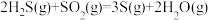 △H=-92.8kJ∙mol-1
△H=-92.8kJ∙mol-1
克劳斯工艺中获得气态硫黄的总反应的热化学方程式:______ 。
(2)T∙F菌在酸性溶液中可实现天然气的催化脱硫,其原理如图所示,下列说法正确的是______ 。
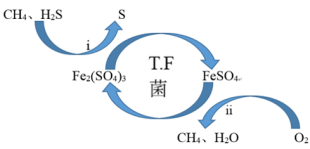
A.脱硫过程需要不断添加Fe2(SO4)3溶液
B.i过程可导致环境pH减小
C.该脱硫过程的总反应为:2H2S+O2=2S↓+2H2O
D.该过程可以在高温下进行
(3) 分解反应
分解反应 △H>0。在无催化剂及
△H>0。在无催化剂及 催化下,
催化下, 在反应器中不同温度时反应,间隔相同时间测定一次
在反应器中不同温度时反应,间隔相同时间测定一次 的转化率,其转化率与温度的关系如图所示:
的转化率,其转化率与温度的关系如图所示:
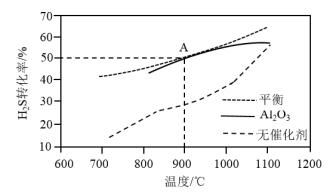
①在约1100℃时,有无 催化,其转化率几乎相等,是因为
催化,其转化率几乎相等,是因为______ 。
②在压强p、温度T, 催化条件下,将
催化条件下,将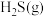 、
、 按照物质的量比为1∶n混合,发生热分解反应
按照物质的量比为1∶n混合,发生热分解反应 ,
, 平衡产率为α。掺入
平衡产率为α。掺入 能提高
能提高 的平衡产率,解释说明该事实
的平衡产率,解释说明该事实______ ,平衡常数Kp=______ (以分压表示,分压=总压×物质的量分数)
(4)当废气中硫化氢浓度较低时常用纯碱溶液进行吸收,已知 、
、 的电离平衡常数如下表所示:
的电离平衡常数如下表所示:
纯碱溶液吸收少量  的离子方程式为
的离子方程式为______ 。
 ,直接排放会污染空气,通过下列方法可以进行处理。
,直接排放会污染空气,通过下列方法可以进行处理。(1)工业上用克劳斯工艺处理含
 的尾气获得硫黄,流程如图:
的尾气获得硫黄,流程如图:
反应炉中的反应:
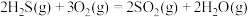 △H=-1035.6kJ∙mol-1
△H=-1035.6kJ∙mol-1催化转化器中的反应:
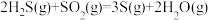 △H=-92.8kJ∙mol-1
△H=-92.8kJ∙mol-1克劳斯工艺中获得气态硫黄的总反应的热化学方程式:
(2)T∙F菌在酸性溶液中可实现天然气的催化脱硫,其原理如图所示,下列说法正确的是

A.脱硫过程需要不断添加Fe2(SO4)3溶液
B.i过程可导致环境pH减小
C.该脱硫过程的总反应为:2H2S+O2=2S↓+2H2O
D.该过程可以在高温下进行
(3)
 分解反应
分解反应 △H>0。在无催化剂及
△H>0。在无催化剂及 催化下,
催化下, 在反应器中不同温度时反应,间隔相同时间测定一次
在反应器中不同温度时反应,间隔相同时间测定一次 的转化率,其转化率与温度的关系如图所示:
的转化率,其转化率与温度的关系如图所示:
①在约1100℃时,有无
 催化,其转化率几乎相等,是因为
催化,其转化率几乎相等,是因为②在压强p、温度T,
 催化条件下,将
催化条件下,将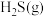 、
、 按照物质的量比为1∶n混合,发生热分解反应
按照物质的量比为1∶n混合,发生热分解反应 ,
, 平衡产率为α。掺入
平衡产率为α。掺入 能提高
能提高 的平衡产率,解释说明该事实
的平衡产率,解释说明该事实(4)当废气中硫化氢浓度较低时常用纯碱溶液进行吸收,已知
 、
、 的电离平衡常数如下表所示:
的电离平衡常数如下表所示:| 电离平衡常数 |  |  |
 |  | 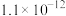 |
 | 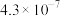 | 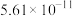 |
 的离子方程式为
的离子方程式为
您最近一年使用:0次
2021-01-03更新
|
1237次组卷
|
9卷引用:八省八校(T8联考)2020-2021学年高三上学期第一次联考化学试题(华中师大一附中)
八省八校(T8联考)2020-2021学年高三上学期第一次联考化学试题(华中师大一附中)(已下线)大题06 化学反应原理综合题(一)-【考前抓大题】备战2021年高考化学(全国通用)(已下线)解密08 化学反应与能量(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密08 化学反应与能量(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)2022年浙江省6月高考真题变式题26-31(已下线)2022年天津市普通高中学业水平等级性考试化学试题变式题(原理综合题)(已下线)03 化学反应原理综合题型集训之Kp计算(解析)-备战2023年高考化学大题逐空突破系列(全国通用)福建省福州第三中学2023届高三下学期第一次质量检测化学试题辽宁省沈阳市五校协作体2023-2024学年高三上学期期中考试化学试题
名校
解题方法
3 . 水煤气变换[CO(g)+H2O(g)
 CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。回答下列问题:
CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。回答下列问题:
(1)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用 标注。
标注。
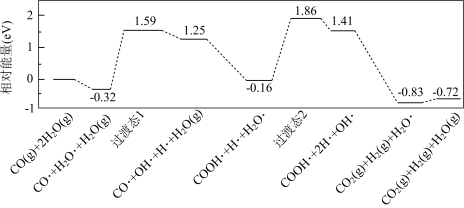
该历程中决速步骤的化学方程式为__ (方程式两边若有相同物料不用约简)。水煤气变换反应的热化学方程式为__ 。
(2)t1℃时,密闭容器中,通入一定量的CO和H2O,发生水煤气变换反应,容器中各物质浓度(单位:mol·L-1)变化如下表所示:
①一定处于平衡状态的时间段为__ 。
②5~6min时间段内,平衡移动方向为__ (填“向左移动”或“向右移动”),根据表中数据判断,平衡移动的原因是__ (填字母编号)。
a.增加了H2O(g)的量 b.增加氢气浓度 c.使用催化剂 d.降低温度
③t2℃时(t2>t1),在相同条件下发生上述反应,达平衡时,CO浓度__ c1(填“>”“<”或“=”)。
(3)已知反应Fe(s)+CO2(g) FeO(s)+CO(g)的平衡常数随温度变化情况如图所示:
FeO(s)+CO(g)的平衡常数随温度变化情况如图所示:

①该反应是__ (填“吸热”或“放热”)反应。
②若T1时水煤气变换反应的平衡常数等于0.5,则T1时FeO(s)+H2(g) Fe(s)+H2O(g)的平衡常数为
Fe(s)+H2O(g)的平衡常数为__ 。
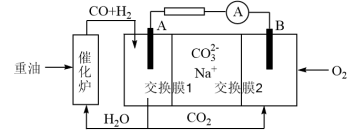
(4)水煤气可做燃料电池的燃料。一种熔融碳酸盐燃料电池的工作原理如图所示。电极A上H2参与的电极反应为__ 。假设催化炉产生的CO与H2物质的量之比为1︰2。电极A处产生的CO2有部分参与循环利用,其利用率为__ 。

 CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。回答下列问题:
CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。回答下列问题:(1)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用
 标注。
标注。
该历程中决速步骤的化学方程式为
(2)t1℃时,密闭容器中,通入一定量的CO和H2O,发生水煤气变换反应,容器中各物质浓度(单位:mol·L-1)变化如下表所示:
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
②5~6min时间段内,平衡移动方向为
a.增加了H2O(g)的量 b.增加氢气浓度 c.使用催化剂 d.降低温度
③t2℃时(t2>t1),在相同条件下发生上述反应,达平衡时,CO浓度
(3)已知反应Fe(s)+CO2(g)
 FeO(s)+CO(g)的平衡常数随温度变化情况如图所示:
FeO(s)+CO(g)的平衡常数随温度变化情况如图所示:
①该反应是
②若T1时水煤气变换反应的平衡常数等于0.5,则T1时FeO(s)+H2(g)
 Fe(s)+H2O(g)的平衡常数为
Fe(s)+H2O(g)的平衡常数为(4)水煤气可做燃料电池的燃料。一种熔融碳酸盐燃料电池的工作原理如图所示。电极A上H2参与的电极反应为

您最近一年使用:0次
名校
4 . 在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C(s)+2NO(g) CO2(g)+N2(g),平衡时c(NO)与温度T的关系如下图所示,则下列说法
CO2(g)+N2(g),平衡时c(NO)与温度T的关系如下图所示,则下列说法不 正确的是
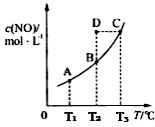
 CO2(g)+N2(g),平衡时c(NO)与温度T的关系如下图所示,则下列说法
CO2(g)+N2(g),平衡时c(NO)与温度T的关系如下图所示,则下列说法
| A.该反应正反应的△H<0 |
| B.若状态A、B的逆反应速率分别为v逆(A)、v逆(B),则v逆(A)>v逆(B) |
| C.在T2时,若反应体系处于状态D,则此时v正>v逆 |
| D.若状态B、C、D的压强分别为PB、PC、PD,则 PC>PD=PB |
您最近一年使用:0次
2019-02-06更新
|
824次组卷
|
6卷引用:【全国百强校】湖北省荆州中学2018-2019学年高二上学期期末考试化学试题
【全国百强校】湖北省荆州中学2018-2019学年高二上学期期末考试化学试题湖北省利川市第五中学2019-2020学年高二12月月考化学试题夯基提能2020届高三化学选择题对题专练——选修4化学反应原理—— 化学平衡的图像分析(强化练习)辽宁省葫芦岛市普通高中2019-2020高二上学期期末质量测试化学试题(已下线)第02章 化学反应速率和化学平衡(A卷基础篇)——2020-2021学年高二化学选修四同步单元AB卷(人教版)吉林油田高级中学2019-2020学年高一下学期期末考试化学试题
名校
5 . (NH4)2Cr2O7用于有机合成催化剂,媒染剂,显影液等。某化学兴趣小组对(NH4)2Cr2O7的部分性质及组成进行探究。已知:Cr2O72-(橙色)+H2O 2CrO42-(黄色)+2H+。回答下列问题:
2CrO42-(黄色)+2H+。回答下列问题:
(1)在试管中加入少量(NH4)2Cr2O7固体,滴加足量浓KOH溶液,振荡、微热,观察到的主要现象是固体溶解、__________ 、__________ 。
(2)为探究(NH4)2Cr2O7 (摩尔质量252g/mol)的分解产物,按下图连接好装置,在A中加入5.040g样品进行实验。
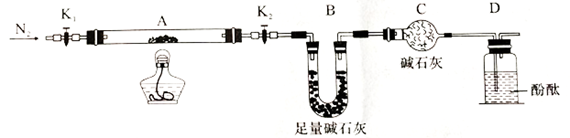
①仪器B的名称是__________ 。
②加热A至恒重,观察到D中溶液不变色,同时测得A、B中质量变化分别为2.00g、1.44g,写出重铬酸铵加热分解反应的化学方程式____________________ 。
③C的作用是__________ 。
(3)实验室常用甲醛法测定含(NH4)2Cr2O7的样品中氮的质量分数,其反应原理为:2Ba2++Cr2O72-+H2O=2BaCrO4↓+2H+、 4NH4++6HCHO =3H++6H2O+(CH2)6N4H+[滴定时,1mol(CH2)6N4H+与1molH+相当],然后用NaOH标准溶液滴定反应生成的酸。
实验步骤:称取样品2.800g,配成250mL溶液,移取25.00mL样品溶液于250mL锥形瓶中,用氯化钡溶液使Cr2O72-完全沉淀后,加入10mL20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用0.200 mol·L-1 NaOH标准溶液滴定至终点。重复上述操作3次。
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则滴定时用去NaOH标准溶液的体积__________ (填“偏大”、“偏小”或“无影响”);滴定时边滴边摇动锥形瓶,眼睛应观察__________ 。
②滴定结果如下表所示

该样品中氮的质量分数为__________ 。
 2CrO42-(黄色)+2H+。回答下列问题:
2CrO42-(黄色)+2H+。回答下列问题:(1)在试管中加入少量(NH4)2Cr2O7固体,滴加足量浓KOH溶液,振荡、微热,观察到的主要现象是固体溶解、
(2)为探究(NH4)2Cr2O7 (摩尔质量252g/mol)的分解产物,按下图连接好装置,在A中加入5.040g样品进行实验。

①仪器B的名称是
②加热A至恒重,观察到D中溶液不变色,同时测得A、B中质量变化分别为2.00g、1.44g,写出重铬酸铵加热分解反应的化学方程式
③C的作用是
(3)实验室常用甲醛法测定含(NH4)2Cr2O7的样品中氮的质量分数,其反应原理为:2Ba2++Cr2O72-+H2O=2BaCrO4↓+2H+、 4NH4++6HCHO =3H++6H2O+(CH2)6N4H+[滴定时,1mol(CH2)6N4H+与1molH+相当],然后用NaOH标准溶液滴定反应生成的酸。
实验步骤:称取样品2.800g,配成250mL溶液,移取25.00mL样品溶液于250mL锥形瓶中,用氯化钡溶液使Cr2O72-完全沉淀后,加入10mL20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用0.200 mol·L-1 NaOH标准溶液滴定至终点。重复上述操作3次。
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则滴定时用去NaOH标准溶液的体积
②滴定结果如下表所示

该样品中氮的质量分数为
您最近一年使用:0次
2019-01-13更新
|
828次组卷
|
3卷引用:【省级联考】湖北省2019届高三上学期1月联考测试理科综合化学试题
名校
6 . 重铬酸钾溶液中存在如下平衡:(1)Cr2O72-+H2O 2H++2CrO42-,向2mL0.1mol·L-1酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,发生反应:Cr2O72-+14H++6Fe2+=2Cr3++6Fe3++7H2O。下列分析正确的是
2H++2CrO42-,向2mL0.1mol·L-1酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,发生反应:Cr2O72-+14H++6Fe2+=2Cr3++6Fe3++7H2O。下列分析正确的是
 2H++2CrO42-,向2mL0.1mol·L-1酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,发生反应:Cr2O72-+14H++6Fe2+=2Cr3++6Fe3++7H2O。下列分析正确的是
2H++2CrO42-,向2mL0.1mol·L-1酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,发生反应:Cr2O72-+14H++6Fe2+=2Cr3++6Fe3++7H2O。下列分析正确的是| A.向K2Cr2O7溶液加入几滴浓NaOH溶液,溶液由黄色变成橙黄 |
| B.氧化性:Cr2O72->Fe3+ |
| C.CrO42-和Fe2+在酸性溶液中能大量共存 |
| D.向K2Cr2O7溶液中加水稀释,反应(1)平衡向左移动 |
您最近一年使用:0次
2017-11-29更新
|
266次组卷
|
2卷引用:湖北省华中师范大学第一附属中学2017-2018学年高二上学期期中考试化学试题
7 . 工业废水中常含有一定量的 和
和 ,它们会对人类及生态系统产生很大的伤害,必须进行处理。该法的工艺流程为
,它们会对人类及生态系统产生很大的伤害,必须进行处理。该法的工艺流程为


 Cr3+
Cr3+ Cr(OH)3↓ 其中第①步存在平衡:2
Cr(OH)3↓ 其中第①步存在平衡:2 (黄色)+2H+
(黄色)+2H+
 (橙色)+H2O
(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显________ 色。
(2)能说明第①步反应达平衡状态的是_________ 。(选填编号)
a. 和
和 的浓度相同 b.v正(
的浓度相同 b.v正( )=2v逆(
)=2v逆( )
)
c.溶液的颜色不变 d.溶液的pH值不变
(3)写出第②步中 转变为Cr3+的离子方程式:
转变为Cr3+的离子方程式:_______________________ .
(4)向Cr2(SO4)3溶液中,滴加NaOH,当pH=4.6时,开始出现Cr(OH)3沉淀,随着pH的升高,沉淀增多,但当pH≥13时,沉淀消失,出现亮绿色的[Cr(OH)4]﹣离子.其平衡关系如下:H++[Cr(OH)4]﹣(亮绿色) Cr(OH)3(s,灰绿色)+H2O
Cr(OH)3(s,灰绿色)+H2O Cr3+(紫色)+H2O +3OH﹣.现向0.05mol·L﹣1的Cr2(SO4)3溶液50mL中,加入等体积0.6mol·L﹣1的NaOH溶液,充分反应后,溶液中可观察到的现象为
Cr3+(紫色)+H2O +3OH﹣.现向0.05mol·L﹣1的Cr2(SO4)3溶液50mL中,加入等体积0.6mol·L﹣1的NaOH溶液,充分反应后,溶液中可观察到的现象为____________________ 。
(5)在Na[Cr(OH)4]和Na2Cr2O7混合后的溶液中加入H2SO4酸化,铬元素以___________ 形式存在(填写离子符号)。
 和
和 ,它们会对人类及生态系统产生很大的伤害,必须进行处理。该法的工艺流程为
,它们会对人类及生态系统产生很大的伤害,必须进行处理。该法的工艺流程为


 Cr3+
Cr3+ Cr(OH)3↓ 其中第①步存在平衡:2
Cr(OH)3↓ 其中第①步存在平衡:2 (黄色)+2H+
(黄色)+2H+
 (橙色)+H2O
(橙色)+H2O(1)若平衡体系的pH=2,则溶液显
(2)能说明第①步反应达平衡状态的是
a.
 和
和 的浓度相同 b.v正(
的浓度相同 b.v正( )=2v逆(
)=2v逆( )
)c.溶液的颜色不变 d.溶液的pH值不变
(3)写出第②步中
 转变为Cr3+的离子方程式:
转变为Cr3+的离子方程式:(4)向Cr2(SO4)3溶液中,滴加NaOH,当pH=4.6时,开始出现Cr(OH)3沉淀,随着pH的升高,沉淀增多,但当pH≥13时,沉淀消失,出现亮绿色的[Cr(OH)4]﹣离子.其平衡关系如下:H++[Cr(OH)4]﹣(亮绿色)
 Cr(OH)3(s,灰绿色)+H2O
Cr(OH)3(s,灰绿色)+H2O Cr3+(紫色)+H2O +3OH﹣.现向0.05mol·L﹣1的Cr2(SO4)3溶液50mL中,加入等体积0.6mol·L﹣1的NaOH溶液,充分反应后,溶液中可观察到的现象为
Cr3+(紫色)+H2O +3OH﹣.现向0.05mol·L﹣1的Cr2(SO4)3溶液50mL中,加入等体积0.6mol·L﹣1的NaOH溶液,充分反应后,溶液中可观察到的现象为(5)在Na[Cr(OH)4]和Na2Cr2O7混合后的溶液中加入H2SO4酸化,铬元素以
您最近一年使用:0次
8 . 有文献报道,硫在空气中燃烧时,产物中SO3约占5% ~ 6%(体积比,下同),而硫在纯氧气中燃烧时,其产物中的SO3约占2% ~ 3%,解释这一事实的理由正确的是( )
| A.在空气中燃烧时,硫的燃烧热小,使化学平衡向有利于生成SO3的方向移动 |
| B.在纯氧气中燃烧时,硫的燃烧热大,不利于化学平衡向生成SO3的方向移动 |
| C.在硫燃烧的过程中,对于SO3的生成,温度的影响大于氧气浓度的影响 |
| D.没有使用催化剂 |
您最近一年使用:0次



