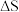N2O4(无色),下列叙述正确的是
N2O4(无色),下列叙述正确的是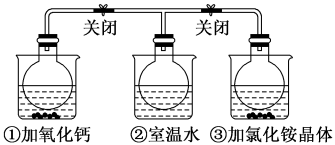
A.2NO2 N2O4是吸热反应 N2O4是吸热反应 |
| B.NH4Cl溶于水时吸收热量 |
| C.①烧瓶中平衡时混合气体的平均相对分子质量增大 |
| D.③烧瓶中气体的压强增大 |
已知:①常温下,Ksp(CoCO3)=1.6×10-7
②相关金属离子[c(Mn+)=1.0mol·L-1]形成氢氧化物沉淀的pH范围如下:
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Co2+ | 7.6 | 9.4 |
| Al3+ | 3.0 | 5.0 |
| Zn2+ | 5.4 | 8.0 |
(2)写出“酸浸”时发生氧化还原反应的化学方程式
(3)“除铝”过程中需要调节溶液pH 的范围为
(4)“萃取”过程可表示为ZnSO4(水层)+2HX(有机层)
 ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是
ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是(5)“沉钴”后经过滤、洗涤、干燥可得CoCO3固体,其中洗涤沉淀的方法是
(6)当Co2+沉淀完全时[c(Co2+)≤1×10-5mol·L-1],溶液中c(CO
 )至少应大于
)至少应大于(7)在空气中煅烧CoCO3生成钴的氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为0.672 L(标准状况),则该钴的氧化物的化学式为
 2SO3(g)(正反应放热),测得反应的相关数据如下:
2SO3(g)(正反应放热),测得反应的相关数据如下:| 容器1 | 容器2 | 容器3 | |
| 反应温度T/K | 700 | 700 | 800 |
| 反应物投入量 | 2molSO2、1molO2 | 4molSO3 | 2molSO2、1molO2 |
| 平衡v正(SO2)/mol/(L·s) | v1 | v2 | v3 |
| 平衡c(SO3)mol/L | c1 | c2 | c3 |
| 平衡体系总压强p/Pa | p1 | p2 | p3 |
| 物质的平衡转化率/α | α1(SO2) | α2(SO3) | α3(SO2) |
| 平衡常数K | K1 | K2 | K3 |
| A.v1<v2,c2<2c1 | B.K1>K3,p2>2p3 |
| C.v1>v3,α1(SO2)>α3(SO2) | D.c2>2c3,α2(SO3)+α3(SO2)<1 |
 Ar-C= N-R + H2O。请回答下列问题:
Ar-C= N-R + H2O。请回答下列问题:(1)要保证反应顺利进行,可采取的措施有
(2)下式表示在金属离子(M2+) 存在或不存在情况下邻氨基苯甲醛的反应,产物中金属离子和N之间的键型是
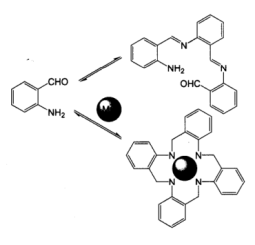
(3)写出以下反应的产物
 + CH3CHO→
+ CH3CHO→ (4)描述以下反应产物的特点,并写出能生成与产物A具有类似结构的一组反应物
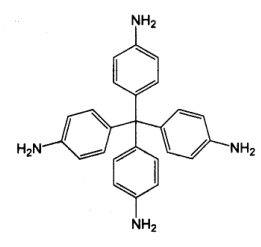 +
+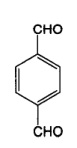 →产物A+H2O
→产物A+H2O
5 . 氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理和化学平衡对于消除环境污染有重要意义。
(1)NO在空气中存在如下反应:2NO(g)+O2(g) 2NO2(g)ΔH。上述反应分两步完成,其反应历程如图所示。
2NO2(g)ΔH。上述反应分两步完成,其反应历程如图所示。

请回答下列问题:
①写出反应II的热化学方程式
②反应I和反应II中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g) 2NO2(g)反应速率的是
2NO2(g)反应速率的是
(2)用活性炭还原法处理氮氧化物的有关反应为:C(s)+2NO(g) N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及12min和15min时各物质的平衡浓度如表所示:
N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及12min和15min时各物质的平衡浓度如表所示:
浓度(mol·L-1) 时间(min) | NO | CO2 | N2 |
0 | 0.200 | 0 | 0 |
12 | 0.050 | 0.075 | 0.075 |
15 | 0.100 | 0.050 | 0.450 |
①T℃时,该反应的平衡常数为
②在12min时,若只改变某一条件使平衡发生移动,15min时重新达到平衡,则改变的条件是
③在15min时,保持温度和容器体积不变再充入NO和N2,使NO、N2的浓度分别增加至原来的2倍4倍,此时反应v正
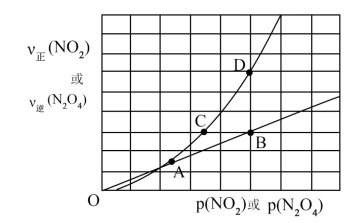
(3)NO2存在如下平衡:2NO2(g) N2O4(g)△H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系式:v正(NO2)=k1·P2(NO2),v逆(N2O4)=k2·P(N2O4),速率与分压关系如图所示。一定温度下,k1、k2与平衡常数Kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是Kp=
N2O4(g)△H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系式:v正(NO2)=k1·P2(NO2),v逆(N2O4)=k2·P(N2O4),速率与分压关系如图所示。一定温度下,k1、k2与平衡常数Kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是Kp=
①水溶液中,K2Cr2O7存在以下平衡:Cr2O
 +H2O
+H2O CrO
CrO +2H+,加入2-3滴NaOH溶液,溶液变黄
+2H+,加入2-3滴NaOH溶液,溶液变黄②探究温度对反应速率的影响:在两支试管中分别混合等体积、同浓度的Na2S2O3溶液和稀硫酸,一支放在热水中,另一支放在冰水中,观察出现浑浊的先后
③[Cu(H2O)4]2+(蓝色)+4C1-
 [CuCl4]2-(黄色)+4H2OΔH>0,升高温度,溶液由蓝色变成黄色
[CuCl4]2-(黄色)+4H2OΔH>0,升高温度,溶液由蓝色变成黄色④把装有NO2与N2O4混合气体的平衡球一端置于冷水,一端置于热水中,置于冷水中的颜色更深
⑤实验室用足量的Zn和稀硫酸反应制备H2,加入几滴CuSO4溶液,反应速率加快,产生H2的量不变
| A.②④⑤ | B.②③⑤ | C.①⑤ | D.①②④ |
 和
和 以减少有害气体的排放。完成下列填空:
以减少有害气体的排放。完成下列填空:Ⅰ.
 的除去。用
的除去。用 溶液吸收
溶液吸收 生成
生成 。
。 被
被 氧化使
氧化使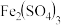 再生,其原理为:
再生,其原理为: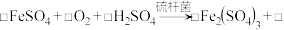 _______
_______(1)硫杆菌存在时,
 被氧化的速率是无菌时的
被氧化的速率是无菌时的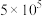 倍。由图1和图2判断,使用硫杆菌的最佳条件为
倍。由图1和图2判断,使用硫杆菌的最佳条件为
(2)补全、配平
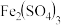 再生的化学方程式,并标出电子转移的数目和方向
再生的化学方程式,并标出电子转移的数目和方向(3)在一定条件下,也可以用
 氧化
氧化 ,其氧化产物随参加反应的
,其氧化产物随参加反应的 变化而不同。当
变化而不同。当 =4时,氧化产物的化学式为
=4时,氧化产物的化学式为Ⅱ.
 的除去。用NaOH溶液吸收
的除去。用NaOH溶液吸收 ,并用CaO使NaOH再生:NaOH溶液
,并用CaO使NaOH再生:NaOH溶液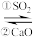
 溶液
溶液(1)写出过程①的离子方程式:
(2)CaO在水中存在如下转化:
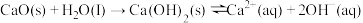 。从平衡移动的角度,简述过程②NaOH再生的原理
。从平衡移动的角度,简述过程②NaOH再生的原理(3)也可用氨水除去
 。某废气含0.2%
。某废气含0.2% 和10%
和10% (体积含量,其余为
(体积含量,其余为 ),一定条件下,该废气以
),一定条件下,该废气以 的速率通过催化剂与速率为20 L/h的
的速率通过催化剂与速率为20 L/h的 混合,再喷水,得到
混合,再喷水,得到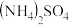 晶体(气体体积均已折算为标准状况)。通过计算说明
晶体(气体体积均已折算为标准状况)。通过计算说明 速率控制在20L/h的原因
速率控制在20L/h的原因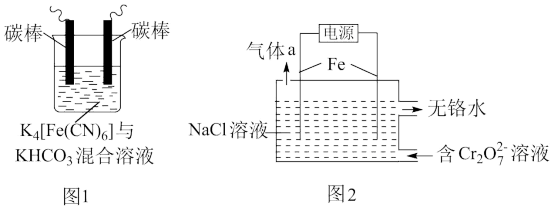
(1)用铁的化合物除硫化氢:2[Fe(CN)6]3-+ 2
 +HS- =2[Fe(CN)6]4-+ 2
+HS- =2[Fe(CN)6]4-+ 2 +S↓,可通过图1使[Fe(CN)6]3-再生,电解时,阳极的电极反应式为
+S↓,可通过图1使[Fe(CN)6]3-再生,电解时,阳极的电极反应式为(2)以铁为电极电解除铬,如图2
已知:
 + H2O=2
+ H2O=2 +2H+
+2H+氧化性:
 >
>
①电解过程中主要反应之一:
 +6Fe2++17H2O= 2Cr(OH)3↓+6Fe(OH)3↓+10H+;气体a主要成分是
+6Fe2++17H2O= 2Cr(OH)3↓+6Fe(OH)3↓+10H+;气体a主要成分是②电解过程中,不同pH时,通电时间与Cr元素的去除率关系如图3所示,pH=10相比pH=4,Cr元素的去除率偏低的原因可能是
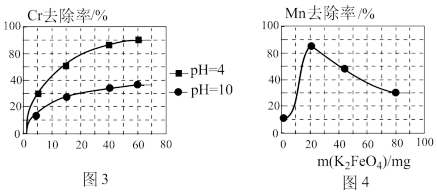
(3)高铁酸钾(K2FeO4)除锰
已知:K2FeO4具有强氧化性,极易溶于水
①在酸性条件下,能与废水中的Mn2+反应生成Fe(OH)3和MnO2沉淀来除锰,该反应的离子方程式
②用K2FeO4处理1L 50 mg/L的含Mn2+废水,Mn元素的去除率与K2FeO4量的关系如图4所示,当K2FeO4超过20 mg时,Mn元素的去除率下降的原因可能是
(1)理论上可采用加热使NO分解的方法处理:
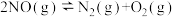 ,反应的部分数据如下表:
,反应的部分数据如下表:项目 |
|
| 正反应活化能 | 逆反应活化能 |
数据/ | a | b | 728 | 910 |
通过计算得出高于7089℃时反应无法自发进行,试判断b
(2)科学家发现活性炭表面的有机结构可以被强氧化剂氧化成酚羟基、羧基(均可表示为C—OH,其电离平衡可表示为
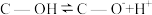 ),这些官能团可以使活性炭表面活性化,有利于NO的吸附。不同氧化剂的预氧化与吸附原理可表示为(未配平):
),这些官能团可以使活性炭表面活性化,有利于NO的吸附。不同氧化剂的预氧化与吸附原理可表示为(未配平):预氧化:
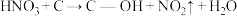
预氧化:

预氧化:

吸附:
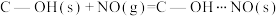
NO吸附实验分别在25℃和55℃下进行,将一定比例的
 与NO混合气体在10 MPa恒压下,以相同速率持续通入到等量的、不同预氧化试剂处理的活性炭中(图象中“原始-C”表示未经处理的活性炭),获得两个温度下“NO捕获率-通气时间”的变化图:
与NO混合气体在10 MPa恒压下,以相同速率持续通入到等量的、不同预氧化试剂处理的活性炭中(图象中“原始-C”表示未经处理的活性炭),获得两个温度下“NO捕获率-通气时间”的变化图: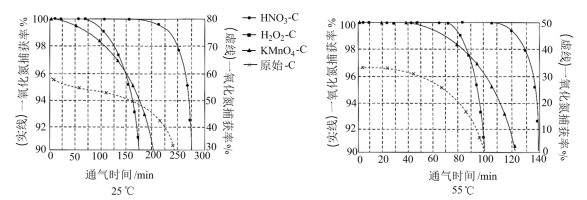
已知:NO捕获率=

请回答:
①下列描述正确的是
A.25℃下原始-C在通气约175分钟后吸附效果超过了
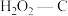
B.若其他条件不变,增大混合气体中
 物质的量分数,吸附平衡会逆向移动
物质的量分数,吸附平衡会逆向移动C.
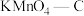 在实验中吸附效果不佳,可能是活性炭表面孔隙被堵塞
在实验中吸附效果不佳,可能是活性炭表面孔隙被堵塞D.由图象可知升温有利于吸附平衡正向移动,故吸附过程的

②其他条件不变,55℃下增大烟气中水蒸气含量后,
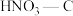 的NO捕获率会迅速降低,通气1小时后为40%,70 min后吸附到达平衡。请在对应图象中用虚线画出通气1小时后至吸附平衡为止NO捕获率的变化曲线
的NO捕获率会迅速降低,通气1小时后为40%,70 min后吸附到达平衡。请在对应图象中用虚线画出通气1小时后至吸附平衡为止NO捕获率的变化曲线③相比其他预氧化试剂处理的活性炭,
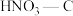 吸附效果更佳,有研究者认为可能是
吸附效果更佳,有研究者认为可能是 引入了
引入了 ,增强了活性炭的表面活性。试利用勒夏特列原理予以解释
,增强了活性炭的表面活性。试利用勒夏特列原理予以解释 CH3OH(g)+H2O(g)。下列有关说法不正确的是
CH3OH(g)+H2O(g)。下列有关说法不正确的是| A.恒温恒容下,该反应达到平衡时,各物质的物质的量分别为1mol、3mol、1mol和1mol,若此时各物质的物质的量分别增加1mol,平衡正向移动。 |
| B.恒温恒压下,该反应达到平衡时,各物质的物质的量分别为1mol、1mol、1mol和1mol,若此时通入12molCO2,平衡正向移动 |
| C.恒温恒容下,先向容器中加入1molCO2,再慢慢通入H2,发生反应,CH3OH的平衡物质的量逐渐增加 |
| D.恒温恒容下,先向容器中加入1molCO2,再慢慢通入H2,发生反应,CH3OH的平衡体积分数先增大后减小 |