1 . 氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理和化学平衡对于消除环境污染有重要意义。
(1)NO在空气中存在如下反应:2NO(g)+O2(g) 2NO2(g)ΔH。上述反应分两步完成,其反应历程如图所示。
2NO2(g)ΔH。上述反应分两步完成,其反应历程如图所示。

请回答下列问题:
①写出反应II的热化学方程式
②反应I和反应II中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g) 2NO2(g)反应速率的是
2NO2(g)反应速率的是
(2)用活性炭还原法处理氮氧化物的有关反应为:C(s)+2NO(g) N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及12min和15min时各物质的平衡浓度如表所示:
N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及12min和15min时各物质的平衡浓度如表所示:
浓度(mol·L-1) 时间(min) | NO | CO2 | N2 |
0 | 0.200 | 0 | 0 |
12 | 0.050 | 0.075 | 0.075 |
15 | 0.100 | 0.050 | 0.450 |
①T℃时,该反应的平衡常数为
②在12min时,若只改变某一条件使平衡发生移动,15min时重新达到平衡,则改变的条件是
③在15min时,保持温度和容器体积不变再充入NO和N2,使NO、N2的浓度分别增加至原来的2倍4倍,此时反应v正
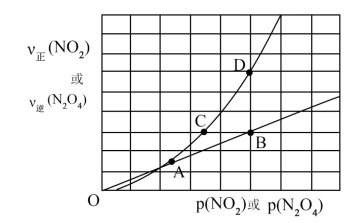
(3)NO2存在如下平衡:2NO2(g) N2O4(g)△H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系式:v正(NO2)=k1·P2(NO2),v逆(N2O4)=k2·P(N2O4),速率与分压关系如图所示。一定温度下,k1、k2与平衡常数Kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是Kp=
N2O4(g)△H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系式:v正(NO2)=k1·P2(NO2),v逆(N2O4)=k2·P(N2O4),速率与分压关系如图所示。一定温度下,k1、k2与平衡常数Kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是Kp=
①水溶液中,K2Cr2O7存在以下平衡:Cr2O
 +H2O
+H2O CrO
CrO +2H+,加入2-3滴NaOH溶液,溶液变黄
+2H+,加入2-3滴NaOH溶液,溶液变黄②探究温度对反应速率的影响:在两支试管中分别混合等体积、同浓度的Na2S2O3溶液和稀硫酸,一支放在热水中,另一支放在冰水中,观察出现浑浊的先后
③[Cu(H2O)4]2+(蓝色)+4C1-
 [CuCl4]2-(黄色)+4H2OΔH>0,升高温度,溶液由蓝色变成黄色
[CuCl4]2-(黄色)+4H2OΔH>0,升高温度,溶液由蓝色变成黄色④把装有NO2与N2O4混合气体的平衡球一端置于冷水,一端置于热水中,置于冷水中的颜色更深
⑤实验室用足量的Zn和稀硫酸反应制备H2,加入几滴CuSO4溶液,反应速率加快,产生H2的量不变
| A.②④⑤ | B.②③⑤ | C.①⑤ | D.①②④ |
(1)理论上可采用加热使NO分解的方法处理:
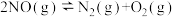 ,反应的部分数据如下表:
,反应的部分数据如下表:项目 |
|
| 正反应活化能 | 逆反应活化能 |
数据/ | a | b | 728 | 910 |
通过计算得出高于7089℃时反应无法自发进行,试判断b
(2)科学家发现活性炭表面的有机结构可以被强氧化剂氧化成酚羟基、羧基(均可表示为C—OH,其电离平衡可表示为
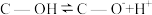 ),这些官能团可以使活性炭表面活性化,有利于NO的吸附。不同氧化剂的预氧化与吸附原理可表示为(未配平):
),这些官能团可以使活性炭表面活性化,有利于NO的吸附。不同氧化剂的预氧化与吸附原理可表示为(未配平):预氧化:
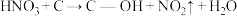
预氧化:

预氧化:

吸附:
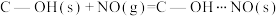
NO吸附实验分别在25℃和55℃下进行,将一定比例的
 与NO混合气体在10 MPa恒压下,以相同速率持续通入到等量的、不同预氧化试剂处理的活性炭中(图象中“原始-C”表示未经处理的活性炭),获得两个温度下“NO捕获率-通气时间”的变化图:
与NO混合气体在10 MPa恒压下,以相同速率持续通入到等量的、不同预氧化试剂处理的活性炭中(图象中“原始-C”表示未经处理的活性炭),获得两个温度下“NO捕获率-通气时间”的变化图: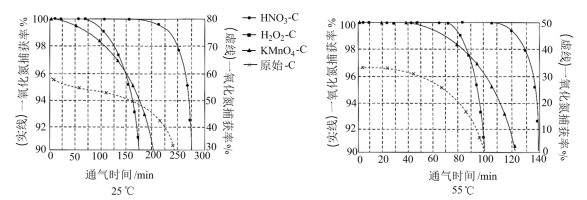
已知:NO捕获率=

请回答:
①下列描述正确的是
A.25℃下原始-C在通气约175分钟后吸附效果超过了
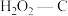
B.若其他条件不变,增大混合气体中
 物质的量分数,吸附平衡会逆向移动
物质的量分数,吸附平衡会逆向移动C.
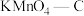 在实验中吸附效果不佳,可能是活性炭表面孔隙被堵塞
在实验中吸附效果不佳,可能是活性炭表面孔隙被堵塞D.由图象可知升温有利于吸附平衡正向移动,故吸附过程的

②其他条件不变,55℃下增大烟气中水蒸气含量后,
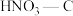 的NO捕获率会迅速降低,通气1小时后为40%,70 min后吸附到达平衡。请在对应图象中用虚线画出通气1小时后至吸附平衡为止NO捕获率的变化曲线
的NO捕获率会迅速降低,通气1小时后为40%,70 min后吸附到达平衡。请在对应图象中用虚线画出通气1小时后至吸附平衡为止NO捕获率的变化曲线③相比其他预氧化试剂处理的活性炭,
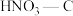 吸附效果更佳,有研究者认为可能是
吸附效果更佳,有研究者认为可能是 引入了
引入了 ,增强了活性炭的表面活性。试利用勒夏特列原理予以解释
,增强了活性炭的表面活性。试利用勒夏特列原理予以解释 呈黄色,Cr2O
呈黄色,Cr2O 呈橙色,重铬酸钾(K2Cr2O7)在水溶液中存在以下平衡:Cr2O
呈橙色,重铬酸钾(K2Cr2O7)在水溶液中存在以下平衡:Cr2O +H2O
+H2O 2CrO
2CrO +2H+,下列说法正确的是( )
+2H+,下列说法正确的是( )| A.向该溶液中滴加适量的NaHSO4固体,平衡向逆反应方向移动,再次达到平衡后,氢离子浓度比原溶液大 |
| B.该反应是氧化还原反应 |
| C.向该溶液中加入过量浓NaOH溶液后,溶液呈橙色 |
| D.向体系中加入少量水,平衡逆向移动 |
方法I:先用氨水将SO2转化为NH4HSO3,再通入空气氧化成(NH4)2SO4。
方法II:用Na2SO3溶液吸收SO2,再经电解转化为H2SO4。
据此回答以下问题:
(1)方法I中发生氧化还原反应的离子方程式
A.增大氨水浓度 B.增大燃煤烟气的流速
C.事先去除燃煤烟气中的二氧化碳 D.增大压强
(2)采用方法II脱硫,燃煤烟气中的二氧化碳能否与生成的NaHSO3溶液反应
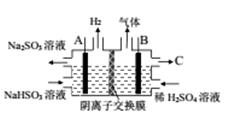
| 试管中试剂 | 实验 | 滴加试剂 | 现象 |
 | I | i.先加1mL0.1mol/LFeSO4溶液 ii.再加硫酸酸化的KMnO4溶液 | i.无明显现象 ii.先变红,后褪色 |
II | iii.先加1 mL 0.05 mol/LFe2(SO4)3溶液 iv.再滴加0.5 mL 0.5 mol/L FeSO4溶液 | iii.溶液变红 iv.红色明显变浅 |
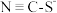 和S=C=N-,SCN-是二者的互变异构的混合物,请写出S=C=N-的电子式
和S=C=N-,SCN-是二者的互变异构的混合物,请写出S=C=N-的电子式(2)①用离子方程式表示实验I溶液变红的原因
②针对实验I中红色褪去的原因,小组同学认为是SCN-被酸性KMnO4氧化为SO
 ,并设计如图实验装置证实了猜想是成立的。其中电解质溶液中的离子交换膜是
,并设计如图实验装置证实了猜想是成立的。其中电解质溶液中的离子交换膜是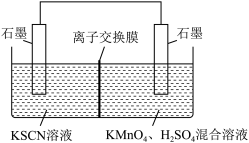
(3)针对实验II“红色明显变浅”的现象,实验小组进行探究。
甲同学认为SCN-可以与Fe2+反应生成无色络合离子,进一步使Fe3++SCN⇌[Fe(SCN)]2+平衡左移,红色明显变浅,而Zn2+与SCN-不络合,于是甲设计了如下实验:
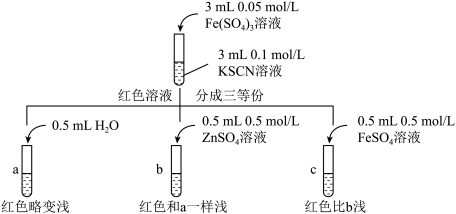
由此推测,实验II“红色明显变浅”的原因是
(4)工业上测定钛铁合金中钛含量的其中一步反应原理是:以KSCN为指示剂,用NH4Fe(SO4)2标准溶液滴定Ti(III),反应的化学方程式为Ti2(SO4)3+2NH4Fe(SO4)2=2Ti(SO4)2+(NH4)2SO4+2FeSO4,则达到滴定终点的实验现象是
 呈粉红色,
呈粉红色, 呈蓝色,
呈蓝色,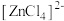 为无色。现将CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:
为无色。现将CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡: ,用该溶液做实验,溶液的颜色变化如下:
,用该溶液做实验,溶液的颜色变化如下:
A.等物质的量的 和 和 中σ键数之比为3:2 中σ键数之比为3:2 |
| B.由实验①可推知△H<0 |
| C.实验②是由于c(H2O)增大,导致平衡逆向移动 |
D.由实验③可知配离子的稳定性: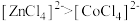 |
(1)研究人员利用含硫物质热化学循环实现太阳能的转化与存储,过程如下:
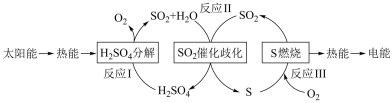
①反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ•mol -1
反应Ⅲ:S(s)+O2(g) = SO2(g) ΔH3=-297 kJ•mol -1
反应Ⅱ的热化学方程式为
②对于反应Ⅱ,将投料比【n(SO2):n(H2O)】为 3:2 的混合气体充入恒容的密闭容器中, 在不同压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如下图所示。下列说法不正确的是

A.p2>p1,反应Ⅱ的ΔS < 0
B.使用合适催化剂可以提高 H2SO4在平衡体系中物质的量分数
C.其他条件相同时,投料比【n(SO2):n(H2O)】改变为 2:1,可提高 SO2的平衡转化率
D.当容器内气体的密度不变时,可判断反应达到平衡状态
E.温度升高,有利于反应速率加快,SO2的平衡转化率提高,K 值变小
(2)“硫碘循环”法是分解水制氢气的研究热点,涉及下列三个反应:
反应A:SO2(g) + I2(aq) + 2H2O(l) = 2HI(aq) + H2SO4(aq)
反应B:2HI(g) ⇌ H2(g) + I2(g)
反应C:2H2SO4(g) ⇌ 2H2O(g) + 2SO2(g) + O2(g)
①某温度下将 1mol HI 充入密闭容器中发生反应B,达到第 1 次平衡后,用选择性膜完全分离出 H2,达到第 2 次平衡后再次分离H2,重复多次,平衡时 n(HI)如下表:
| 达到平衡的次数 | 第 1 次 | 第 2 次 | 第 3 次 | 第 4 次 | 第 5 次 | …… |
| n(HI)/mol | 0.78 | 0.67 | 0.60 | 0.55 | 0.51 | …… |
归纳出分离 H2的次数对 HI 转化率的影响
②反应 A 发生时,溶液中同时存在以下化学平衡: I2(aq) + I‑(aq)⇌
 (aq),其反应速率极快且平衡常数很大。现将 1mol SO2缓缓通入含 1 mol I2的水溶液中恰好完全反应。请在下图中画出溶液中
(aq),其反应速率极快且平衡常数很大。现将 1mol SO2缓缓通入含 1 mol I2的水溶液中恰好完全反应。请在下图中画出溶液中 的物质的量 n( I3- )随反应时间 t 变化的曲线图
的物质的量 n( I3- )随反应时间 t 变化的曲线图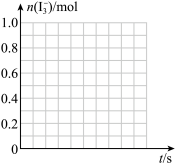
 2CO(g)+2H2(g);ΔH1,
2CO(g)+2H2(g);ΔH1,主要副反应:(Ⅱ)H2(g)+CO2(g)
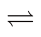 CO(g)+H2O(g);ΔH2>0,
CO(g)+H2O(g);ΔH2>0,(Ⅲ)4H2(g)+CO2(g)
 CH4(g)+2H2O(g);ΔH3<0。
CH4(g)+2H2O(g);ΔH3<0。在恒容反应器中按体积分数V(CH4)∶V(CO2)=50%∶50%充入气体,加入催化剂,测得反应器中平衡时各物质的体积分数与温度的关系如图所示。下列说法正确的是( )
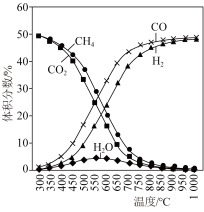
| A.ΔH1=2ΔH2-ΔH3<0 |
| B.其他条件不变,适当增大起始时V(CH4)∶V(CO2),可抑制副反应(Ⅱ)、(Ⅲ)的进行 |
| C.300~580℃时,H2O的体积分数不断增大,是由于反应(Ⅲ)生成H2O的量大于反应(Ⅱ)消耗的量 |
| D.T℃时,在2.0L容器中加入2mol CH4、2mol CO2以及催化剂进行重整反应,测得CO2的平衡转化率为75%,则反应(Ⅰ)的平衡常数小于81 |
 常用于飞机发动机、宇航船舱骨架、导弹、军舰的水翼等。钒精矿可表示为
常用于飞机发动机、宇航船舱骨架、导弹、军舰的水翼等。钒精矿可表示为 ,还含有其他难溶硫酸盐杂质。“萃取”钒工艺流程路线图如下:
,还含有其他难溶硫酸盐杂质。“萃取”钒工艺流程路线图如下: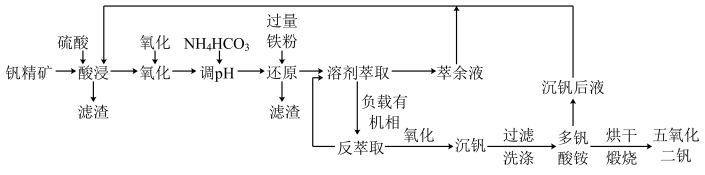
已知:①
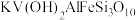 中
中 为
为 价。
价。②“氧化”后的溶液中钒以
 存在,反萃取后的溶液中钒以
存在,反萃取后的溶液中钒以 存在。
存在。③
 为萃取剂。
为萃取剂。回答下列问题:
(1)将钒精矿
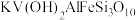 写成氧化物的形式
写成氧化物的形式(2)写出“氧化”过程中反应的离子方程式
(3)加入
 调节溶液
调节溶液 的目的是
的目的是(4)“还原”过程中主要反应的离子反应方程式为
(5)为了提高
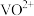 的产率,反萃取剂应该呈
的产率,反萃取剂应该呈(6)若用氧化剂
 “氧化沉钒”时,生成
“氧化沉钒”时,生成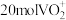 ,至少需要
,至少需要
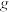 。
。(7)写出煅烧多钒酸铵
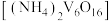 的化学反应方程式
的化学反应方程式





