①

 kJ⋅mol-1
kJ⋅mol-1②


副反应:
 ,
,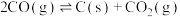 ,
,
Ⅰ.已知:
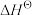 为标准摩尔生成焓,其定义为标准状态下,由稳定相态的单质生成1 mol该物质的焓变。对于稳定相态单质,其
为标准摩尔生成焓,其定义为标准状态下,由稳定相态的单质生成1 mol该物质的焓变。对于稳定相态单质,其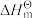 为零。
为零。例如C(石墨)

 kJ·mol-1,则
kJ·mol-1,则 的标准生成焓为-393.5 kJ⋅mol-1。
的标准生成焓为-393.5 kJ⋅mol-1。| 物质 |  |  | CO |
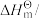 /kJ⋅mol-1 /kJ⋅mol-1 | -285.8 | -393.5 | -110.5 |

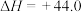 kJ⋅mol-1,结合表中数据计算反应
kJ⋅mol-1,结合表中数据计算反应
(2)在镍催化剂表面甲烷和水蒸气发生反应,最后生成CO、
 和
和 ,反应机理如下,请补充其中的两个反应方程式(Z表示催化剂的活性中心)。
,反应机理如下,请补充其中的两个反应方程式(Z表示催化剂的活性中心)。a.
 ;
; b.
c.
 ;
;d.
e.
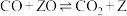
Ⅱ.在一体积可变的密闭容器中,投入一定量的
 和
和 发生甲烷水蒸气重整反应。
发生甲烷水蒸气重整反应。(3)下列有关说法正确的是___________。
A. 浓度不变,说明体系已达平衡状态 浓度不变,说明体系已达平衡状态 |
| B.反应②前后气体物质的量不变,所以此反应熵变为0 |
C.在催化剂表面, 、 、 分子中的化学键被削弱 分子中的化学键被削弱 |
D.在体系中通入适量的 ,有利于减少积碳,从而有利于反应进行 ,有利于减少积碳,从而有利于反应进行 |
 、
、 、CO、
、CO、 的体积分数分别为a、b、c、d,反应①的平衡常数
的体积分数分别为a、b、c、d,反应①的平衡常数
 (用含字母的式子表示。
(用含字母的式子表示。 是以分压表示的平衡常数,分压=总压×体积分数)。
是以分压表示的平衡常数,分压=总压×体积分数)。(5)500℃时,反应相同时间后测得
 的转化率随压强的变化如图所示。则图中E点和G点CH4的浓度大小关系为c(E)
的转化率随压强的变化如图所示。则图中E点和G点CH4的浓度大小关系为c(E)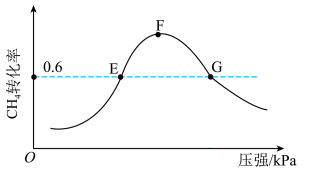
(6)通过甲烷水蒸气重整反应的平衡含量计算,以及析碳条件的判断,该转化需适当增大水碳比[
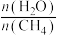 ],请分析可能的原因:
],请分析可能的原因: -
- 干重整技术(简称“DRM技术”)在转化利用
干重整技术(简称“DRM技术”)在转化利用 的同时可以大量利用
的同时可以大量利用 ,从而成为一项“绿色”的化工技术而受到科研人员的广泛关注。该过程中涉及的反应如下:
,从而成为一项“绿色”的化工技术而受到科研人员的广泛关注。该过程中涉及的反应如下:主反应:


副反应:


回答下列问题:
(1)已知
 、CO和
、CO和 的燃烧热分别为-890.3kJ/mol、-283.0kJ/mol和-285.8kJ/mol,DRM技术主反应的
的燃烧热分别为-890.3kJ/mol、-283.0kJ/mol和-285.8kJ/mol,DRM技术主反应的
(2)在刚性密闭容器中,反应达到平衡状态时
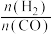 随温度变化的关系如图甲所示,随着进料比
随温度变化的关系如图甲所示,随着进料比 的增加,
的增加,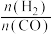 值的变化趋势及原因是
值的变化趋势及原因是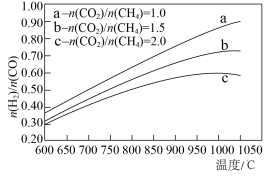
(3)在1000℃、压强为P时,按投料比
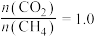 加入刚性密闭容器中,达平衡时甲烷的转化率为80%,二氧化碳的转化率为90%,则反应前后气体的总物质的量之比为
加入刚性密闭容器中,达平衡时甲烷的转化率为80%,二氧化碳的转化率为90%,则反应前后气体的总物质的量之比为
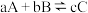 达到化学平衡时,
达到化学平衡时, )
)(4)DRM技术主反应的催化转化原理的如图乙所示:
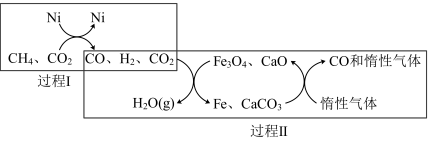
①过程Ⅱ实现了含氢物种与含碳物种的分离。生成
 (g)的化学方程式是
(g)的化学方程式是②过程Ⅱ的催化剂是

(1)已知4.4kg CO2与足量H2恰好完全反应,生成气态的水和气态的甲醇,可放出4947kJ的热量,试写出该反应的热化学方程式
(2) 一定条件下,往2L恒容密闭容器中充入1mol CO2和3 mol H2在不同催化剂作用下发生反应I、反应II与反应Ⅲ,相同时间内CO2的转化率随温度变化如图(图中c点的转化率为66.67%,即转化了2/3)所示:
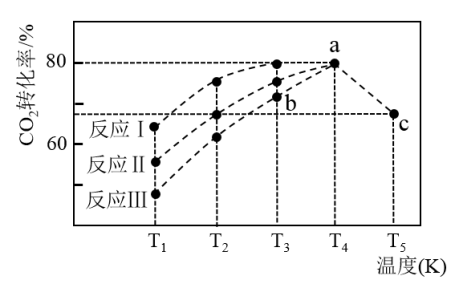
①催化剂效果最佳的反应是
②b点v(正)
③若此反应在a点时已达平衡状态,a点的转化率比c点高的原因是
A.CO2的浓度减小 B.正反应速率增大,逆反应速率减小
C.CO2和H2的体积比为1:3 D. CH3OH的体积分数增大
④c点时该反应的平衡常数K =
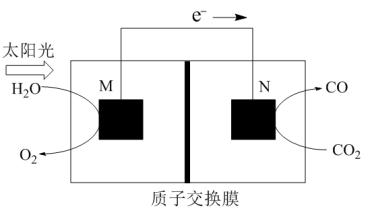
(3)科学家还研究了其它转化温室气体的方法,利用如图所示装置可以将CO2转化为气体燃料CO。该装置工作时,N电极的电极反应式为
4 . 氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理和化学平衡对于消除环境污染有重要意义。
(1)NO在空气中存在如下反应:2NO(g)+O2(g) 2NO2(g)ΔH。上述反应分两步完成,其反应历程如图所示。
2NO2(g)ΔH。上述反应分两步完成,其反应历程如图所示。

请回答下列问题:
①写出反应II的热化学方程式
②反应I和反应II中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g) 2NO2(g)反应速率的是
2NO2(g)反应速率的是
(2)用活性炭还原法处理氮氧化物的有关反应为:C(s)+2NO(g) N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及12min和15min时各物质的平衡浓度如表所示:
N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及12min和15min时各物质的平衡浓度如表所示:
浓度(mol·L-1) 时间(min) | NO | CO2 | N2 |
0 | 0.200 | 0 | 0 |
12 | 0.050 | 0.075 | 0.075 |
15 | 0.100 | 0.050 | 0.450 |
①T℃时,该反应的平衡常数为
②在12min时,若只改变某一条件使平衡发生移动,15min时重新达到平衡,则改变的条件是
③在15min时,保持温度和容器体积不变再充入NO和N2,使NO、N2的浓度分别增加至原来的2倍4倍,此时反应v正
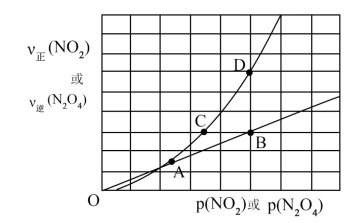
(3)NO2存在如下平衡:2NO2(g) N2O4(g)△H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系式:v正(NO2)=k1·P2(NO2),v逆(N2O4)=k2·P(N2O4),速率与分压关系如图所示。一定温度下,k1、k2与平衡常数Kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是Kp=
N2O4(g)△H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系式:v正(NO2)=k1·P2(NO2),v逆(N2O4)=k2·P(N2O4),速率与分压关系如图所示。一定温度下,k1、k2与平衡常数Kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是Kp=

已知:萃取Co2+的反应原理:Co2++2HR(有机磷)
 CoR2+2H+。下列说法错误的是
CoR2+2H+。下列说法错误的是| A.“滤液Ⅰ”中溶质的主要成分是Na[Al(OH)4] |
| B.“酸溶”中H2O2的作用是将Co2+氧化为Co3+ |
| C.“反萃取”中可加入H2SO4分离出Co2+ |
| D.“沉钴”时增大Na2CO3溶液的浓度或滴加速率,能够提高产品的纯度 |

下列说法不正确的是
A.由图1可知,Cl2溶于NaCl溶液时还发生了反应Cl2+Cl-=Cl |
| B.随NaCl溶液浓度增大,Cl2+H2O⇌H++Cl-+HClO平衡逆移,Cl2溶解度减小 |
C.随盐酸浓度增加Cl2与H2O的反应被抑制,生成Cl 为主要反应从而促进Cl2溶解 为主要反应从而促进Cl2溶解 |
| D.由上述实验可知,H+浓度增大促进Cl2溶解,由此推知在稀硫酸中,随硫酸浓度增大Cl2的溶解度会增大 |
(1)不同pH时,该含砷废水中各种含砷微粒的物质的量分数如下图所示:

①H3AsO3为
②“调pH”时,控制溶液的pH=6,“沉砷”时会生成As2S3沉淀。写出“沉砷”时反应的离子方程式:
(2)已知As2S3与过量的S2-存在反应:As2S3(s)+3S2-(aq)
 2AsS
2AsS (aq),则“沉砷"中加入FeSO4的作用是
(aq),则“沉砷"中加入FeSO4的作用是(3)“氧化”步骤除了可以加入氧化剂,还可通过电解反应将有毒的AsO
 可转化为无毒的AsO
可转化为无毒的AsO 。用石墨为电极,在强碱性溶液中电解含AsO
。用石墨为电极,在强碱性溶液中电解含AsO 的溶液,阳极的电极反应式为
的溶液,阳极的电极反应式为(4)加H2SO4调节pH=0时,由Na3AsO4制备As2O3的离子方程式为
(5)已知As2O3在不同温度和不同浓度硫酸中的溶解度(S)曲线如图所示,为了提高As2O3的沉淀率,“一系列操作”过程中,冷却结晶时应控制的条件为

 是常用的氮氧化物
是常用的氮氧化物 的净化方法,原理是用
的净化方法,原理是用 在特定催化剂作用下将
在特定催化剂作用下将 ,还原为
,还原为 .
.反应Ⅰ:

反应Ⅱ:
(1)反应Ⅱ
 的净化;一定温度和压强下,为了提高
的净化;一定温度和压强下,为了提高 的净化速率,可采取的最合理的措施是
的净化速率,可采取的最合理的措施是(2)
 是
是 催化剂的活性组分.在反应器中以一定流速通过烟气
催化剂的活性组分.在反应器中以一定流速通过烟气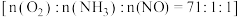 ,在不同温度下进行该催化还原反应,
,在不同温度下进行该催化还原反应, 的质量分数对单位时间内
的质量分数对单位时间内 去除率的影响如图所示.
去除率的影响如图所示.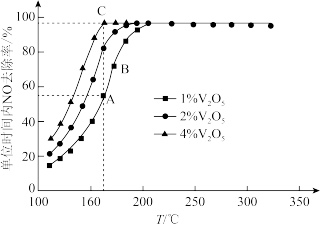
①下列说法中正确的是
A.该催化剂能加快反应速率,但不能改变反应的焓变
B.状态A时保持其他条件不变减小压强,能增大单位时间
 的去除率
的去除率C.状态B时选择合适催化剂,可以提高相同时间内
 的去除率
的去除率D.
 的质量分数越高,催化剂的活性越好
的质量分数越高,催化剂的活性越好E.该催化剂具有选择性,能降低特定反应的活化能
②从起始至对应A、B、C三点的平均反应速率由大到小的顺序为
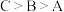 ,原因是
,原因是③若烟气中
 含量一定,在催化剂适宜温度范围内,当
含量一定,在催化剂适宜温度范围内,当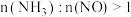 时,随着该比值的增大,
时,随着该比值的增大, 去除率无明显变化,可能的原因是
去除率无明显变化,可能的原因是(3)一定温度下,向
 密闭刚性容器(含催化剂)中投入
密闭刚性容器(含催化剂)中投入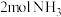 和
和 ,发生反应
,发生反应 .达到平衡状态时,
.达到平衡状态时, 的转化率为60%,此时再加入
的转化率为60%,此时再加入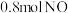 和
和 ,则反应速率
,则反应速率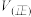
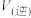 (填“大于”、“小于”、“等于”).
(填“大于”、“小于”、“等于”).
(1)银的浸出
I.两步法:

已知:i.
 溶液与
溶液与 溶液直接混合能发生氧化还原反应;
溶液直接混合能发生氧化还原反应;ii.
 ,
,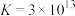 。
。①
 溶液将胶片上的单质银转化为
溶液将胶片上的单质银转化为 ,其离子方程式是
,其离子方程式是②
 溶液能溶解
溶液能溶解 并得到含
并得到含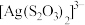 的浸出液。结合平衡移动原理解释
的浸出液。结合平衡移动原理解释 溶解的原因:
溶解的原因:II.一步法:用水溶解
 和乙二胺四乙酸二钠(用
和乙二胺四乙酸二钠(用 表示)的混合固体,调节
表示)的混合固体,调节 形成
形成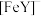 溶液,再加入一定量
溶液,再加入一定量 ,配成浸取液。将废感光胶片浸入浸取液中,发生反应:
,配成浸取液。将废感光胶片浸入浸取液中,发生反应: 。
。③从物质氧化性或还原性的角度分析加入
 的作用:
的作用:(2)银的还原
调节(1)所得浸出液的
 ,向其中加入
,向其中加入 溶液(B的化合价为
溶液(B的化合价为 )至不再产生黑色沉淀,过滤得到粗银;滤液中的
)至不再产生黑色沉淀,过滤得到粗银;滤液中的 可以循环使用。补全离子方程式:
可以循环使用。补全离子方程式: ,
,(3)银浸出率的测定
称取m1g洗净干燥的原胶片,灼烧灰化后用
 溶解,过滤。滤液用
溶解,过滤。滤液用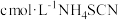 标准溶液滴定至终点,消耗标准溶液V1mL。另取m2g洗净干燥的浸取后胶片,用同样方法处理,滴定,消耗
标准溶液滴定至终点,消耗标准溶液V1mL。另取m2g洗净干燥的浸取后胶片,用同样方法处理,滴定,消耗 标准溶液V2mL。(已知:
标准溶液V2mL。(已知: )
)①银的浸出率

②实验发现在浸取试剂均过量、浸取时间足够长的情况下,与II相比,I中银的浸出率明显偏低,其原因可能是
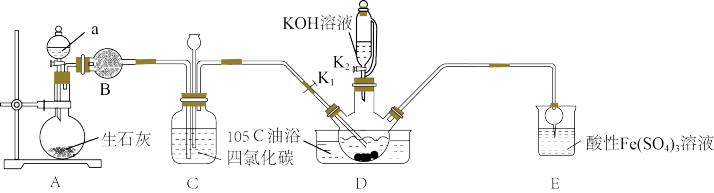
已知:①
 不溶于
不溶于 和
和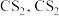 不溶于水且密度比水大;
不溶于水且密度比水大;②D中三颈烧瓶内盛放
 、水和催化剂,发生反应
、水和催化剂,发生反应 ,该反应比较缓慢且
,该反应比较缓慢且 在高于170℃时易分解,
在高于170℃时易分解, 在高于25℃时即分解。
在高于25℃时即分解。回答下列问题:
(1)试剂a是
(2)制备KSCN溶液:将D中反应混合液加热至105℃,打开K1通入氨气。
①反应一段时间后,关闭K1,此时装置C中观察到的现象是保持三颈烧瓶内反应混合液温度为105℃一段时间,这样操作的目的是
②打开K2,缓缓滴入适量的KOH溶液,继续保持反应混合液温度为105℃。
(3)装置E中发生氧化还原反应的离子方程式是
(4)制备硫氰酸钾晶体:先滤去三颈烧瓶中的固体催化剂,再经
(5)取少量所得KSCN晶体配成溶液,将装置E中混合液过滤得溶液x,进行如下实验:

①设计实验探究ⅱ中银镜产生的原因
②小组同学观察到ⅲ中实验现象后,用力振荡试管,又观察到红色褪去和沉淀增多,请用必要的文字和离子方程式解释:



