1 . 过渡性金属元素在工业生产中有很重要的作用,如金属钼用于制火箭、卫星的合金构件,钼酸钠晶体(Na2MoO4·2H2O)是一种重要的金属缓蚀剂。某工厂利用钼精矿(主要成分MoS2,还含少量钙、镁等元素)为原料冶炼金属钼和钼酸钠晶体(Na2MoO4·2H2O)的主要流程图如下:_______ ,已知Rb(铷)质子数为37,在第五周期ⅠA,Mo的质子数为42,那么Mo在周期表中的位置为第五周期_______ 族。
(2)用浓氨水溶解粗产品的离子方程式是_______ ,由图中信息可以判断MoO3是_______ 氧化物。(填“酸性”、“碱性”或“两性”)
(3)操作Ⅰ是_______ ,操作Ⅱ所得的钼酸要水洗,检验钼酸是否洗涤干净的方法是_______ 。
(4)采用NaClO氧化钼矿的方法将矿石中的钼浸出,该过程放热。①请配平以下化学反应:_______ 。
_______NaClO+_______MoS2+_______NaOH→_______Na2MoO4+_______Na2SO4+_______NaCl+_______H2O
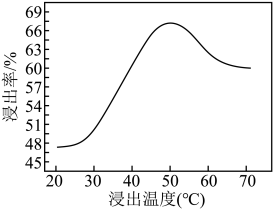
②钼的浸出率随着温度变化如图,当温度高于50℃后浸出率降低的可能原因是_______ (写一点)。 Lix(MoS2)n,则电池工作时正极上的电极反应式为
Lix(MoS2)n,则电池工作时正极上的电极反应式为_______ 。
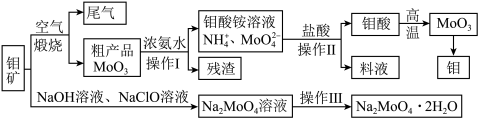
(2)用浓氨水溶解粗产品的离子方程式是
(3)操作Ⅰ是
(4)采用NaClO氧化钼矿的方法将矿石中的钼浸出,该过程放热。①请配平以下化学反应:
_______NaClO+_______MoS2+_______NaOH→_______Na2MoO4+_______Na2SO4+_______NaCl+_______H2O
②钼的浸出率随着温度变化如图,当温度高于50℃后浸出率降低的可能原因是
 Lix(MoS2)n,则电池工作时正极上的电极反应式为
Lix(MoS2)n,则电池工作时正极上的电极反应式为
您最近一年使用:0次
名校
解题方法
2 . 资源化利用CO2,不仅可以减少温室气体的排放,还可以获得燃料或重要的化工产品。
(1)CO2的捕集:
①CO2属于___________ 分子(填“极性”或“非极性”),其晶体(干冰)属于__________ 晶体。
②用饱和 溶液做吸收剂可“捕集”CO2。若所得溶液
溶液做吸收剂可“捕集”CO2。若所得溶液 ,溶液中c(HCO
,溶液中c(HCO ):c(CO
):c(CO )=
)=_______ ;(室温下, 的K1=4×10-7;K2=5×10-11)若吸收剂失效,可利用NaOH溶液使其再生,写出该反应的离子方程式
的K1=4×10-7;K2=5×10-11)若吸收剂失效,可利用NaOH溶液使其再生,写出该反应的离子方程式_____ 。
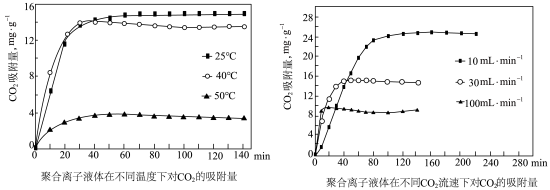
③聚合离子液体是目前广泛研究的CO2吸附剂。结合下图 分析聚合离子液体吸附CO2的有利条件是____________ 。
(2)生产尿素:工业上以CO2、 为原料生产尿素[CO(NH2)2],该反应分为二步进行:
为原料生产尿素[CO(NH2)2],该反应分为二步进行:
第一步: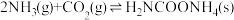
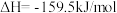
第二步:
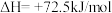
写出上述合成尿素的热化学方程式_______ 。
(3)合成乙酸:中国科学家首次以 、CO2和H2为原料高效合成乙酸,其反应路径如图所示:
、CO2和H2为原料高效合成乙酸,其反应路径如图所示:
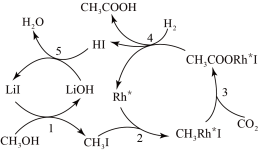
①原料中的 可通过电解法由
可通过电解法由 制取,用稀硫酸作电解质溶液,写出生成
制取,用稀硫酸作电解质溶液,写出生成 的电极反应式:
的电极反应式:____________ 。
②根据图示 ,写出总反应的化学方程式:_______ 。
(1)CO2的捕集:
①CO2属于
②用饱和
 溶液做吸收剂可“捕集”CO2。若所得溶液
溶液做吸收剂可“捕集”CO2。若所得溶液 ,溶液中c(HCO
,溶液中c(HCO ):c(CO
):c(CO )=
)= 的K1=4×10-7;K2=5×10-11)若吸收剂失效,可利用NaOH溶液使其再生,写出该反应的离子方程式
的K1=4×10-7;K2=5×10-11)若吸收剂失效,可利用NaOH溶液使其再生,写出该反应的离子方程式③聚合离子液体是目前广泛研究的CO2吸附剂。

(2)生产尿素:工业上以CO2、
 为原料生产尿素[CO(NH2)2],该反应分为二步进行:
为原料生产尿素[CO(NH2)2],该反应分为二步进行:第一步:
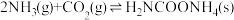
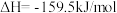
第二步:

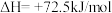
写出上述合成尿素的热化学方程式
(3)合成乙酸:中国科学家首次以
 、CO2和H2为原料高效合成乙酸,其反应路径如图所示:
、CO2和H2为原料高效合成乙酸,其反应路径如图所示:
①原料中的
 可通过电解法由
可通过电解法由 制取,用稀硫酸作电解质溶液,写出生成
制取,用稀硫酸作电解质溶液,写出生成 的电极反应式:
的电极反应式:②
您最近一年使用:0次
2024-04-04更新
|
362次组卷
|
3卷引用:天津市南开中学2020届高三一模化学试卷
名校
解题方法
3 . 向 和
和 混合溶液中滴加稀盐酸,
混合溶液中滴加稀盐酸, 的生成量与加入
的生成量与加入 盐酸的体积的关系如图所示。下列判断正确的是
盐酸的体积的关系如图所示。下列判断正确的是
 和
和 混合溶液中滴加稀盐酸,
混合溶液中滴加稀盐酸, 的生成量与加入
的生成量与加入 盐酸的体积的关系如图所示。下列判断正确的是
盐酸的体积的关系如图所示。下列判断正确的是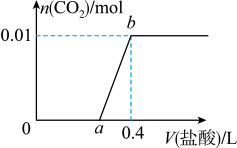
| A.在0-a范围内,只发生中和反应 |
B.ab段发生反应的离子方程式为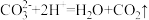 |
C. |
D.原混合溶液中 与Na2CO3的物质的量之比为 与Na2CO3的物质的量之比为 |
您最近一年使用:0次
2024-01-27更新
|
217次组卷
|
34卷引用:浙江省丽水外国语实验学校2020-2021学年高一上学期第三次月考化学试题
浙江省丽水外国语实验学校2020-2021学年高一上学期第三次月考化学试题福建省莆田二中2019-2020学年高一上学期期末检测化学试题浙江省诸暨市2016-2017学年高一上学期期末考试化学试题 浙江省诸暨市2017-2018学年高二下学期期末考试化学试题 浙江省部分重点中学普通高中2022届高三学业水平模拟考试化学试题青海省湟川中学2020-2021学年高一下学期开学考试化学试题新疆巴音郭楞蒙古自治州第二中学2021届高三上学期开学摸底考试化学试题浙江省宁波市效实中学2020-2021学年高一下学期期中考试化学(学考)试题重庆市秀山高级中学校2021-2022学年高三上学期9月月考化学试题山东省滨州市惠民县第二中学致远高中部2021-2022学年高三10月月考化学试题内蒙古自治区包钢第一中学2021-2022学年高三上学期10月月考化学试题(已下线)专题06 常见金属及其化合物-备战2022年高考化学学霸纠错(全国通用)黑龙江省鹤岗市第一中学2021-2022学年高一上学期期末考试化学试题江西省新余市2021-2022学年高一上学期期末考试化学试题江西省抚州市临川区第一中学2021-2022学年高一下学期第一次月考化学试题浙江省当湖高级中学2021-2022学年高一上学期12月阶段性测试化学试题浙江省宁波市六校2021-2022学年高一下学期期中联考化学试题黑龙江省哈尔滨市第七十三中学校2020-2021学年高二下学期期中考试化学试题(已下线)第06讲 钠及其化合物(练)-2023年高考化学一轮复习讲练测(新教材新高考)山东省枣庄市滕州市第一中学2022-2023学年高三上学期10月考试化学试题浙江省温州市瑞安市第六中学2021-2022学年高一下学期5月月考化学试题浙江省温州新力量联盟2022-2023学年高一上学期期中联考 化学试题上海市复兴高级中学2022-2023学年高三上学期10月月考化学试题浙江省绍兴鲁迅高级中学2021-2022学年高一上学期期中考试化学试题浙江省湖州市2022-2023学年高一上学期期末检测化学试题(已下线)第三章 金属及其化合物 第12练 Na2CO3、NaHCO3碱金属(已下线)浙江省柯桥中学2023-2024学年高一上学期期中检测化学试题 河北省石家庄市第四十二中学2023-2024学年高一上学期第二次月考化学试题 安徽省合肥市第一中学2023-2024学年高一上学期素质拓展训练(四)化学试题浙江省杭州第十一中学2023-2024学年高一上学期期中考试化学试题15-2023新东方高一上期中考化学12-2023新东方高二上期中考化学12陕西省西安市周至县第六中学2023-2024学年高三上学期11月期中化学试题浙江省湖州市南浔高级中学2023-2024学年高一上学期十二月月考化学试题
名校
解题方法
4 . 相对分子质量为Mr的气态化合物V L(标准状况)溶于m g水中,得到溶液的质量分数为w%,物质的量浓度为c mol·L-1,密度为ρ g·cm-3,则下列说法正确的是
A.溶液密度ρ可表示为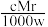 | B.物质的量浓度c可表示为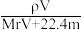 |
C.溶液的质量分数w%可表示为 | D.相对分子质量Mr可表示为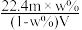 |
您最近一年使用:0次
2023-10-29更新
|
1150次组卷
|
42卷引用:2015-2016学年黑龙江铁人中学高一上第一阶段测化学卷
2015-2016学年黑龙江铁人中学高一上第一阶段测化学卷(已下线)2018年9月16日《每日一题》人教必修1- 每周一测湖南省长沙市周南梅溪湖中学2018-2019学年高一下学期一模检测化学试题【全国百强校】四川省成都市石室中学2018-2019学年高一上学期10月月考化学试题广东省揭阳市惠来县第一中学2018-2019学年高一上学期期中考试化学试题辽宁省抚顺市第一中学2020届高三上学期期中考试化学试题人教版高一化学必修1第一章—第三章综合测试题江西省南昌市新建区第一中学2019—2020学年高一上学期第一次月考化学试题鲁科版高中化学必修1第一章《认识化学科学》测试卷云南省丽江市华坪县第一中学2019—2020学年高一上学期期末考试化学试题云南省昭通市绥江县二中2019-2020学年高一上学期期末考试化学试题河北省沧州市第一中学2019-2020学年高二4月月考化学试题(已下线)【南昌新东方】2019 雷氏学校 高一上第一次月考(已下线)考点02 物质的量与阿伏加德罗常数-2020年高考化学命题预测与模拟试题分类精编江西省南昌市八一中学2019-2020学年高一下学期开学考试(5月)化学试题宁夏贺兰县景博中学2019-2020学年高一上学期第一次月考化学试题浙江省诸暨中学2019-2020学年高二下学期期中考试化学试题(已下线)【南昌新东方】4.进贤一中 田荣达江西省南昌新建一中2020-2021学年高一上学期第一次月考化学试题黑龙江省齐齐哈尔市讷河市拉哈一中2020-2021学年高一上学期12月月考化学试题江西省南昌市进贤县第一中学2020-2021学年高一上学期第一次月考化学试题河南省郑州市第一中学2020-2021学年高一上学期第一次月考化学试题山西省晋城市第一中学校2023-2024学年高三上学期第四次调研化学试题(已下线)课时12 物质的量浓度与溶液的配制-2022年高考化学一轮复习小题多维练(全国通用)陕西省周至县第四中学2021-2022学年高三上学期10月月考化学试题(已下线)考点02 化学用语和常用化学计量-备战2022年高考化学学霸纠错(全国通用)陕西省西安市第一中学2021-2022学年高一上学期10月月考化学试题湖北省荆州中学2021-2022学年高一上学期期末考试化学试题黑龙江省哈尔滨市第九中学校2022-2023学年高一上学期11月月考化学试题内蒙古鄂尔多斯市第一中学2022-2023 学年高一上学期期末考试化学试题湖北省部分重点中学2022-2023年高一上学期期末联合考试化学试题(已下线)第12讲 物质的量浓度的相关计算-【暑假自学课】2023年新高一化学暑假精品课(人教版2019必修第一册)(已下线)第2讲 物质的浓度及溶液配制黑龙江省哈尔滨师范大学附属中学2022-2023学年高三下学期开学考试化学试题黑龙江省哈尔滨师范大学附属中学2024届高三上学期开学考试化学试题湖南省部分学校2023-2024学年高三上学期第二次联考化学试题辽宁省东北育才学校科学高中部2023-2024学年高一上学期第一次月考化学试题山东省新泰市第一中学(实验部)2023-2024学年高一上学期第二次月考化学试题河北省石家庄二中实验学校2023-2024学年高一上学期12月月考化学试题黑龙江省实验中学2023-2024学年高一上学期第二次阶段测试化学试题天津市第一中学2023-2024学年高一上学期月考(第三章单元测验1)化学试题广东省广州市黄广中学2023-2024学年高一上学期化学竞赛选拔考试
名校
解题方法
5 . 某温度下,恒容密闭容器内发生反应:H2(g)+I2 g)  2HI(g) △H<0, 该温度下,K=43,某时刻,测得容器内 H2、I2、HI的浓度依次为0.01 mol/L、0.01 mol/L、0.02 mol/L。一段时间后,下列情况与事实相符的是
2HI(g) △H<0, 该温度下,K=43,某时刻,测得容器内 H2、I2、HI的浓度依次为0.01 mol/L、0.01 mol/L、0.02 mol/L。一段时间后,下列情况与事实相符的是
 2HI(g) △H<0, 该温度下,K=43,某时刻,测得容器内 H2、I2、HI的浓度依次为0.01 mol/L、0.01 mol/L、0.02 mol/L。一段时间后,下列情况与事实相符的是
2HI(g) △H<0, 该温度下,K=43,某时刻,测得容器内 H2、I2、HI的浓度依次为0.01 mol/L、0.01 mol/L、0.02 mol/L。一段时间后,下列情况与事实相符的是| A.混合气体颜色变深 | B.混合气体密度变大 |
| C.容器内压强变小 | D.氢气的体积分数变小 |
您最近一年使用:0次
2023-10-21更新
|
689次组卷
|
25卷引用:北京市海淀区2020届高三上学期期末考试化学试题
北京市海淀区2020届高三上学期期末考试化学试题天津市河北区2020届高三年级“停课不停学”期间线上测试化学试题天津市南开区2023届高三下学期质量监测 ( 二 ) 化学试题北京市海淀区2021~2022学年高二上学期期末化学试题(已下线)第04练 化学平衡-2022年【寒假分层作业】高二化学(人教版2019选择性必修1)安徽省舒城中学2021-2022学年高二下学期第一次月考化学试题天津市外国语大学附属外国语学校2021-2022学年高二上学期期末检测化学试题吉林省汪清县汪清四中2021-2022学年高二上学期第一次阶段考试化学试题四川省南充市2021-2022学年高二下学期期末考试化学试题 陕西省咸阳市武功县2021--2022学年高二上学期质量调研化学试题北京市铁路第二中学2022-2023学年高二上学期期中检测化学试题湖北省宜昌英杰学校2022-2023学年高二上学期10月测试化学试题北京市第三十五中学2022-2023学年高二上学期10月月考化学试题甘肃省兰州第一中学2022-2023学年高二上学期期末考试化学试题陕西省洛南中学2022-2023学年高二上学期10月月考化学试题(已下线)考点2 化学平衡 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)天津市第一中学2023-2024学年高二上学期10月月考化学试题北京市海淀区2023-2024学年高二上学期期中考试化学试题北京市和平街第一中学2023-2024学年高二上学期10月阶段性练习化学试题北京市第五十中学2023-2024学年高二上学期期中考试化学试题北京市广渠门中学2023-2024学年高二上学期期中考试化学试题 北京市第一六一中学2023-2024学年高二上学期10月月考化学试题安徽省合肥卓越中学2023-2024学年高二上学期期中考试化学试题北京市北京师范大学附属中学平谷第一分校2023-2024学年高二上学期期中考试化学试题天津市南开中学2023-2024学年高三下学期第四次月考化学试卷
名校
解题方法
6 . 实验室常利用难挥发性酸制备易挥发性酸的原理,用浓硫酸与硝石(NaNO3)反应制备HNO3反应装置如图,下列说法不正确的是
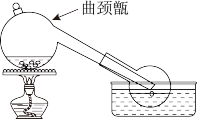
| A.可从实验室中选无色透明洁净的试剂瓶盛装制得的硝酸 |
B.反应方程式为: |
| C.反应温度如果过高,制得HNO3可能会呈现黄色 |
| D.曲颈甑不适宜制备沸点过低的物质 |
您最近一年使用:0次
2023-06-08更新
|
333次组卷
|
5卷引用:广东省珠海市2020届高三第三次模拟理综化学试题
名校
7 . 有机高分子化合物M是生产玻璃钢的原料,其合成路线如图:
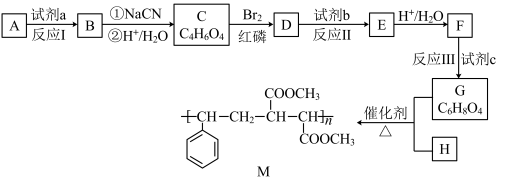
已知:R﹣X R﹣COOH
R﹣COOH
(1)烃A的相对分子质量为28,其结构简式是_______ 。
(2)试剂a是_______ 。
(3)C的结构简式是_______ 。
(4)反应Ⅱ的化学方程式是_______ 。
(5)反应Ⅲ的反应类型是_______ 。
(6)G的一种同分异构体N满足如下转化关系:
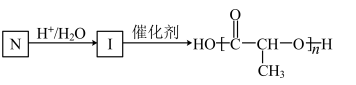
在该条件下,1mol N生成2mol I。N的结构简式是_______ 。

已知:R﹣X
 R﹣COOH
R﹣COOH(1)烃A的相对分子质量为28,其结构简式是
(2)试剂a是
(3)C的结构简式是
(4)反应Ⅱ的化学方程式是
(5)反应Ⅲ的反应类型是
(6)G的一种同分异构体N满足如下转化关系:

在该条件下,1mol N生成2mol I。N的结构简式是
您最近一年使用:0次
名校
8 . 亚砷酸(H3AsO3)在溶液中存在多种微粒形态,各种微粒物质的量分数与溶液pH关系如图所示。下列说法中,不正确的是
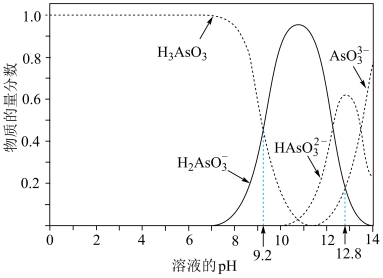

A.K3AsO3溶液中的水解方程式:AsO +H2O⇌HAsO +H2O⇌HAsO +OH﹣ +OH﹣ |
B.pH=12.8时,c(HAsO )>c(H2AsO )>c(H2AsO )=c(AsO )=c(AsO ) ) |
C.pH=12时,溶液中c(H2AsO )+2c(HAsO )+2c(HAsO )+3c(AsO )+3c(AsO )+c(OH﹣)=c(H+) )+c(OH﹣)=c(H+) |
D.pH=8.2时,在H2AsO 和H3AsO3的混合溶液中:c(H2AsO 和H3AsO3的混合溶液中:c(H2AsO ):c(H3AsO3)=1:10 ):c(H3AsO3)=1:10 |
您最近一年使用:0次
名校
解题方法
9 . 某学习小组拟对KMnO4与Na2S的反应进行了探究。所有探究实验中所使用的KMnO4溶液均为浓酸酸化的0.1mol/LKMnO4溶液[c(H+)=1.5mol/L]。
资料显示:
Ⅰ.Na2SX可溶于水,Na2SX在酸性条件下不稳定。
П.MnS为肉红色固体,难溶于水。
(1)请写出实验a中Na2S与KMnO4发生的化学反应方程式___________ 。
(2)针对实验b中,静置后淡黄色沉淀溶解的原因,小组同学提出两种假设:
假设i:淡黄色沉淀溶于水中;
假设ii:淡黄色沉淀与Na2S反应得到Na2SX并溶解。
①小组同学仔细分析实验过程后,认为假设i不成立,其依据为:___________ 。
②小组同学通过进一步实验证实溶液中存在Na2SX。请用化学用语说明设计该实验所依据的化学原理:___________
(3)请结合平衡移动原理,解释实验abc中,仅c得到肉红色固体的原因:___________ 。
(4)为探究实验d中所得棕褐色固体的组成,小组同学继续进行了实验e.某同学分析后,认为黑色固体为纯净的某种物质,并设计实验证实了他的猜想。其实验操作为:___________ 。
(5)实验d中,两溶液混合后立即发生的复分解反应可能干扰氧化还原反应的进行,请设计实验,在排除上述干扰的前提下探究等体积的KMnO4溶液与0.1mol/LNa2S溶液反应的可能的还原产物。(已知:该条件KMnO4可反应完全)。(请将实验装置补充完整,标出所用试剂,并描述实验操作)___________ 。

(6)综合以上实验,KMnO4酸性溶液与Na2S溶液反应的复杂性,与___________ 有关。
| 实验 | 操作 | 现象 |
| a | 向2mL0.1mol/LNa2S溶液中滴加3滴KMnO4溶液,振荡,静置 | 溶液中出现黄色浑浊,得到淡黄色沉淀、无色溶液 |
| b | 向2mL1.0mol/LNa2S溶液中滴加3滴KMnO4溶液,振荡,静置 | 溶液中出现黄色浑浊,浑浊消失,得到浅黄色溶液 |
| c | 向2mL2.4mol/LNa2S溶液中滴加3滴KMnO4溶液,振荡,静置 | 有肉红色固体生成,上清液为 浅黄色 |
| d | 向2mLKMnO4溶液中滴加0.1mol/LNa2S溶液 | 立即有臭鸡蛋气味气体生成,稍后,有棕褐色固体生成 |
| e | 取少量d中所得固体,滴加1.0mol/LNa2S溶液,振荡,静置 | 得到黑色固体,浅黄色溶液 |
Ⅰ.Na2SX可溶于水,Na2SX在酸性条件下不稳定。
П.MnS为肉红色固体,难溶于水。
(1)请写出实验a中Na2S与KMnO4发生的化学反应方程式
(2)针对实验b中,静置后淡黄色沉淀溶解的原因,小组同学提出两种假设:
假设i:淡黄色沉淀溶于水中;
假设ii:淡黄色沉淀与Na2S反应得到Na2SX并溶解。
①小组同学仔细分析实验过程后,认为假设i不成立,其依据为:
②小组同学通过进一步实验证实溶液中存在Na2SX。请用化学用语说明设计该实验所依据的化学原理:
(3)请结合平衡移动原理,解释实验abc中,仅c得到肉红色固体的原因:
(4)为探究实验d中所得棕褐色固体的组成,小组同学继续进行了实验e.某同学分析后,认为黑色固体为纯净的某种物质,并设计实验证实了他的猜想。其实验操作为:
(5)实验d中,两溶液混合后立即发生的复分解反应可能干扰氧化还原反应的进行,请设计实验,在排除上述干扰的前提下探究等体积的KMnO4溶液与0.1mol/LNa2S溶液反应的可能的还原产物。(已知:该条件KMnO4可反应完全)。(请将实验装置补充完整,标出所用试剂,并描述实验操作)

(6)综合以上实验,KMnO4酸性溶液与Na2S溶液反应的复杂性,与
您最近一年使用:0次
10 . 资源的高效利用对保护环境、促进经济持续健康发展具有重要作用,如回收利用电解精炼铜的阳极泥中含有的银、铂、金等贵重金属。提炼阳极泥的方法有多种,湿法提炼是其中重要的一种,其主要生产流程如图:
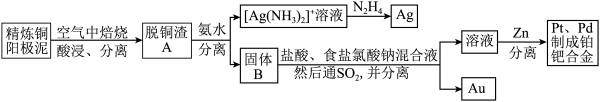
已知:
Ag+(aq)+Cl-(aq)⇌AgCl(s) K1=5.6×109
Ag+(aq)+2NH3∙H2O(aq)⇌[Ag(NH3)2]+(aq)+2H2O K2=1.1×107
请回答下列问题:
(1)各步生产流程中都涉及了同一种分离方法,该方法是___________ 。
(2)脱铜渣A中含有AgCl,由A到B使用的试剂必须是浓度高的氨水,结合有关化学用语说明原因___________ 。
(3)已知N2H4被银氨溶液氧化的产物是N2,则每生成1molAg,需要消耗___________ gN2H4。
(4)固体B中单质Au在酸性环境下与NaClO3、NaCl反应生成NaAuCl4;在NaAuCl4中Au元素的化合价为___________ 该反应的离子方程式为___________
(5)阳极泥中的铜可以用FeCl3,溶液浸出,所得溶液主要含有的阳离子为Cu2+、Fe3+和Fe2+;结合下图分析:(其中的纵坐标代表金属阳离子浓度的对数)
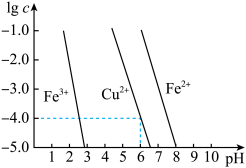
①从浸出液中提纯铜,最好先加入酸化的双氧水,目的是___________ ,然后加入适量的CuO调节pH=3.7,除去___________ 离子。
②从图中数据计算可得Cu(OH)2的Ksp约为___________ 。

已知:
Ag+(aq)+Cl-(aq)⇌AgCl(s) K1=5.6×109
Ag+(aq)+2NH3∙H2O(aq)⇌[Ag(NH3)2]+(aq)+2H2O K2=1.1×107
请回答下列问题:
(1)各步生产流程中都涉及了同一种分离方法,该方法是
(2)脱铜渣A中含有AgCl,由A到B使用的试剂必须是浓度高的氨水,结合有关化学用语说明原因
(3)已知N2H4被银氨溶液氧化的产物是N2,则每生成1molAg,需要消耗
(4)固体B中单质Au在酸性环境下与NaClO3、NaCl反应生成NaAuCl4;在NaAuCl4中Au元素的化合价为
(5)阳极泥中的铜可以用FeCl3,溶液浸出,所得溶液主要含有的阳离子为Cu2+、Fe3+和Fe2+;结合下图分析:(其中的纵坐标代表金属阳离子浓度的对数)

①从浸出液中提纯铜,最好先加入酸化的双氧水,目的是
②从图中数据计算可得Cu(OH)2的Ksp约为
您最近一年使用:0次



