名校
解题方法
1 . 标准状况下,1.5mol 的体积为
的体积为
 的体积为
的体积为| A.11.2L | B.22.4L | C.33.6L | D.67.2L |
您最近一年使用:0次
7日内更新
|
64次组卷
|
5卷引用:广西桂林市第十八中学2019-2020学年高二上学期期中考试化学(文)试题
广西桂林市第十八中学2019-2020学年高二上学期期中考试化学(文)试题贵州省长顺文博高级中学2020-2021学年高二上学期期中考试化学试题湖南省普通高中2024届高三学业水平合格性考试模拟试卷(二)化学试题(已下线)山东省青岛市2023-2024学年高三下学期第三次模拟考试化学试题(已下线)江苏省南京市第十三中学2024届高三下学期适应性考试化学试题
2 . 某种化合物的结构如图所示,其中X、Y、Z、Q、W为原子序数依次增大的五种短周期元素,Q核外最外层电子数与Y核外电子总数相同,X的原子半径是元素周期表中最小的。下列叙述正确的是
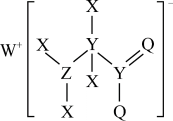
| A.WX的水溶液呈中性 |
| B.元素非金属性的顺序为Y>Z>Q |
| C.Z的最高价氧化物对应的水化物是一元强酸 |
| D.该化合物中与Y双键相连的Q不满足8电子稳定结构 |
您最近一年使用:0次
3 . CH4在高温下的分解反应相当复杂,其原理属于游离基反应。随着反应温度的不同,CH4的分解产物为甲基-CH3、亚甲基-CH2-、次甲基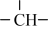 、氢原子H等,这些基团又可以相互结合形成诸多种类的物质,如2个亚甲基结合,就形成了乙烯、2个次甲基结合就形成的乙炔。一般规律是:温度越高,小分子量的产物就越多。
、氢原子H等,这些基团又可以相互结合形成诸多种类的物质,如2个亚甲基结合,就形成了乙烯、2个次甲基结合就形成的乙炔。一般规律是:温度越高,小分子量的产物就越多。
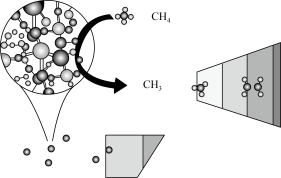
(2)已知相关物质的燃烧热如表,写出甲烷制备乙烯的热化学方程式
| 物质 | 燃烧热/(kJ·mol-1) |
| 氢气 | 285.8 |
| 甲烷 | 890.3 |
| 乙烯 | 1411.0 |
①在该温度下,其平衡常数K=
②若向该容器通入高温水蒸气(不参加反应,高于400℃),C2H4的产率将
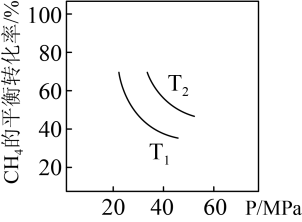
③若容器体积固定,不同温度下可得变化如下图,则温度T1、T2的关系是
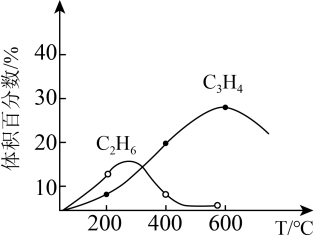
B.400℃时,C2H4、C2H6的体积分数分别为20.0%、6.0%,则体系中CH4的体积分数是
您最近一年使用:0次
4 . 某课外小组采用廉价原料NH4VO3、TiO2和Fe2O3,制出含VO2+、TiO2+和Fe3+的金属盐溶液,然后选择氨水作沉淀剂进行共沉淀反应,对共沉淀物[含VO(OH)2、Ti(OH)4、Fe(OH)3]进行煅烧还原制备合金样品,钒基固溶体合金是一类重要的贮氢材料。制备共沉淀物的装置如下图:_______ 、_______ 、_______ 。
(2)装置C中支管插入三颈烧瓶中的作用是_______ 。
(3)制备VO2+时,用草酸将 还原得VO2+。若把草酸改为盐酸,也能得到VO2+,但会产生一种有毒气体,该反应的离子方程式为
还原得VO2+。若把草酸改为盐酸,也能得到VO2+,但会产生一种有毒气体,该反应的离子方程式为_______ 。
(4)反应过程需控制温度为60℃,三颈烧瓶的加热方式是_______ 。
(5)往三颈烧瓶中滴加含金属离子的混合液,得悬浊液,取出充分沉降。
①检测上层清液是否含Fe3+的实验方案是_______ 。
②经过滤、无水乙醇洗涤、低温干燥,得共沉淀物。使用无水乙醇洗涤的优点是_______ 。
(6)将(5)所得共沉淀物煅烧并还原后得钒基固溶体合金。为测定产品中铁的质量分数,取50.60g产品溶于足量稀硫酸(其中V、Ti不溶),过滤,将滤液配成250.00mL,取25.00mL溶液,用0.1000mol/L酸性KMnO4溶液滴定,进行平行实验后,平均消耗KMnO4溶液的体积为20.00mL。则产品中铁的质量分数为_______ 。
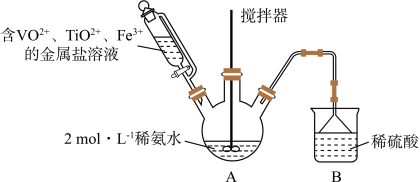
(2)装置C中支管插入三颈烧瓶中的作用是
(3)制备VO2+时,用草酸将
 还原得VO2+。若把草酸改为盐酸,也能得到VO2+,但会产生一种有毒气体,该反应的离子方程式为
还原得VO2+。若把草酸改为盐酸,也能得到VO2+,但会产生一种有毒气体,该反应的离子方程式为(4)反应过程需控制温度为60℃,三颈烧瓶的加热方式是
(5)往三颈烧瓶中滴加含金属离子的混合液,得悬浊液,取出充分沉降。
①检测上层清液是否含Fe3+的实验方案是
②经过滤、无水乙醇洗涤、低温干燥,得共沉淀物。使用无水乙醇洗涤的优点是
(6)将(5)所得共沉淀物煅烧并还原后得钒基固溶体合金。为测定产品中铁的质量分数,取50.60g产品溶于足量稀硫酸(其中V、Ti不溶),过滤,将滤液配成250.00mL,取25.00mL溶液,用0.1000mol/L酸性KMnO4溶液滴定,进行平行实验后,平均消耗KMnO4溶液的体积为20.00mL。则产品中铁的质量分数为
您最近一年使用:0次
5 . 过渡性金属元素在工业生产中有很重要的作用,如金属钼用于制火箭、卫星的合金构件,钼酸钠晶体(Na2MoO4·2H2O)是一种重要的金属缓蚀剂。某工厂利用钼精矿(主要成分MoS2,还含少量钙、镁等元素)为原料冶炼金属钼和钼酸钠晶体(Na2MoO4·2H2O)的主要流程图如下:_______ ,已知Rb(铷)质子数为37,在第五周期ⅠA,Mo的质子数为42,那么Mo在周期表中的位置为第五周期_______ 族。
(2)用浓氨水溶解粗产品的离子方程式是_______ ,由图中信息可以判断MoO3是_______ 氧化物。(填“酸性”、“碱性”或“两性”)
(3)操作Ⅰ是_______ ,操作Ⅱ所得的钼酸要水洗,检验钼酸是否洗涤干净的方法是_______ 。
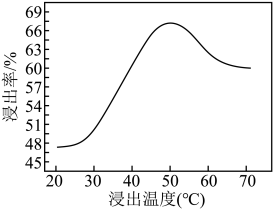
(4)采用NaClO氧化钼矿的方法将矿石中的钼浸出,该过程放热。①请配平以下化学反应:_______ 。
_______NaClO+_______MoS2+_______NaOH→_______Na2MoO4+_______Na2SO4+_______NaCl+_______H2O
②钼的浸出率随着温度变化如图,当温度高于50℃后浸出率降低的可能原因是_______ (写一点)。 Lix(MoS2)n,则电池工作时正极上的电极反应式为
Lix(MoS2)n,则电池工作时正极上的电极反应式为_______ 。
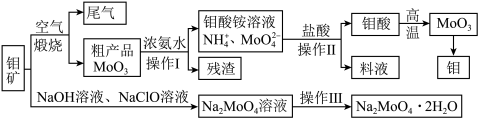
(2)用浓氨水溶解粗产品的离子方程式是
(3)操作Ⅰ是
(4)采用NaClO氧化钼矿的方法将矿石中的钼浸出,该过程放热。①请配平以下化学反应:
_______NaClO+_______MoS2+_______NaOH→_______Na2MoO4+_______Na2SO4+_______NaCl+_______H2O
②钼的浸出率随着温度变化如图,当温度高于50℃后浸出率降低的可能原因是
 Lix(MoS2)n,则电池工作时正极上的电极反应式为
Lix(MoS2)n,则电池工作时正极上的电极反应式为
您最近一年使用:0次
6 . SO2和NOx是主要大气污染物,利用下图装置可同时吸收SO2和NO。

| A.b极为直流电源的正极,与其相连的电极发生氧化反应 |
B.阴极发生反应的离子方程式为SO2-2e-+2H2O=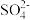 +4H+ +4H+ |
C.吸收池中发生反应的离子方程式为2NO+2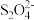 +2H2O=N2+4 +2H2O=N2+4 |
| D.阴极得到2mol电子时,通过阳离子交换膜的氢离子为2mol |
您最近一年使用:0次
7 . 已知NA是阿伏加德罗常数的值,下列说法正确的是
| A.32g乙醇和14g二甲醚(H3C-O-CH3)的混合物中共价键数目为8NA |
| B.0.1molH2C2O4被氧化为CO2转移的电子数为0.1NA |
| C.18g18O含有的中子数为8NA |
| D.常温下,6.4g铜片投入到足量的浓硫酸中,生成的SO2分子数为0.1NA |
您最近一年使用:0次
名校
解题方法
8 . 资源化利用CO2,不仅可以减少温室气体的排放,还可以获得燃料或重要的化工产品。
(1)CO2的捕集:
①CO2属于___________ 分子(填“极性”或“非极性”),其晶体(干冰)属于__________ 晶体。
②用饱和 溶液做吸收剂可“捕集”CO2。若所得溶液
溶液做吸收剂可“捕集”CO2。若所得溶液 ,溶液中c(HCO
,溶液中c(HCO ):c(CO
):c(CO )=
)=_______ ;(室温下, 的K1=4×10-7;K2=5×10-11)若吸收剂失效,可利用NaOH溶液使其再生,写出该反应的离子方程式
的K1=4×10-7;K2=5×10-11)若吸收剂失效,可利用NaOH溶液使其再生,写出该反应的离子方程式_____ 。
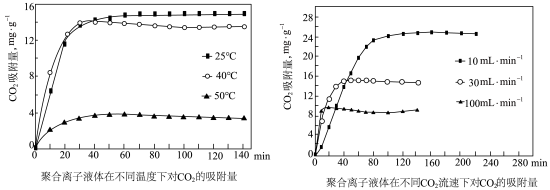
③聚合离子液体是目前广泛研究的CO2吸附剂。结合下图 分析聚合离子液体吸附CO2的有利条件是____________ 。
(2)生产尿素:工业上以CO2、 为原料生产尿素[CO(NH2)2],该反应分为二步进行:
为原料生产尿素[CO(NH2)2],该反应分为二步进行:
第一步: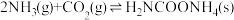
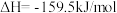
第二步:
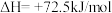
写出上述合成尿素的热化学方程式_______ 。
(3)合成乙酸:中国科学家首次以 、CO2和H2为原料高效合成乙酸,其反应路径如图所示:
、CO2和H2为原料高效合成乙酸,其反应路径如图所示:
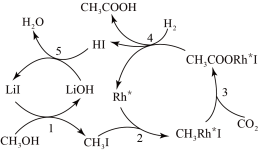
①原料中的 可通过电解法由
可通过电解法由 制取,用稀硫酸作电解质溶液,写出生成
制取,用稀硫酸作电解质溶液,写出生成 的电极反应式:
的电极反应式:____________ 。
②根据图示 ,写出总反应的化学方程式:_______ 。
(1)CO2的捕集:
①CO2属于
②用饱和
 溶液做吸收剂可“捕集”CO2。若所得溶液
溶液做吸收剂可“捕集”CO2。若所得溶液 ,溶液中c(HCO
,溶液中c(HCO ):c(CO
):c(CO )=
)= 的K1=4×10-7;K2=5×10-11)若吸收剂失效,可利用NaOH溶液使其再生,写出该反应的离子方程式
的K1=4×10-7;K2=5×10-11)若吸收剂失效,可利用NaOH溶液使其再生,写出该反应的离子方程式③聚合离子液体是目前广泛研究的CO2吸附剂。

(2)生产尿素:工业上以CO2、
 为原料生产尿素[CO(NH2)2],该反应分为二步进行:
为原料生产尿素[CO(NH2)2],该反应分为二步进行:第一步:
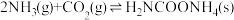
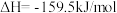
第二步:

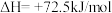
写出上述合成尿素的热化学方程式
(3)合成乙酸:中国科学家首次以
 、CO2和H2为原料高效合成乙酸,其反应路径如图所示:
、CO2和H2为原料高效合成乙酸,其反应路径如图所示:
①原料中的
 可通过电解法由
可通过电解法由 制取,用稀硫酸作电解质溶液,写出生成
制取,用稀硫酸作电解质溶液,写出生成 的电极反应式:
的电极反应式:②
您最近一年使用:0次
2024-04-04更新
|
344次组卷
|
3卷引用:天津市南开中学2020届高三一模化学试卷
2013·上海·二模
名校
9 . 下列有机物分类正确的是
A.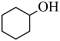 芳香族化合物 芳香族化合物 | B.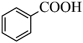 羧酸 羧酸 |
C.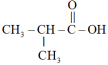 醛 醛 | D.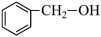 酚 酚 |
您最近一年使用:0次
2024-04-03更新
|
590次组卷
|
13卷引用:2013届上海市闸北区高三下学期二模化学试卷
(已下线)2013届上海市闸北区高三下学期二模化学试卷(已下线)2014届上海市长宁区高三上学期期末(一模)考试化学试卷辽宁省抚顺市六校协作体2019-2020学年高二上学期期末考试化学试题河北省邯郸市永年区第二中学2019-2020学年高二下学期6月考试化学试题新疆乌鲁木齐市高级中学2024届高三上学期第一次模拟考试化学试题上海市育才中学2022-2023学年高二上学期期中考试化学试题第一章 有机化合物的结构特点与研究方法(A卷·知识通关练)-【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修3)(已下线)专题突破卷10 有机化学基础(一)-2024年高考化学一轮复习考点通关卷(新教材新高考)云南省保山市高(完)中C、D类学校2022-2023学年高二下学期6月份联考化学试题江西省宜春市宜丰中学2022-2023学年高二下学期3月月考化学试题辽宁省朝阳市建平县实验中学2023-2024学年高二下学期3月月考化学试题1.1.1 有机化合物的分类方法 随堂练习黑龙江省佳木斯市三校联考2023-2024学年高二下学期4月期中考试化学试题
10 . 下列制取SO2、验证其漂白性、收集并进行尾气处理的装置和原理能达到实验目的的是
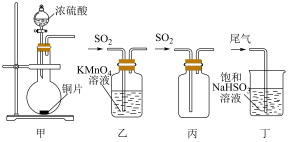
| A.用装置甲制取SO2 | B.用装置乙验证SO2的漂白性 |
| C.用装置丙收集SO2 | D.用装置丁处理实验中的尾气 |
您最近一年使用:0次
2024-03-25更新
|
734次组卷
|
107卷引用:北京市密云区2017-2018学年高三第二学期阶段性练习理综化学试题
北京市密云区2017-2018学年高三第二学期阶段性练习理综化学试题四川省成都市第七中学2020年高中毕业班教学质量监测卷理科综合化学试题陕西省西安市高新第一中学2020届高三教学质量监测理综化学试题河南省洛阳市第一高级中学2016-2017学年高一6月月考化学试题2017年全国普通高等学校招生统一考试化学(江苏卷精编版)安徽省宣城市2016-2017学年高一下学期期末调研测试化学试题江苏省海安高级中学2018届高三1月月考化学试题北京市丰台区2018届高三上学期期末考试化学试题(已下线)【中等生百日捷进提升系列-基础练测】专题2.15 物质的制备及实验方案设计与评价重庆市第一中学2017-2018学年高一下学期第一次月考化学试题(已下线)解密16 化学实验基础(教师版)——备战2018年高考化学之高频考点解密【全国百强校】四川省雅安中学2018-2019学年高一上学期开学考试化学试题山东省淄博市淄川中学2019届高三上学期开学考试化学试题【校级联考】湖北省宜昌县域高中协同发展共合体2018-2019学年高一上学期期末考试化学试题【全国百强校】吉林省延边市第二中学2018-2019学年高一下学期开学考试化学试题步步为赢 高二化学暑假作业:作业十二 化学实验基础知识重庆市璧山大路中学校2018-2019学年高一下学期4月月考化学试题重庆市第三十中学2018-2019学年高一下学期期中考试化学试题百所名校联考-非金属及其化合物福建省莆田市莆田第二十五中学2020届高三上学期期中考试化学试题安徽省合肥二中2019-2020学年度高三上学期第一次段考化学试题安徽省芜湖市严桥中学2019-2020学年高三第一学期第三次月考化学试题宁夏回族自治区吴忠市青铜峡市高级中学2020届高三上学期第二次月考化学试题上海市同济大学第一附属中学2019—2020学年高三上学期期中考试化学试题2019年秋高三化学复习强化练习—— 硫及其化合物上海市普陀区2020届高三上学期一模化学试题江苏省苏州市2018-2019学年高一上学期期末考试化学试题2020届高三化学一轮复习 化学基础实验(选择题和大题训练)(已下线)专题3.4 硫及其化合物 -巅峰冲刺山东省2020年高考化学一轮考点扫描《2020年新高考政策解读与配套资源》第2章 第3节 化学反应的利用福建省福州市第一中学2020年高一在线自测自评质检化学试题(已下线)广东省深圳中学2020届高三3月份教学质量监测卷理综化学试题福建省泉州第十六中学2019-2020学年高一下学期5月月考化学试题(已下线)专题4.3 硫及其化合物(练)——2020年高考化学一轮复习讲练测(已下线)专题4.3 硫及其化合物(讲)——2020年高考化学一轮复习讲练测北京市丰台区首师大附属云岗中学2019届高三上学期10月月考化学试题河北省衡水市桃城区第十四中学2019-2020学年高一下学期第二次调研考试化学试题(已下线)考点15 常见非金属元素单质及其重要化合物3——硫-2020年【衔接教材·暑假作业】新高三一轮复习化学(已下线)第6单元 常见的非金属元素(A卷 基础过关检测)-2021年高考化学一轮复习单元滚动双测卷广东省珠海市2019-2020学年高一下学期期末学业质量监测化学试题苏教版(2020)高一必修第一册专题4 总结检测鲁科版(2019)高一必修第一册第3章 物质的性质与转化 总结检测鲁科版(2019)高一必修第一册第三章C 高考挑战区 过高考 3年真题强化闯关北京师范大学珠海分校附属外国语学校2019-2020学年高一下学期期末考试化学试题高一必修第一册(鲁科2019)第3章 第2节 硫的转化 高考帮高一必修第二册(人教2019版)第五章 素养检测高一必修第一册(苏教2019版)专题4 C 高考挑战区湖南省长沙市雅礼中学2021届高三上学期第二次月考化学试题(已下线)专题讲座(四) 常见气体的实验室制备、净化和收集(精练)-2021年高考化学一轮复习讲练测高一必修第一册(苏教2019)专题4 第一单元 含硫化合物的性质3福建省漳州市平和县第一中学2021届高三上学期期中考试化学试题安徽省灵璧县第一中学2020-2021学年高一上学期12月月考试题山东省胶州市实验中学2020-2021学年高一上学期12月月考化学试题(已下线)练习9 硫和二氧化硫-2020-2021学年【补习教材·寒假作业】高一化学(人教版2019)江苏省苏州市苏州大学附属中学2020-2021学年高一上学期月考化学试卷2江苏省苏州市园区苏州大学附属中学2020-2021学年高一上学期12月月考化学试题江苏省昆山市周市高级中学2020-2021学年高一上学期第二次模块测试化学试题江西省上饶市2019-2020学年高一下学期期末教学质量测试化学试题(已下线)北京市西城区2024届高三下学期第三次模拟测试化学试题专题4 第一单元综合拔高练-高中化学苏教2019版必修第一册(人教版2019)必修第二册 第五章 化工生产中的重要非金属元素 第一节 硫及其化合物宁夏银川一中2020-2021学年高一上学期期末考试(GAC)化学试题(已下线)5.1.3 不同价态含硫物质的转化(基础过关)-2020-2021学年高一化学新教材新理念新设计同步课堂(人教2019必修第二册)湖南省长沙市第一中学2020-2021学年高一下学期第一次月考化学试题黑龙江省哈尔滨市阿城区龙涤中学2020-2021学年高一4月月考化学试题(已下线)【苏州新东方】04 吴县中学黑龙江省哈尔滨市第一六二中学校2020-2021学年高一下学期4月月考化学试题吉林省松原市前郭尔罗斯蒙古族自治县第五中学2021届高三下学期5月月考化学试题甘肃省金昌市第一中学2020-2021学年高一下学期期中考试化学(理)试题江苏省启东市吕四中学2020-2021学年高一下学期第二次月考化学试题云南省楚雄天人中学2020-2021学年高一下学期3月月考化学(B)试题云南省楚雄天人中学2020-2021学年高一下学期3月月考化学(A)试题吉林省白城一中、大安一中、通榆一中、洮南一中、镇赉一中2020-2021学年高一下学期期末考试化学试题(已下线)考向12 硫及其化合物-备战2022年高考化学一轮复习考点微专题广东省深圳市第七高级中学2022届高三第一次月考化学试卷江苏省盐城市伍佑中学2021-2022学年高二上学期第一次阶段考试化学(必修)试题浙江省温州市瑞安市上海新纪元高级中学2021-2022学年高一9月份月考(5-6班)化学试题江苏省徐州市沛县2021-2022学年高三上学期第一次学情调研化学试题(已下线)考向34 物质的检验、分离和提纯-备战2022年高考化学一轮复习考点微专题江苏省徐州市2021-2022学年高一上学期12月月考化学试题(已下线)上海市华东师范大学第二附属中学2021-2022学年高一上学期12月质量检测化学试题(已下线)第10练 硫及其化合物-2022年【寒假分层作业】高一化学(苏教版2019必修第一册)江苏省盐城市滨海县五汛中学2021-2022学年高二上学期期中考试化学试题甘肃省张掖市第二中学 2021-2022学年高一下学期3月月考化学试题宁夏青铜峡市高级中学2021-2022学年高一上学期期末考试化学试题(已下线)卷13 化学基础实验(检验、鉴别、分离、提纯)-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)上海市七宝中学 2021-2022学年高一下学期期中考试化学试题(已下线)【期末复习】必刷题(1)-【帮课堂】2021-2022学年高一化学同步精品讲义(人教版2019必修第二册)广东省广州市育才中学2021-2022学年高一下学期期中考试化学试题天津市第二十一中学2021-2022学年高一下学期期中学情调研化学试题新疆维吾尔自治区阿克苏地区第二中学2021-2022学年高一年级下学期第二次月考化学试题(已下线)【教材实验热点】06 二氧化硫的漂白性(已下线)考点10 硫及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)江苏省南京市中华中学2021-2022学年高三上学期期中考试化学试题江苏省苏州市常熟中学2022-2023学年高一上学期末测试卷一化学试题四川省资阳市乐至中学2022-2023学年高一下学期3月月考化学试题四川省自贡市荣县2022-2023学年高一下学期4月期中考试化学试题广东省广州市协和中学2022-2023学年高一下学期期中考试化学试题广东省广州科学城中学2022-2023学年高一下学期期中考试化学试题(已下线)专题突破卷13 化学实验基础(二)-2024年高考化学一轮复习考点通关卷(新教材新高考)(已下线)考点巩固卷04 非金属及其化合物(4大考点60题)?-2024年高考化学一轮复习考点通关卷(新高考通用)山东省鄄城县第一中学2023-2024学年高三上学期9月月考化学试题(已下线)押题卷01-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(江苏专用)福建省漳州市第一中学2023-2024学年高一上学期化学12月月考(第二单元)江西省丰城市东煌学校2022-2023学年高一下学期6月期末考试化学试题广东实验中学越秀学校2023-2024学年高一3月段考化学试题黑龙江省双鸭山市第一中学2023-2024学年高一下学期4月月考化学试题



