1 . 某种化合物的结构如图所示,其中X、Y、Z、Q、W为原子序数依次增大的五种短周期元素,Q核外最外层电子数与Y核外电子总数相同,X的原子半径是元素周期表中最小的。下列叙述正确的是
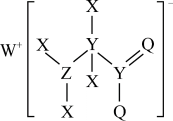
| A.WX的水溶液呈中性 |
| B.元素非金属性的顺序为Y>Z>Q |
| C.Z的最高价氧化物对应的水化物是一元强酸 |
| D.该化合物中与Y双键相连的Q不满足8电子稳定结构 |
您最近一年使用:0次
2 . CH4在高温下的分解反应相当复杂,其原理属于游离基反应。随着反应温度的不同,CH4的分解产物为甲基-CH3、亚甲基-CH2-、次甲基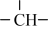 、氢原子H等,这些基团又可以相互结合形成诸多种类的物质,如2个亚甲基结合,就形成了乙烯、2个次甲基结合就形成的乙炔。一般规律是:温度越高,小分子量的产物就越多。
、氢原子H等,这些基团又可以相互结合形成诸多种类的物质,如2个亚甲基结合,就形成了乙烯、2个次甲基结合就形成的乙炔。一般规律是:温度越高,小分子量的产物就越多。
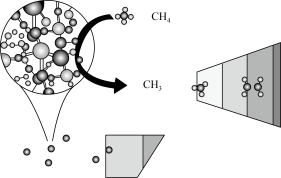
(2)已知相关物质的燃烧热如表,写出甲烷制备乙烯的热化学方程式
| 物质 | 燃烧热/(kJ·mol-1) |
| 氢气 | 285.8 |
| 甲烷 | 890.3 |
| 乙烯 | 1411.0 |
①在该温度下,其平衡常数K=
②若向该容器通入高温水蒸气(不参加反应,高于400℃),C2H4的产率将
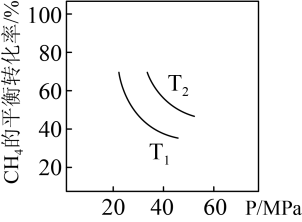
③若容器体积固定,不同温度下可得变化如下图,则温度T1、T2的关系是
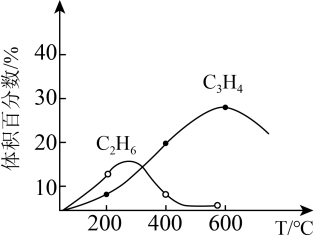
B.400℃时,C2H4、C2H6的体积分数分别为20.0%、6.0%,则体系中CH4的体积分数是
您最近一年使用:0次
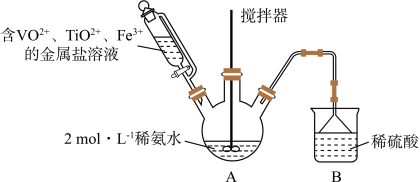
3 . 某课外小组采用廉价原料NH4VO3、TiO2和Fe2O3,制出含VO2+、TiO2+和Fe3+的金属盐溶液,然后选择氨水作沉淀剂进行共沉淀反应,对共沉淀物[含VO(OH)2、Ti(OH)4、Fe(OH)3]进行煅烧还原制备合金样品,钒基固溶体合金是一类重要的贮氢材料。制备共沉淀物的装置如下图:_______ 、_______ 、_______ 。
(2)装置C中支管插入三颈烧瓶中的作用是_______ 。
(3)制备VO2+时,用草酸将 还原得VO2+。若把草酸改为盐酸,也能得到VO2+,但会产生一种有毒气体,该反应的离子方程式为
还原得VO2+。若把草酸改为盐酸,也能得到VO2+,但会产生一种有毒气体,该反应的离子方程式为_______ 。
(4)反应过程需控制温度为60℃,三颈烧瓶的加热方式是_______ 。
(5)往三颈烧瓶中滴加含金属离子的混合液,得悬浊液,取出充分沉降。
①检测上层清液是否含Fe3+的实验方案是_______ 。
②经过滤、无水乙醇洗涤、低温干燥,得共沉淀物。使用无水乙醇洗涤的优点是_______ 。
(6)将(5)所得共沉淀物煅烧并还原后得钒基固溶体合金。为测定产品中铁的质量分数,取50.60g产品溶于足量稀硫酸(其中V、Ti不溶),过滤,将滤液配成250.00mL,取25.00mL溶液,用0.1000mol/L酸性KMnO4溶液滴定,进行平行实验后,平均消耗KMnO4溶液的体积为20.00mL。则产品中铁的质量分数为_______ 。
(2)装置C中支管插入三颈烧瓶中的作用是
(3)制备VO2+时,用草酸将
 还原得VO2+。若把草酸改为盐酸,也能得到VO2+,但会产生一种有毒气体,该反应的离子方程式为
还原得VO2+。若把草酸改为盐酸,也能得到VO2+,但会产生一种有毒气体,该反应的离子方程式为(4)反应过程需控制温度为60℃,三颈烧瓶的加热方式是
(5)往三颈烧瓶中滴加含金属离子的混合液,得悬浊液,取出充分沉降。
①检测上层清液是否含Fe3+的实验方案是
②经过滤、无水乙醇洗涤、低温干燥,得共沉淀物。使用无水乙醇洗涤的优点是
(6)将(5)所得共沉淀物煅烧并还原后得钒基固溶体合金。为测定产品中铁的质量分数,取50.60g产品溶于足量稀硫酸(其中V、Ti不溶),过滤,将滤液配成250.00mL,取25.00mL溶液,用0.1000mol/L酸性KMnO4溶液滴定,进行平行实验后,平均消耗KMnO4溶液的体积为20.00mL。则产品中铁的质量分数为
您最近一年使用:0次
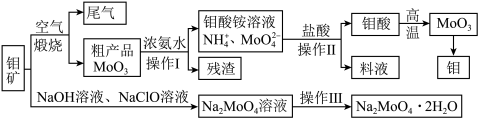
4 . 过渡性金属元素在工业生产中有很重要的作用,如金属钼用于制火箭、卫星的合金构件,钼酸钠晶体(Na2MoO4·2H2O)是一种重要的金属缓蚀剂。某工厂利用钼精矿(主要成分MoS2,还含少量钙、镁等元素)为原料冶炼金属钼和钼酸钠晶体(Na2MoO4·2H2O)的主要流程图如下:_______ ,已知Rb(铷)质子数为37,在第五周期ⅠA,Mo的质子数为42,那么Mo在周期表中的位置为第五周期_______ 族。
(2)用浓氨水溶解粗产品的离子方程式是_______ ,由图中信息可以判断MoO3是_______ 氧化物。(填“酸性”、“碱性”或“两性”)
(3)操作Ⅰ是_______ ,操作Ⅱ所得的钼酸要水洗,检验钼酸是否洗涤干净的方法是_______ 。
(4)采用NaClO氧化钼矿的方法将矿石中的钼浸出,该过程放热。①请配平以下化学反应:_______ 。
_______NaClO+_______MoS2+_______NaOH→_______Na2MoO4+_______Na2SO4+_______NaCl+_______H2O
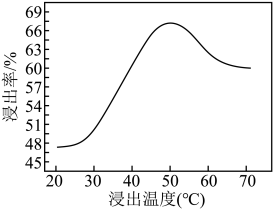
②钼的浸出率随着温度变化如图,当温度高于50℃后浸出率降低的可能原因是_______ (写一点)。 Lix(MoS2)n,则电池工作时正极上的电极反应式为
Lix(MoS2)n,则电池工作时正极上的电极反应式为_______ 。
(2)用浓氨水溶解粗产品的离子方程式是
(3)操作Ⅰ是
(4)采用NaClO氧化钼矿的方法将矿石中的钼浸出,该过程放热。①请配平以下化学反应:
_______NaClO+_______MoS2+_______NaOH→_______Na2MoO4+_______Na2SO4+_______NaCl+_______H2O
②钼的浸出率随着温度变化如图,当温度高于50℃后浸出率降低的可能原因是
 Lix(MoS2)n,则电池工作时正极上的电极反应式为
Lix(MoS2)n,则电池工作时正极上的电极反应式为
您最近一年使用:0次
5 . SO2和NOx是主要大气污染物,利用下图装置可同时吸收SO2和NO。

| A.b极为直流电源的正极,与其相连的电极发生氧化反应 |
B.阴极发生反应的离子方程式为SO2-2e-+2H2O= +4H+ +4H+ |
C.吸收池中发生反应的离子方程式为2NO+2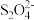 +2H2O=N2+4 +2H2O=N2+4 |
| D.阴极得到2mol电子时,通过阳离子交换膜的氢离子为2mol |
您最近一年使用:0次
6 . 已知NA是阿伏加德罗常数的值,下列说法正确的是
| A.32g乙醇和14g二甲醚(H3C-O-CH3)的混合物中共价键数目为8NA |
| B.0.1molH2C2O4被氧化为CO2转移的电子数为0.1NA |
| C.18g18O含有的中子数为8NA |
| D.常温下,6.4g铜片投入到足量的浓硫酸中,生成的SO2分子数为0.1NA |
您最近一年使用:0次
名校
7 . 设NA为阿伏伽德罗常数的值,下列说法正确的是
| A.100mL 1mol/L NH4Cl溶液中含有阳离子的数目大于0.1NA |
| B.0.1mol的11B中,含有0.6NA个电子 |
| C.25℃时,pH=13的Ba(OH)2溶液中含有氢氧根离子数为0.1NA |
| D.标准状况下,5.6L CO2中含有的共用电子对数为0.5 NA |
您最近一年使用:0次
9-10高二下·浙江温州·期末
名校
解题方法
8 . 在25 ℃、101 kPa下,碳、氢气、甲烷和葡萄糖的摩尔燃烧焓依次是393.5 kJ/mol、285.8 kJ/mol、890.3 kJ/mol、2 800 kJ/mol,则下列热化学方程式正确的是
A.C(s)+ O2(g)=CO(g) ΔH=-393.5 kJ/mol O2(g)=CO(g) ΔH=-393.5 kJ/mol |
| B.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ/mol |
| C.2H2(g)+O2(g)=2H2O(l) ΔH=+571.6 kJ/mol |
D. C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(g) ΔH=-1 400 kJ/mol C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(g) ΔH=-1 400 kJ/mol |
您最近一年使用:0次
2023-08-26更新
|
1455次组卷
|
53卷引用:2016届贵州省遵义航天高级中学高三第五次模拟理科综合试卷
2016届贵州省遵义航天高级中学高三第五次模拟理科综合试卷(已下线)2013届陕西省宝鸡市高三第三次模拟理综化学试卷2015-2016学年贵州省思南中学高二上第一半月考化学试卷2016届海南省华侨中学高三考前模拟理综化学试卷(已下线)09-10年温州市高二下学期期末四校联考化学卷(已下线)2010年河北省邯郸市高二上学期期末考试化学试卷(已下线)2010—2011学年湖北省长阳一中高二上学期期末考试化学试卷(已下线)2011-2012学年陕西省西安市第一中学高二上学期期中考试化学试卷(已下线)2011-2012学年海南省洋浦中学高二下学期期末考试化学试卷(已下线)2011-2012学年江西上饶中学高一零点、实验班下期末化学试卷(已下线)2013-2014学年海南省三亚市一中高二上学期期中考试理科化学试卷(已下线)2013-2014学年海南三亚一中高二上学期期中考试理科化学试卷(B)(已下线)2014届高考化学二轮复习提分训练 专题5化学反应与能量练习卷(已下线)2014-2015学年山西省太原第五中学高二10月月考化学试卷2014-2015四川省邛崃市高埂中学高二下学期第一次月考化学试卷2016-2017学年河北省涿鹿中学高二上学期第一次月考化学试卷2016-2017学年吉林省汪清六中高二上第一次月考化学试卷2016-2017学年广西柳州铁路一中高二上段考理化学卷辽宁省鞍山市第一中学2016-2017学年高一下学期期中考试化学试题宁夏银川市六盘山高级中学2017-2018学年高二上学期第一次月考化学试题山东省临沂市蒙阴县实验中学2017-2018学年高二上学期期中考试化学试题1山东省临沂市蒙阴县实验中学2017-2018学年高二上学期期中考试化学试题2山西省忻州二中2018-2019学年高二上学期期中考试化学试题(已下线)2019年9月1日《每日一题》人教选修4—— 每周一测河南省周口中英文学校2019-2020学年高二上学期第一次月考化学试题四川省广安市岳池县顾县中学2019—2020学年第一学期高二上学期期中测试化学(选修四)试题山西省运城市景胜中学2019-2020学年高二上学期期中考试化学试题江西省上饶市“山江湖”协作体2019-2020学年高二上学期期中联考(自主班)化学试题云南省楚雄市楚雄实验中学2018—2019学年高二上学期9月月考化学试题(已下线)1.2 燃烧热 能源(基础练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)内蒙古自治区通辽市科左后旗甘旗卡第二高级中学2020-2021学年高二上学期期中考试化学试题河南省豫北名校2020-2021学年高二上学期11月质量检测化学试题华中师范大学海南附属中学2019-2020学年高二上学期第三次月考化学试题江苏省南菁高级中学2020-2021学年度高二上学期第一次阶段性考试化学(强化班)试题江苏省江阴长泾中学2020~2021学年下学期期中考试化学试题青海省海东市第二中学2020-2021学年高二4月月考化学试题吉林省长春外国语学校2020-2021学年高一下学期期末考试化学试题(已下线)第二节 燃烧热 能源(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版选修4)(已下线)1.1.2 热化学方程式 燃烧热-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)(已下线)专题18 化学反应与能量(热点讲义)-2022年高三毕业班化学常考点归纳与变式演练甘肃省舟曲县第一中学2021-2022学年高二上学期第一次月考化学试题江西省吉安市(吉安县三中、泰和二中、安福二中、井大附中 )2021-2022学年高二上学期期中考试化学试题山西省运城市康杰中学2021-2022学年高二上学期期中化学试题(已下线)1.1.2 热化学方程式 燃烧热(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)1.1.2 热化学方程式 燃烧热(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)1.3 燃料的合理利用-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)(已下线)1.3 燃料的合理利用-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)(已下线)第02讲 热化学方程式与燃烧热(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)(已下线)第一章 化学反应的热效应(A卷·知识通关练)-【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)云南省昆明市寻甸县第二中学2022-2023学年高二上学期10月月考 化学试卷(已下线)单项选择题第3课时 反应焓变的计算(已下线)专题01 反应热、焓变与热化学方程式【考题猜想】(6大题型)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)
9 . 根据SO2通入不同溶液中的实验现象,所得结论不正确的是
| 选项 | 实验 | 现象 | 结论 |
| A | 含HCl、BaCl2的FeCl3溶液 | 产生白色沉淀 | SO2有还原性 |
| B | H2S溶液 | 产生黄色沉淀 | SO2有氧化性 |
| C | 酸性KMnO4溶液 | 紫色溶液褪色 | SO2有漂白性 |
| D | Na2SiO3溶液 | 产生胶状沉淀 | 酸性:H2SO3>H2SiO3 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-06-07更新
|
1948次组卷
|
112卷引用:贵州省贵阳市第一中学2020届高三教学质量监测理科综合化学试题
贵州省贵阳市第一中学2020届高三教学质量监测理科综合化学试题四川省成都市第七中学2020年高中毕业班教学质量监测卷理科综合化学试题广东省深圳中学2020年高中毕业班教学质量监测卷理科综合化学试题河北省衡水中学2020年高中毕业班教学质量监测卷理科综合化学试题辽宁省沈阳东北育才中学2020年高中毕业班教学质量监测卷理科综合化学试题山东省淄博市淄川中学2016-2017学年高二下学期学分认定(期末)考试化学试题河北省安平中学2016-2017学年高二下学期期末考试化学试题2017年全国普通高等学校招生统一考试理综化学(北京卷精编版)河北省涞水波峰中学2018届高三第一次调研考试化学试题江西省横峰中学、铅山一中、德兴一中2018届高三上学期第一次月考化学试题宁夏六盘山高级中学2018届高三上学期第一次月考化学试题山东省郓城实验中学2018届高三10月月考化学试题江西省铅山县第一中学2018届高三上学期第一次月考化学试题黑龙江省哈尔滨市第六中学2018届高三12月月考化学试题辽宁省大连渤海高级中学2018届高三上学期期末考试化学试题云南省玉溪第一中学2017-2018学年高一下学期4月月考化学试题云南省玉溪市玉溪一中2017-2018学年高一下学期4月月考化学试题内蒙古北方重工业集团有限公司第三中学2017-2018学年高一3月月考化学试题(已下线)《考前20天终极攻略》-5月21日 基础实验(已下线)《考前20天终极攻略》-5月26日 元素及其化合物(已下线)解密06 非金属及其化合物(教师版)——备战2018年高考化学之高频考点解密【全国市级联考】四川省广安市2017-2018学年高一下学期期末考试化学试题(已下线)2019高考备考一轮复习精品资料 第四章 常见的非金属及其化合物 第2讲 氧及其化合物【教学案】(已下线)2019高考备考一轮复习精品资料 第四章 常见的非金属及其化合物 第3讲 硫及其化合物【教学案】【全国百强校】北京市中央民族大学附属中学(朝阳分校)2019届高三上学期10月月考化学试题【全国百强校】宁夏回族自治区育才中学2019届高三上学期月考(二)化学试题云南省腾冲市第八中学2018-2019学年高二上学期期中考试化学试题【全国百强校】山东省济南市第一中学2019届高三上学期期中考试化学试题(已下线)2019高考热点题型和提分秘籍 第四章 常见的非金属及其化合物 第3讲 硫及其化合物 (教学案)【全国百强校】黑龙江省哈尔滨市第六中学2019届高三上学期12月月考化学试题(已下线)2019高考热点题型和提分秘籍 第四章 常见的非金属及其化合物 第1讲 碳、硅及无机非金属材料 (教学案)山东省德州市夏津县第一中学2019届高三上学期12月月考化学试题(已下线)2019高考备考二轮复习精品资料-专题6 非金属及其化合物(教学案)(已下线)2019高考备考二轮复习精品资料-专题6 非金属及其化合物(押题专练)(已下线)2019高考备考二轮复习精品资料-专题5 金属及其化合物(教学案)(已下线)2019年高考总复习巅峰冲刺-专题08 常见无机物及其应用应试策略河南省封丘县第一中学2018-2019学年高一下学期开学考试化学试题步步为赢 高二化学暑假作业:作业十三 化学实验综合内蒙古包头稀土高新区二中2020届高三10月月考理综化学试题四川省绵阳市南山中学2020届高三10月月考化学试题四川省成都石室中学2019-2020学年高二入学考试化学试题北京师范大学实验中学丰台学校2019-2020学年高三上学期期中考试化学试题2020届高三化学一轮复习 化学基础实验(选择题和大题训练)四川省成都市实验中学2020届高三上学期第十四次周考理科综合化学试题(已下线)专题01 硫及其化合物(核心素养卷)-【新教材精创】2019-2020学年高一化学新教材知识讲学(必修第二册)(已下线)专题六 元素化合物的性质、应用及转化(真题汇编)-2020年高考二轮模块化复习之《元素化合物》名师讲案与提分特训山东省济宁市汶上圣泽中学2019-2020学年高一下学期第二次月考化学试题安徽省黄山市八校联盟2019-2020学年高一下学期期中联考化学试题(已下线)专题4.3 硫及其化合物(练)——2020年高考化学一轮复习讲练测(已下线)专题4.3 硫及其化合物(讲)——2020年高考化学一轮复习讲练测云南省昆明市寻甸县民族中学2019-2020学年高一下学期第一次月考化学试题河北省衡水市桃城区第十四中学2019-2020学年高一下学期第二次综合测试化学试题黑龙江省大庆市第十中学2019-2020学年高二下学期期末考试化学试题四川省泸县第二中学2019-2020学年高一下学期期末模拟考试化学试题苏教版(2020)高一必修第一册专题4 总结检测(已下线)第15讲 硫及其化合物(精讲)——2021年高考化学一轮复习讲练测安徽省阜阳市阜南实验中学2020届高三下学期4月月考化学试题山东省济南市章丘区第四中学2021届高三上学期第一次教学质量检测(8月)化学试题黑龙江省哈尔滨市第三中学校2020-2021学年高三上学期第一次验收考试化学试题湖北省宜昌市葛洲坝中学2021届高三9月月考化学试题陕西省西安中学2018-2019学年高一下学期期末考试化学题湖南省邵阳市邵东县创新实验学校2021届高三上学期第一次月考化学试题(已下线)专题讲座(四) 常见气体的实验室制备、净化和收集(精练)-2021年高考化学一轮复习讲练测福建省莆田第二十五中学2021届高三上学期期中考试化学试题江西省鹰潭市2019-2020年度高一下学期期末检测化学试题辽宁沈阳市第二十八中学2020--2021学年高一上学期期末考试化学试题重庆市永川景圣中学2020-2021学年高三上学期第二次月考化学试题(已下线)第7周 晚练题-备战2022年高考化学周测与晚练(新高考专用)(已下线)化学(北京A卷)-学易金卷:2023年高考第一次模拟考试卷北京部分学校2025届高三高考化学模拟卷04 吉林省长春市第二十九中学2021届高三上学期期末考试化学试题专题4 第一单元综合拔高练-高中化学苏教2019版必修第一册河北省深州市长江中学2020-2021学年高一下学期3月底月考化学试题新疆维吾尔自治区巴州二中2021届高三第六次月考化学试题广东实验中学2020-201学年高一下学期期中考试化学(合格考)试题云南省楚雄天人中学2020-2021学年高一下学期3月月考化学(A)试题(已下线)课时22 硫及其化合物-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点11 硫及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点11 硫及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)第11讲 硫及其化合物(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)安徽省马鞍山市含山县第二中学2021-2022学年高三上学期第一次月考化学试题广西河池市高级中学2021-2022学年高三上学期第三次月考化学试题云南省丽江市第一高级中学2021-2022学年高二下学期4月月考化学试题(已下线)考点10 硫及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)北京市顺义牛栏山第一中学2021-2022学年高一下学期居家学习成果展示化学测试题北京师范大学附属中学2021-2022学年高一下学期期中考试化学试题(已下线)第11讲 硫及其化合物(讲)-2023年高考化学一轮复习讲练测(新教材新高考)甘肃省武威第十八中学2022-2023学年高三上学期第一次诊断化学试题黑龙江省哈尔滨市第三中学校2022-2023学年高三上学期第一次验收考试化学试题黑龙江省哈尔滨市第三中学校2022-2023学年高三上学期9月月考化学试题辽宁省本溪满族自治县高级中学2021-2022学年高一下学期开学考试化学试题黑龙江省哈尔滨市第十九中学2021-2022学年高三上学期第一次月考化学试题云南省红河县第一中学2020-2021学年高一下学期期末考试化学试题(已下线)题型48 SO2的制备与性质探究北京市顺义区第一中学2022-2023学年高一下学期3月月考化学试题宁夏银川市第二中学2022-2023学年高一下学期第一次月考化学试题山东省济宁市曲阜孔子高级中学2022-2023学年高一下学期4月月考化学试题黑龙江省齐齐哈尔市第八中学校2022-2023学年高一下学期3月月考化学试题广东省开平市忠源纪念中学2022-2023学年高一下学期4月期中考试化学试题广东省东莞市东华高级中学2022-2023学年高一下学期3月月考化学试题广东省深圳聚龙科学中学2022-2023学年高一下学期第一次段考(学业水平)化学试题广东省广州市广东实验中学2020-2021学年高一下学期期中考试(合格考)化学试题(已下线)第3讲 硫及其重要化合物北京市第二中学2022-2023学年高一下学期期末考试化学试题黑龙江省七台河市勃利县高级中学2022-2023学年高三上学期11月期中考试化学试题江苏省南菁高级中学2023-2024学年高一上学期9月阶段性检测化学(创优班)试题北京师范大学第二附属中学2023-2024学年高一下学期3月化学测试题陕西省咸阳市三原县北城中学2023-2024学年高一下学期第一次月考化学试题(已下线)专题01 硫、氮及其化合物-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(北京专用)新疆乌鲁木齐市第八中学2023-2024学年高一下学期期末考试化学试题湖南省岳阳市岳阳县第一中学2023-2024学年高一下学期7月期末考试化学试题河北省无极中学2023-2024学年高一下学期期中模拟(四)化学试题
名校
10 . 丙烯酸可与水反应生成乳酸,化学方程式如下。下列说法正确的是




| A.该反应为加成反应,没有副产物生成 |
B.可用 的 的 溶液鉴别丙烯酸和乳酸 溶液鉴别丙烯酸和乳酸 |
| C.丙烯酸与乳酸都属于有机酸,两者不发生反应 |
D. 乳酸分别与足量 乳酸分别与足量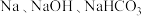 反应,消耗三者物质的量之比为 反应,消耗三者物质的量之比为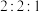 |
您最近一年使用:0次
2022-07-08更新
|
0次组卷
|
8卷引用:2017届贵州省黔东南州高三下学期高考模拟考试理综化学试卷



