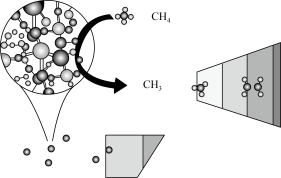
CH4在高温下的分解反应相当复杂,其原理属于游离基反应。随着反应温度的不同,CH4的分解产物为甲基-CH3、亚甲基-CH2-、次甲基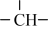 、氢原子H等,这些基团又可以相互结合形成诸多种类的物质,如2个亚甲基结合,就形成了乙烯、2个次甲基结合就形成的乙炔。一般规律是:温度越高,小分子量的产物就越多。
、氢原子H等,这些基团又可以相互结合形成诸多种类的物质,如2个亚甲基结合,就形成了乙烯、2个次甲基结合就形成的乙炔。一般规律是:温度越高,小分子量的产物就越多。
(2)已知相关物质的燃烧热如表,写出甲烷制备乙烯的热化学方程式
| 物质 | 燃烧热/(kJ·mol-1) |
| 氢气 | 285.8 |
| 甲烷 | 890.3 |
| 乙烯 | 1411.0 |
①在该温度下,其平衡常数K=
②若向该容器通入高温水蒸气(不参加反应,高于400℃),C2H4的产率将
③若容器体积固定,不同温度下可得变化如下图,则温度T1、T2的关系是
B.400℃时,C2H4、C2H6的体积分数分别为20.0%、6.0%,则体系中CH4的体积分数是
更新时间:2024-05-18 11:53:43
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】甲醇作为燃料,在化石能源和可再生能源时期均有广泛的应用前景。工业上常用天然气作为制备 的原料。已知:
的原料。已知:
①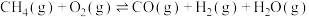
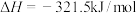
②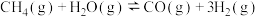
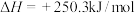
③
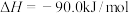
(1) 与
与 化合生成
化合生成 的热化学方程式是
的热化学方程式是___________ 。
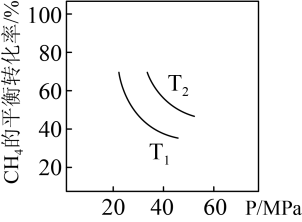
(2)利用③
 的原理:向恒容、体积为VL的密闭容器中充入1
的原理:向恒容、体积为VL的密闭容器中充入1
 与2
与2
 ,在不同压强下合成甲醇。
,在不同压强下合成甲醇。 的平衡转化率与温度、压强(P)的关系如下图所示:
的平衡转化率与温度、压强(P)的关系如下图所示:
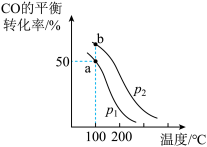
①以下能说明该反应达到平衡状态的是___________ 。
A.混合气体的密度保持不变 B.容器内总压强保持不变
C. 的体积分数保持不变 D.
的体积分数保持不变 D.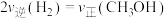
②压强
___________  (填“<”或“>”)
(填“<”或“>”)
③结合图像信息,计算b点时,该反应的平衡常数
___________ 。
④要提高 的转化率,可以采取的措施是
的转化率,可以采取的措施是___________ 。
a.升温 b.加入催化剂 c.增加 的浓度 d.加入
的浓度 d.加入 e.加入惰性气体 f.分离出甲醇
e.加入惰性气体 f.分离出甲醇
 的原料。已知:
的原料。已知:①
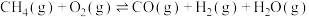
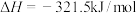
②
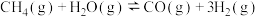
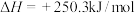
③

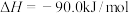
(1)
 与
与 化合生成
化合生成 的热化学方程式是
的热化学方程式是(2)利用③

 的原理:向恒容、体积为VL的密闭容器中充入1
的原理:向恒容、体积为VL的密闭容器中充入1
 与2
与2
 ,在不同压强下合成甲醇。
,在不同压强下合成甲醇。 的平衡转化率与温度、压强(P)的关系如下图所示:
的平衡转化率与温度、压强(P)的关系如下图所示:
①以下能说明该反应达到平衡状态的是
A.混合气体的密度保持不变 B.容器内总压强保持不变
C.
 的体积分数保持不变 D.
的体积分数保持不变 D.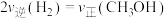
②压强

 (填“<”或“>”)
(填“<”或“>”)③结合图像信息,计算b点时,该反应的平衡常数

④要提高
 的转化率,可以采取的措施是
的转化率,可以采取的措施是a.升温 b.加入催化剂 c.增加
 的浓度 d.加入
的浓度 d.加入 e.加入惰性气体 f.分离出甲醇
e.加入惰性气体 f.分离出甲醇
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】甲醇是一种新型燃料,工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g) CH3OH(g) △H1=-116kJ/mol
CH3OH(g) △H1=-116kJ/mol
(1)已知:CO(g)+ O2(g)=CO2 (g) △H2=-283kJ/mol
O2(g)=CO2 (g) △H2=-283kJ/mol
H2(g) + O2(g)=H2O (g) △H1=-242kJ/mol
O2(g)=H2O (g) △H1=-242kJ/mol
则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式:________________
(2)在容积为1L的恒容容器中,分别研究在230℃、250℃、270℃三种温度下合成甲醇的规律。如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。
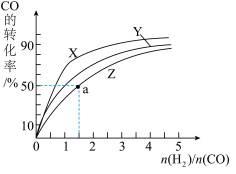
请回答:
①在上述三种温度中,曲线Z对应的温度是_________
②利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H2(g)=CH3OH(g)的平衡常数 K=_________ 。
③下列既能提高上述反应中 CO 的平衡转化率,又能增大反应速率的是____ (填标号)。
a.增大压强 b.降低温度 c.增大H2浓度 d.加高效催化剂
④若上述反应在某恒温恒容容器中发生,能说明该反应达到平衡的是____ (填标号)。
a.气体平均相对分子质量保持不变 b.△H1保持不变
c.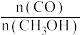 保持不变 d.气体密度保持不变
保持不变 d.气体密度保持不变
(3)在某温度下,将一定量的CO和H2投入10L的密闭容器中,5min时达到平衡,各物质的物质的浓度(mol/L)变化如下表所示:
若5min~10min只改变了某一条件,所改变的条件是______________ 。
 CH3OH(g) △H1=-116kJ/mol
CH3OH(g) △H1=-116kJ/mol(1)已知:CO(g)+
 O2(g)=CO2 (g) △H2=-283kJ/mol
O2(g)=CO2 (g) △H2=-283kJ/mol H2(g) +
 O2(g)=H2O (g) △H1=-242kJ/mol
O2(g)=H2O (g) △H1=-242kJ/mol则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式:
(2)在容积为1L的恒容容器中,分别研究在230℃、250℃、270℃三种温度下合成甲醇的规律。如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。

请回答:
①在上述三种温度中,曲线Z对应的温度是
②利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H2(g)=CH3OH(g)的平衡常数 K=
③下列既能提高上述反应中 CO 的平衡转化率,又能增大反应速率的是
a.增大压强 b.降低温度 c.增大H2浓度 d.加高效催化剂
④若上述反应在某恒温恒容容器中发生,能说明该反应达到平衡的是
a.气体平均相对分子质量保持不变 b.△H1保持不变
c.
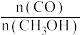 保持不变 d.气体密度保持不变
保持不变 d.气体密度保持不变(3)在某温度下,将一定量的CO和H2投入10L的密闭容器中,5min时达到平衡,各物质的物质的浓度(mol/L)变化如下表所示:
| 0min | 5min | 10min | |
| CO | 0.1 | 0.05 | |
| H2 | 0.2 | 0.2 | |
| CH3OH | 0 | 0.04 | 0.05 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】磷石膏是湿法生产磷酸的固体废弃物,用磷石膏生产硫酸或硫,既可减少对环境的污染又可使资源循环利用。
(1)已知:3CaSO4(s)+CaS(s)=4CaO(s)+4SO2(g) △H1=a kJ/mol
3CaS(s)+CaSO4(s)= 4CaO(s)+4S(s) △H2=b kJ/mol
则硫酸还原磷石膏的反应2CaSO4(s)+S(s)=2CaO(s)+3SO2(g) △H=_______ kJ/mol(用含a、b的代数式表示)。
(2)磷石膏转氨法制硫酸的主要反应为CaSO4(s)+(NH4)2CO3⇌CaCO3(s)+(NH4)2SO4,该反应的平衡常数K=_______ [已知: Ksp(CaCO3)=2.5×10-9,Ksp(CaSO4)=3.2×10-7]。
(3)一氧化碳还原CaSO4可发生下列反应,其lgKp与温度(T)的关系如图所示(Kp为以分压表示的平衡常数)。

I.SO2(g)+3CO(g)⇌2CO2(g)+COS(g)
II.CaSO4(s)+CO(g)⇌CaO(s)+CO2(g)+SO2(g)
①△H>0的反应是_______ (填“I”或“II”)。
②在交点A处,气体分压间满足的关系是:p(COS)=_______ 。
③在恒温恒容密闭容器中进行反应(I),能说明已达到平衡状态的是_______ (填字母)。
a. 2v(CO)正=3v(CO2)正
b.气体的密度不再随时间变化
c.气体的压强不再随时间变化
d.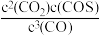 的值不再随时间而变化
的值不再随时间而变化
④若在1.0L的恒容密闭容器中加入1molCaSO4,并充入1molCO,只发生反应II,在B点时气体总压强为1 MPa,则此时CaSO4转化率为_______ (已知 =1.41)。
=1.41)。
(1)已知:3CaSO4(s)+CaS(s)=4CaO(s)+4SO2(g) △H1=a kJ/mol
3CaS(s)+CaSO4(s)= 4CaO(s)+4S(s) △H2=b kJ/mol
则硫酸还原磷石膏的反应2CaSO4(s)+S(s)=2CaO(s)+3SO2(g) △H=
(2)磷石膏转氨法制硫酸的主要反应为CaSO4(s)+(NH4)2CO3⇌CaCO3(s)+(NH4)2SO4,该反应的平衡常数K=
(3)一氧化碳还原CaSO4可发生下列反应,其lgKp与温度(T)的关系如图所示(Kp为以分压表示的平衡常数)。

I.SO2(g)+3CO(g)⇌2CO2(g)+COS(g)
II.CaSO4(s)+CO(g)⇌CaO(s)+CO2(g)+SO2(g)
①△H>0的反应是
②在交点A处,气体分压间满足的关系是:p(COS)=
③在恒温恒容密闭容器中进行反应(I),能说明已达到平衡状态的是
a. 2v(CO)正=3v(CO2)正
b.气体的密度不再随时间变化
c.气体的压强不再随时间变化
d.
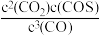 的值不再随时间而变化
的值不再随时间而变化④若在1.0L的恒容密闭容器中加入1molCaSO4,并充入1molCO,只发生反应II,在B点时气体总压强为1 MPa,则此时CaSO4转化率为
 =1.41)。
=1.41)。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】以天然气为原料合成甲醇。有关热化学方程式如下:
①2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH1=-70.8 kJ·mol-1
②CO(g)+2H2(g) CH3OH(g) ΔH2
CH3OH(g) ΔH2
③2CH4(g)+O2(g) 2CH3OH(g) ΔH3=-251.0 kJ·mol-1
2CH3OH(g) ΔH3=-251.0 kJ·mol-1
(1)ΔH2=____ kJ·mol-1。
(2)在恒容密闭容器里,按物质的量比1:1加入一定量的碳和水蒸气反应生成水煤气。一定条件下达到平衡,当改变反应的某一条件时,下列变化能说明平衡一定向正反应方向移动的是_________ 。(填序号)
A.正反应速率先增大后减少 B.化学平衡常数K减少
C.再加入一定量碳 D.反应物气体体积分数增大
(3)在体积可变的密闭容器中投入1 mol CO和2 mol H2,在不同条件下发生反应:
CO(g)+2H2(g) CH3OH(g)。实验测得CH3OH的物质的量随温度、压强的变化如图所示。
CH3OH(g)。实验测得CH3OH的物质的量随温度、压强的变化如图所示。
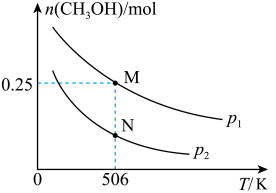
①该反应自发进行的条件是_____________ (填“低温”、“高温”或“任意温度”)
②506 K时,反应平衡时H2的转化率为___ ;压强:p1_____ (填“>”“<”或“=”) p2。
③反应速率:N点v正(CO)____ (填“>”“<”或“=”)M点v逆(CO)。
④若压强为p1、在1 L恒容密闭容器中进行上述反应(起始投料不变),在不同温度下上述反应的平衡常数的对数(lg K)如图所示。则温度为506 K时,平衡常数K=____ (保留三位小数),B、C、D、E四点中能正确表示该反应的lg K与T的关系的点为____ 。
(4)在2 L恒容密闭容器中充入a(a>0) mol H2、2 mol CO和7.4 mol CH3OH(g),在506 K下进行上述反应。为了使该反应逆向进行,a的范围为________ 。
①2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH1=-70.8 kJ·mol-1
②CO(g)+2H2(g)
 CH3OH(g) ΔH2
CH3OH(g) ΔH2③2CH4(g)+O2(g)
 2CH3OH(g) ΔH3=-251.0 kJ·mol-1
2CH3OH(g) ΔH3=-251.0 kJ·mol-1(1)ΔH2=
(2)在恒容密闭容器里,按物质的量比1:1加入一定量的碳和水蒸气反应生成水煤气。一定条件下达到平衡,当改变反应的某一条件时,下列变化能说明平衡一定向正反应方向移动的是
A.正反应速率先增大后减少 B.化学平衡常数K减少
C.再加入一定量碳 D.反应物气体体积分数增大
(3)在体积可变的密闭容器中投入1 mol CO和2 mol H2,在不同条件下发生反应:
CO(g)+2H2(g)
 CH3OH(g)。实验测得CH3OH的物质的量随温度、压强的变化如图所示。
CH3OH(g)。实验测得CH3OH的物质的量随温度、压强的变化如图所示。
①该反应自发进行的条件是
②506 K时,反应平衡时H2的转化率为
③反应速率:N点v正(CO)
④若压强为p1、在1 L恒容密闭容器中进行上述反应(起始投料不变),在不同温度下上述反应的平衡常数的对数(lg K)如图所示。则温度为506 K时,平衡常数K=
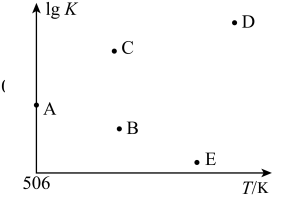
(4)在2 L恒容密闭容器中充入a(a>0) mol H2、2 mol CO和7.4 mol CH3OH(g),在506 K下进行上述反应。为了使该反应逆向进行,a的范围为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】CO是合成尿素、甲酸的原料。
(1)在100 kPa和T K下,由稳定单质生成1 mol化合物的焓变称为该物质在T K时的标准摩尔生成焓,用符号ΔHθ表示。已知石墨和一氧化碳的燃烧热分别为393.5 kJ·mol-1和283.0 kJ·mol-1,则CO(g)的ΔHθ=_________ 。
(2)合成尿素的反应:2NH3(g)+CO(g)⇌CO(NH2)2(g)+H2(g) ΔH=-81.0 kJ·mol-1;T℃时,在体积为2 L 的恒容密闭容器中,将2 mol的NH3和1 mol CO混合反应,5 min时,NH3的转化率为80%。则0~5 min平均反应速率为v(CO)=_________ 。
已知:
则:K1________ (填“>”或“<”)126.5;其判断理由是__________ 。
(3)若保持恒温恒容条件,将物质的量之和为3 mol的NH3和CO以不同的氨碳比进行反应,结果如图所示:

①若图中c表示平衡体系中尿素的体积分数,则a表示________ 的转化率。
②当 =
=________ 时,尿素含量最大;在该条件下,对于该反应既能增大反应速率又能使平衡正向移动的措施是_____ (写一种)。
(1)在100 kPa和T K下,由稳定单质生成1 mol化合物的焓变称为该物质在T K时的标准摩尔生成焓,用符号ΔHθ表示。已知石墨和一氧化碳的燃烧热分别为393.5 kJ·mol-1和283.0 kJ·mol-1,则CO(g)的ΔHθ=
(2)合成尿素的反应:2NH3(g)+CO(g)⇌CO(NH2)2(g)+H2(g) ΔH=-81.0 kJ·mol-1;T℃时,在体积为2 L 的恒容密闭容器中,将2 mol的NH3和1 mol CO混合反应,5 min时,NH3的转化率为80%。则0~5 min平均反应速率为v(CO)=
已知:
| 温度/K | 398 | 498 | … |
| 平衡常数(K) | 126.5 | K1 | … |
则:K1
(3)若保持恒温恒容条件,将物质的量之和为3 mol的NH3和CO以不同的氨碳比进行反应,结果如图所示:

①若图中c表示平衡体系中尿素的体积分数,则a表示
②当
 =
=
您最近一年使用:0次
【推荐3】新型材料 AIN 应用前景广泛,对其制备过程的研究成为热点。
(1)将物质的量均为a mol 的 Al2O3与N2充入恒温恒容密闭容器中,控制温度发生反应:2Al2O3(s)+2N2(g) 4AlN(s) +3O2(g) △H>0。
4AlN(s) +3O2(g) △H>0。
①下列可作为反应达到平衡的判据是_________ (填序号)。
A.固体的质量不再改变
B.2v正(N2)=3v逆(O 2)
C.△H 不变
D.容器内气体的压强不变
E.N2分子数与 O2分子数比为 2:3
②在起始压强为p的反应体系中,平衡时 N2的转化率为α,则上述反应的平衡常数 Kp__________ (对于气相反应,用某组分 B 的平衡压强 p(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kp,如p(B) =p总·x(B) ,p总为平衡总压强,x(B)为平衡系统中B的物质的量分数)。
③为促进反应的进行,实际生产中需加入焦炭,其原因是____________ 。
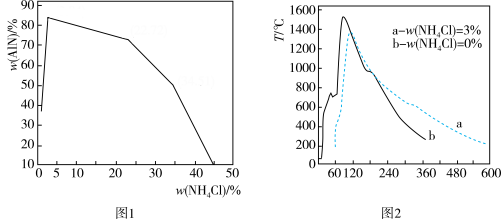
(2)铝粉与 N2在一定温度下可直接生成 AlN, 加入少量 NH4Cl 固体可促进反应。将等质量的A1粉与不同量的 NH4Cl混合均匀后置于充 N2的密闭容器中,电火花引燃,产品中 AlN的质量分数[ω(AlN)] 随原料中ω(NH4Cl)的变化如图1所示,燃烧过程中温度随时间变化如图2所示。则:
①固体混合物中,ω(NH4Cl)的最佳选择是__________ 。
②结合图2解释当ω(NH4Cl)超过一定值后,ω(AlN)明显减少的原因__________ 。
(3)AIN粉末会缓慢发生水解反应,粒径为100 nm 的 AlN 粉末水解时溶液 pH的变化如图3 所示。
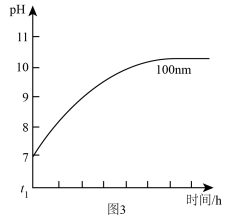
①AlN 粉末水解的化学方程式是______________ 。
②相同条件下,请在图3中画出粒径为40 nm 的AlN粉末水解的变化曲线____________ 。
(1)将物质的量均为a mol 的 Al2O3与N2充入恒温恒容密闭容器中,控制温度发生反应:2Al2O3(s)+2N2(g)
 4AlN(s) +3O2(g) △H>0。
4AlN(s) +3O2(g) △H>0。①下列可作为反应达到平衡的判据是
A.固体的质量不再改变
B.2v正(N2)=3v逆(O 2)
C.△H 不变
D.容器内气体的压强不变
E.N2分子数与 O2分子数比为 2:3
②在起始压强为p的反应体系中,平衡时 N2的转化率为α,则上述反应的平衡常数 Kp
③为促进反应的进行,实际生产中需加入焦炭,其原因是
(2)铝粉与 N2在一定温度下可直接生成 AlN, 加入少量 NH4Cl 固体可促进反应。将等质量的A1粉与不同量的 NH4Cl混合均匀后置于充 N2的密闭容器中,电火花引燃,产品中 AlN的质量分数[ω(AlN)] 随原料中ω(NH4Cl)的变化如图1所示,燃烧过程中温度随时间变化如图2所示。则:
①固体混合物中,ω(NH4Cl)的最佳选择是
②结合图2解释当ω(NH4Cl)超过一定值后,ω(AlN)明显减少的原因

(3)AIN粉末会缓慢发生水解反应,粒径为100 nm 的 AlN 粉末水解时溶液 pH的变化如图3 所示。

①AlN 粉末水解的化学方程式是
②相同条件下,请在图3中画出粒径为40 nm 的AlN粉末水解的变化曲线
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料.从天然气获得合成气过程中可能发生的反应有:
①CH4(g)+H2O(g) CO(g)+3H2(g) △H1=+206.1kJ/mol
CO(g)+3H2(g) △H1=+206.1kJ/mol
②CH4(g)+CO2(g) 2CO(g)+2H2(g) △H2=+247.3kJ/mol
2CO(g)+2H2(g) △H2=+247.3kJ/mol
③CO(g)+H2O(g) CO2(g)+H2(g) △H3=-41.2kJ/mol
CO2(g)+H2(g) △H3=-41.2kJ/mol


请回答下列问题:
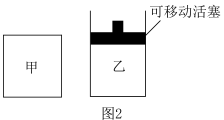
(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示.反应进行的前5min内,v (H2)=_____ ;10min时,改变的外界条件可能是________ 。
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等.在相同温度下发生反应②,并维持反应过程中温度不变.已知甲容器中CH4的转化率随时间变化的图象如图3所示,请在图3中画出乙容器中CH4的转化率随时间变化的图象_____ 。
(3)800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
此时反应③中正、逆反应速率的关系式是____________ (填代号)。
a.v(正)>v (逆) b.v(正)<v (逆)
c.v(正)= v (逆) d.无法判断.
①CH4(g)+H2O(g)
 CO(g)+3H2(g) △H1=+206.1kJ/mol
CO(g)+3H2(g) △H1=+206.1kJ/mol②CH4(g)+CO2(g)
 2CO(g)+2H2(g) △H2=+247.3kJ/mol
2CO(g)+2H2(g) △H2=+247.3kJ/mol③CO(g)+H2O(g)
 CO2(g)+H2(g) △H3=-41.2kJ/mol
CO2(g)+H2(g) △H3=-41.2kJ/mol


请回答下列问题:
(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示.反应进行的前5min内,v (H2)=
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等.在相同温度下发生反应②,并维持反应过程中温度不变.已知甲容器中CH4的转化率随时间变化的图象如图3所示,请在图3中画出乙容器中CH4的转化率随时间变化的图象
(3)800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
此时反应③中正、逆反应速率的关系式是
a.v(正)>v (逆) b.v(正)<v (逆)
c.v(正)= v (逆) d.无法判断.
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
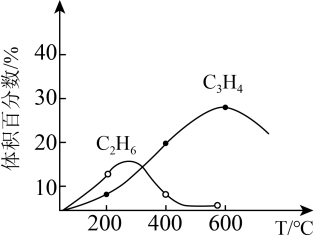
【推荐2】甲烧催化裂解是工业上制备乙炔的方法之一。回答下列问题:
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H1=-885 kJ/mol
2C2H2(g)+5O2(8)=4CO2(g)+2H2O(l) △H2= -2600 kJ/mol
2H2(g)+O2(g)=2H2O(l) △H3 =-572 kJ/mol
则2CH4(g)=C2H2(g)+3H2(g) △H=_______ kJ/mol
(2)某科研小组尝试利用固体表面催化工艺进行CH4的裂解。_______ 。 C2H4(g) + 2H2 (g),达到平衡时,测得p(H2)=p(CH4)。CH4的平衡转化率为
C2H4(g) + 2H2 (g),达到平衡时,测得p(H2)=p(CH4)。CH4的平衡转化率为_______ (结果保留两位有效数字)。
②在图中,T°C时,化学反应2CH4(g) C2H2(g)+ 3H2(g)的压强平衡常数Kp=
C2H2(g)+ 3H2(g)的压强平衡常数Kp=_______ Pa2。
(4)CH4在催化剂作用下吸收二氧化碳反应为:CH4(g)+CO2(g) 2CO(g)+2H2(g) △H= +120 kJ·mol-1,按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率的影响如图所示。此反应优选温度为900°C的原因是
2CO(g)+2H2(g) △H= +120 kJ·mol-1,按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率的影响如图所示。此反应优选温度为900°C的原因是_______ 。
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H1=-885 kJ/mol
2C2H2(g)+5O2(8)=4CO2(g)+2H2O(l) △H2= -2600 kJ/mol
2H2(g)+O2(g)=2H2O(l) △H3 =-572 kJ/mol
则2CH4(g)=C2H2(g)+3H2(g) △H=
(2)某科研小组尝试利用固体表面催化工艺进行CH4的裂解。
①若用 分别表示CH4、C2H2、H2和固体催化剂,在固体催化剂表面CH4的裂解过程如图所示,从吸附到解吸的过程中,能量状态最高的是
分别表示CH4、C2H2、H2和固体催化剂,在固体催化剂表面CH4的裂解过程如图所示,从吸附到解吸的过程中,能量状态最高的是



 C2H4(g) + 2H2 (g),达到平衡时,测得p(H2)=p(CH4)。CH4的平衡转化率为
C2H4(g) + 2H2 (g),达到平衡时,测得p(H2)=p(CH4)。CH4的平衡转化率为②在图中,T°C时,化学反应2CH4(g)
 C2H2(g)+ 3H2(g)的压强平衡常数Kp=
C2H2(g)+ 3H2(g)的压强平衡常数Kp=(4)CH4在催化剂作用下吸收二氧化碳反应为:CH4(g)+CO2(g)
 2CO(g)+2H2(g) △H= +120 kJ·mol-1,按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率的影响如图所示。此反应优选温度为900°C的原因是
2CO(g)+2H2(g) △H= +120 kJ·mol-1,按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率的影响如图所示。此反应优选温度为900°C的原因是
您最近一年使用:0次
【推荐3】恒温T、恒压P下,向密闭容器中充入1mol正丁烷,发生以下反应:
反应1: (g)
(g)
 (g,顺-2-丁烯)+H2(g) K1 ΔH1
(g,顺-2-丁烯)+H2(g) K1 ΔH1
反应2: (g)
(g)
 (g,反-2-丁烯)+H2(g) K2 ΔH2
(g,反-2-丁烯)+H2(g) K2 ΔH2
反应3: (g,顺-2-丁烯)
(g,顺-2-丁烯)
 (g,反-2-丁烯) K3 ΔH3
(g,反-2-丁烯) K3 ΔH3
已知:lnK=- +C,其中K为平衡常数,T为温度(单位:K)R、C均为常数。反应1和反应2的lnK随
+C,其中K为平衡常数,T为温度(单位:K)R、C均为常数。反应1和反应2的lnK随 变化关系曲线如图所示:
变化关系曲线如图所示:
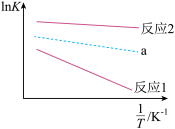
回答下列问题:
(1)ΔH3=_________ (用ΔH1、ΔH2表示);K3=________ (用K1、K2表示)。
(2)由图可推知,ΔH1_______ 0(填“>”、“<“”或“=”,下同);ΔH3_______ 0。
(3)判断下列说法正确的是_______ 。
A.断开1mol碳碳双键的同时生成1molH-H时,反应达到平衡状态
B.稳定性:反-2-丁烯>顺-2-丁烯
C.图中a可表示为反应3中lnK随 的变化曲线
的变化曲线
D.向平衡体系中再充入1mol正丁烷,平衡后氢气的物质的量为原来的2倍
E.减小压强至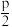 ,顺-2-丁烯的物质的量不变
,顺-2-丁烯的物质的量不变
(4)已知:对于反应mA(g)+nB(g) pC(g)+qD(g),Kx=
pC(g)+qD(g),Kx=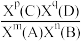 ,X为物质的量分数。若上述反应达平衡时,n(H2)=amol,反应3的Kx=b,则反应1的Kx=
,X为物质的量分数。若上述反应达平衡时,n(H2)=amol,反应3的Kx=b,则反应1的Kx=________ (用a、b表示)。
反应1:
 (g)
(g)
 (g,顺-2-丁烯)+H2(g) K1 ΔH1
(g,顺-2-丁烯)+H2(g) K1 ΔH1反应2:
 (g)
(g)
 (g,反-2-丁烯)+H2(g) K2 ΔH2
(g,反-2-丁烯)+H2(g) K2 ΔH2反应3:
 (g,顺-2-丁烯)
(g,顺-2-丁烯)
 (g,反-2-丁烯) K3 ΔH3
(g,反-2-丁烯) K3 ΔH3已知:lnK=-
 +C,其中K为平衡常数,T为温度(单位:K)R、C均为常数。反应1和反应2的lnK随
+C,其中K为平衡常数,T为温度(单位:K)R、C均为常数。反应1和反应2的lnK随 变化关系曲线如图所示:
变化关系曲线如图所示:
回答下列问题:
(1)ΔH3=
(2)由图可推知,ΔH1
(3)判断下列说法正确的是
A.断开1mol碳碳双键的同时生成1molH-H时,反应达到平衡状态
B.稳定性:反-2-丁烯>顺-2-丁烯
C.图中a可表示为反应3中lnK随
 的变化曲线
的变化曲线D.向平衡体系中再充入1mol正丁烷,平衡后氢气的物质的量为原来的2倍
E.减小压强至
 ,顺-2-丁烯的物质的量不变
,顺-2-丁烯的物质的量不变(4)已知:对于反应mA(g)+nB(g)
 pC(g)+qD(g),Kx=
pC(g)+qD(g),Kx=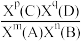 ,X为物质的量分数。若上述反应达平衡时,n(H2)=amol,反应3的Kx=b,则反应1的Kx=
,X为物质的量分数。若上述反应达平衡时,n(H2)=amol,反应3的Kx=b,则反应1的Kx=
您最近一年使用:0次



