名校
1 . 法匹拉韦(有机物Ⅰ)是一种广谱抗病毒仿制药,其含有的环状结构与苯的共辄结构类似。一种合成法匹拉韦的路线如图所示:
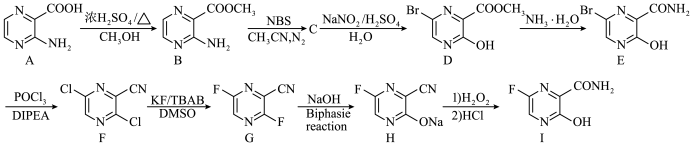
已知:① ;
;
②
 ;
;③化合物F、G不易分离,萃取剂的极性过大则常得到黑色糊状物,过小则萃取率不高。
回答下列问题:
(1)化合物B中含氧官能团的名称为
(2)C的结构简式为
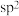 杂化的C原子个数是
杂化的C原子个数是(3)D的同分异构体J满足下列条件:
①J与其一种水解产物均可以发生银镜反应;
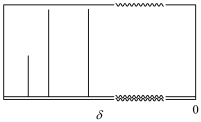
②J的 谱如图所示;
谱如图所示;
③J含有两种含氧官能团,不存在两个氧原子相连或氧原子与溴原子相连的情况;
④J含有环状结构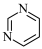 。
。
请写出J的结构简式:
(4)请写出G到H的化学方程式
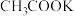 或
或 换为NaOH,请从产率与经济性的角度分析本工艺的优点:
换为NaOH,请从产率与经济性的角度分析本工艺的优点:(5)根据已有知识并结合相关信息,将以A为原料制备
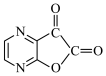 的合成路线补充完整。
的合成路线补充完整。
您最近一年使用:0次
2024-03-21更新
|
1021次组卷
|
4卷引用:湖南省株洲市第一中学2021届高三下学期第二次模拟检测化学试题
湖南省株洲市第一中学2021届高三下学期第二次模拟检测化学试题湖南省长沙市长郡中学2023-2024学年高三模拟考试(一)化学试题(已下线)专题11 有机推断综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)福建省宁德市福古霞三校2024届高三3月份适应性检测化学试题
2 . 常温下,向含 、
、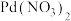 和
和 的溶液中滴加KSCN溶液,浊液中
的溶液中滴加KSCN溶液,浊液中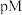 [
[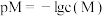 ,
,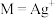 、
、 或
或 ]与
]与 的关系如图所示。已知:常温下,
的关系如图所示。已知:常温下,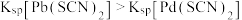 ,平衡常数K大于
,平衡常数K大于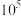 时认为该反应能完全进行。
时认为该反应能完全进行。
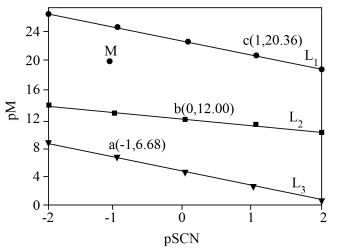
下列叙述错误的是
 、
、 和
和 的溶液中滴加KSCN溶液,浊液中
的溶液中滴加KSCN溶液,浊液中 [
[ ,
,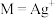 、
、 或
或 ]与
]与 的关系如图所示。已知:常温下,
的关系如图所示。已知:常温下,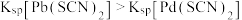 ,平衡常数K大于
,平衡常数K大于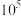 时认为该反应能完全进行。
时认为该反应能完全进行。
下列叙述错误的是
A.直线 代表pPd与pSCN的关系 代表pPd与pSCN的关系 |
B.饱和AgSCN溶液中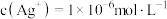 |
C.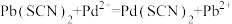 不可逆 不可逆 |
D.M点溶液可析出AgSCN和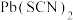 |
您最近一年使用:0次
2024-03-10更新
|
249次组卷
|
2卷引用:湖南省株洲市第一中学2021届高三第一次模拟检测化学试题
名校
3 .  为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A.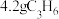 中含有 中含有 键数目可能为 键数目可能为 |
B. ( (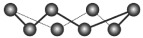 )分子中所含共价键数为 )分子中所含共价键数为 |
C. 质量分数为98%的 质量分数为98%的 ,用水稀释至 ,用水稀释至 的质量分数为9.8% 的质量分数为9.8% |
D.完全燃烧生成 和 和 物质的量之比为 物质的量之比为 的有机物一定为 的有机物一定为 |
您最近一年使用:0次
2024-03-09更新
|
552次组卷
|
2卷引用:湖南省株洲市第一中学2021届高三下学期第二次模拟检测化学试题
名校
解题方法
4 . 丙胺卡因(Ⅰ)是一种局部麻醉药物,应用于医学、科研和工业等领域。其合成路线如下所示:
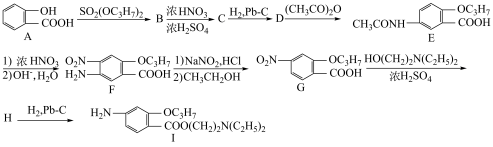
(1) 的系统名称为
的系统名称为________ ,沸点:A_____ (填“大于”或“小于”)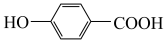
(2)C的结构简式为________ ;D的官能团名称为_________ 。
(3)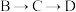 依次发生的化学反应类型为
依次发生的化学反应类型为________ 、_________ 。
(4)写出 的化学反应方程式:
的化学反应方程式:___________ 。
(5)J是 的同分异构体,满足以下条件的
的同分异构体,满足以下条件的 有
有___________ 种。
①有两种官能团,遇氯化铁溶液显色 ②苯环上有两个取代基
(6)已知:苯环连有−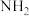 使苯环的邻对位氢原子活化,易被其他原子或原子团取代,苯环连有一
使苯环的邻对位氢原子活化,易被其他原子或原子团取代,苯环连有一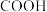 时,新进入的取代基主要进入它的间位,同时使苯环钝化。若以苯甲酸为原料(其他试剂自选),制备
时,新进入的取代基主要进入它的间位,同时使苯环钝化。若以苯甲酸为原料(其他试剂自选),制备 的合成路线为
的合成路线为________ 。

(1)
 的系统名称为
的系统名称为
(2)C的结构简式为
(3)
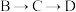 依次发生的化学反应类型为
依次发生的化学反应类型为(4)写出
 的化学反应方程式:
的化学反应方程式:(5)J是
 的同分异构体,满足以下条件的
的同分异构体,满足以下条件的 有
有①有两种官能团,遇氯化铁溶液显色 ②苯环上有两个取代基
(6)已知:苯环连有−
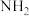 使苯环的邻对位氢原子活化,易被其他原子或原子团取代,苯环连有一
使苯环的邻对位氢原子活化,易被其他原子或原子团取代,苯环连有一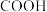 时,新进入的取代基主要进入它的间位,同时使苯环钝化。若以苯甲酸为原料(其他试剂自选),制备
时,新进入的取代基主要进入它的间位,同时使苯环钝化。若以苯甲酸为原料(其他试剂自选),制备 的合成路线为
的合成路线为
您最近一年使用:0次
2024-03-02更新
|
269次组卷
|
4卷引用:湖南省宁乡市第一高级中学2021届高三第二次模拟考试化学试卷
名校
5 . 以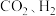 为原料合成
为原料合成 涉及的反应如下:
涉及的反应如下:
I.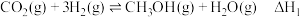
Ⅱ.
Ⅲ.
回答下列问题:
(1)计算反应I的
___________  ,该反应在
,该反应在___________ (填“高温”、“低温”或“任意温度”)下能自发。
(2)在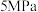 下,按照
下,按照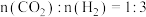 投料,假设只发生反应I和Ⅱ,平衡时,
投料,假设只发生反应I和Ⅱ,平衡时, 和
和 在含碳产物物质的量分数及
在含碳产物物质的量分数及 的转化率随温度的变化如图:
的转化率随温度的变化如图:
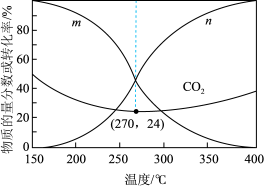
①图中代表 的曲线为
的曲线为___________ (填“m”或“n”)。
②解释 范围内
范围内 转化率随温度升高而降低的原因
转化率随温度升高而降低的原因___________ 。
③下列说法正确的是___________ (填字母)。
A.温度越高,越有利于工业生产
B. 范围内,温度升高,
范围内,温度升高, 的平衡产量先减小后增大
的平衡产量先减小后增大
C.随着温度逐渐升高,混合气体的平均相对分子质量几乎又变回起始的状态
④已知气体分压=气体总压×气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数 ;则
;则 时
时 的分压为
的分压为___________  (用最简分数),反应II的平衡常数
(用最简分数),反应II的平衡常数 为
为___________ (列出算式即可)。
 为原料合成
为原料合成 涉及的反应如下:
涉及的反应如下:I.
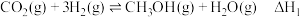
Ⅱ.

Ⅲ.

回答下列问题:
(1)计算反应I的

 ,该反应在
,该反应在(2)在
 下,按照
下,按照 投料,假设只发生反应I和Ⅱ,平衡时,
投料,假设只发生反应I和Ⅱ,平衡时, 和
和 在含碳产物物质的量分数及
在含碳产物物质的量分数及 的转化率随温度的变化如图:
的转化率随温度的变化如图:
①图中代表
 的曲线为
的曲线为②解释
 范围内
范围内 转化率随温度升高而降低的原因
转化率随温度升高而降低的原因③下列说法正确的是
A.温度越高,越有利于工业生产

B.
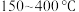 范围内,温度升高,
范围内,温度升高, 的平衡产量先减小后增大
的平衡产量先减小后增大C.随着温度逐渐升高,混合气体的平均相对分子质量几乎又变回起始的状态
④已知气体分压=气体总压×气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数
 ;则
;则 时
时 的分压为
的分压为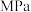 (用最简分数),反应II的平衡常数
(用最简分数),反应II的平衡常数 为
为
您最近一年使用:0次
2024-03-02更新
|
119次组卷
|
2卷引用:湖南省宁乡市第一高级中学2021届高三第三次模拟考试化学试卷
名校
6 . 无水氯化铁,在空气中极易潮解,加热易升华,常应用于金属蚀刻和污水处理。某化学兴趣小组设计如下实验制备无水氯化铁,并进行其性质探究。回答下列问题:
I.无水氯化铁的制备
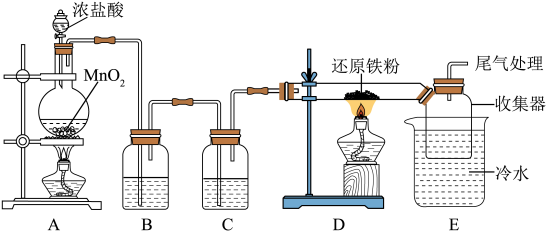
(1)盛装浓盐酸的仪器名称是_______ ,装置B中盛装的药品是_______ ,装置C的作用是_______ 。
(2)装置D中发生反应的化学方程式为_______ 。
(3)装置D、E之间用大口径玻璃管连接的原因是_______ 。
Ⅱ.氯化铁性质探究
(4)取收集器中固体配制成 溶液。所需的玻璃仪器主要有量筒、玻璃棒、烧杯、胶头滴管和
溶液。所需的玻璃仪器主要有量筒、玻璃棒、烧杯、胶头滴管和_______ 配制溶液时,应先将氯化铁固体溶于较浓的盐酸中,盐酸的作用是_______ 。
(5)向甲、乙两支试管中分别加入 溶液,向甲试管中滴加
溶液,向甲试管中滴加 溶液,试管中溶液由黄色变为红褐色,并有沉淀生成,振荡后沉淀消失,继续滴加
溶液,试管中溶液由黄色变为红褐色,并有沉淀生成,振荡后沉淀消失,继续滴加 溶液,溶液颜色加深,放置一小时后溶液变为绿色。向乙试管中滴加
溶液,溶液颜色加深,放置一小时后溶液变为绿色。向乙试管中滴加 溶液,试管中溶液由黄色变为红褐色,没有沉淀生成,继续滴加
溶液,试管中溶液由黄色变为红褐色,没有沉淀生成,继续滴加 溶液,溶液颜色加深,放置一小时后溶液变为绿色。
溶液,溶液颜色加深,放置一小时后溶液变为绿色。
①甲试管中产生沉淀的化学式为_______ ,利用平衡移动原理解释产生该沉淀的原因:_______ 。
②甲、乙两支试管中最终溶液都变为绿色,发生反应的离子方程式为_______ 。
I.无水氯化铁的制备

(1)盛装浓盐酸的仪器名称是
(2)装置D中发生反应的化学方程式为
(3)装置D、E之间用大口径玻璃管连接的原因是
Ⅱ.氯化铁性质探究
(4)取收集器中固体配制成
 溶液。所需的玻璃仪器主要有量筒、玻璃棒、烧杯、胶头滴管和
溶液。所需的玻璃仪器主要有量筒、玻璃棒、烧杯、胶头滴管和(5)向甲、乙两支试管中分别加入
 溶液,向甲试管中滴加
溶液,向甲试管中滴加 溶液,试管中溶液由黄色变为红褐色,并有沉淀生成,振荡后沉淀消失,继续滴加
溶液,试管中溶液由黄色变为红褐色,并有沉淀生成,振荡后沉淀消失,继续滴加 溶液,溶液颜色加深,放置一小时后溶液变为绿色。向乙试管中滴加
溶液,溶液颜色加深,放置一小时后溶液变为绿色。向乙试管中滴加 溶液,试管中溶液由黄色变为红褐色,没有沉淀生成,继续滴加
溶液,试管中溶液由黄色变为红褐色,没有沉淀生成,继续滴加 溶液,溶液颜色加深,放置一小时后溶液变为绿色。
溶液,溶液颜色加深,放置一小时后溶液变为绿色。①甲试管中产生沉淀的化学式为
②甲、乙两支试管中最终溶液都变为绿色,发生反应的离子方程式为
您最近一年使用:0次
2024-03-02更新
|
111次组卷
|
2卷引用:湖南省宁乡市第一高级中学2021届高三第三次模拟考试化学试卷
名校
7 . 合成氨厂和硝酸厂的烟气中含有大量的氮氧化物,脱硝是指将烟气中的氮氧化物转化为无毒无害物质的化学过程。回答下列问题:
(1)已知反应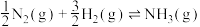 的活化能为
的活化能为 ,合成氨有关化学键的键能如下表:
,合成氨有关化学键的键能如下表:
则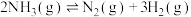 的活化能为
的活化能为___________  。
。
(2)在一定条件下,向某反应容器中投入5molN2、15molH2在不同温度(T)下发生反应: ,平衡体系中
,平衡体系中 的质量分数随平衡时气体总压强变化的曲线如图所示。
的质量分数随平衡时气体总压强变化的曲线如图所示。

①T1、T2、T3中,温度最低的是___________ 。
②M点时, 的转化率为
的转化率为___________ 。
③下列情况能说明反应达到平衡状态的是___________ (填标号)。
A.2v(NH3)=3v(H2)
B.混合气体的相对分子质量不再变化
C.N2体积分数不再变化
D.恒容容器中混合气体的密度保持不变
(3)利用NaClO2/H2O2酸性复合吸收剂可同时对NO、SO2进行氧化得到硝酸和硫酸而除去。在温度一定时, 和溶液的pH对脱硫、脱硝的影响如图所示:
和溶液的pH对脱硫、脱硝的影响如图所示:

由图可知,脱硫、脱硝的最佳条件是___________(填标号)。
(1)已知反应
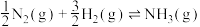 的活化能为
的活化能为 ,合成氨有关化学键的键能如下表:
,合成氨有关化学键的键能如下表:| 化学键 | H-H |  | N-H |
键能/( ) ) | 436 | 946 | 391 |
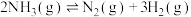 的活化能为
的活化能为 。
。(2)在一定条件下,向某反应容器中投入5molN2、15molH2在不同温度(T)下发生反应:
 ,平衡体系中
,平衡体系中 的质量分数随平衡时气体总压强变化的曲线如图所示。
的质量分数随平衡时气体总压强变化的曲线如图所示。
①T1、T2、T3中,温度最低的是
②M点时,
 的转化率为
的转化率为③下列情况能说明反应达到平衡状态的是
A.2v(NH3)=3v(H2)
B.混合气体的相对分子质量不再变化
C.N2体积分数不再变化
D.恒容容器中混合气体的密度保持不变
(3)利用NaClO2/H2O2酸性复合吸收剂可同时对NO、SO2进行氧化得到硝酸和硫酸而除去。在温度一定时,
 和溶液的pH对脱硫、脱硝的影响如图所示:
和溶液的pH对脱硫、脱硝的影响如图所示:
由图可知,脱硫、脱硝的最佳条件是___________(填标号)。
A.pH在5.0~5.5, | B.pH在5.0~5.5, |
C.pH在5.5~6.0, | D.pH在5.5~6.0, |
您最近一年使用:0次
2024-03-02更新
|
113次组卷
|
2卷引用:湖南省长沙市宁乡市第一高级中学2021届高三新高考第一次模拟考试化学试卷
名校
解题方法
8 . 下列实验操作能达到实验目的的是
| 选项 | 实验目的 | 实验操作 |
| A | 除去 气体中混有的 气体中混有的 | 将混合气体通入盛饱和 溶液的洗气瓶 溶液的洗气瓶 |
| B | 比较氯和碳的非金属性强弱 | 将足量盐酸与 溶液混合 溶液混合 |
| C | 检验溶液中的 | 向待测液中滴加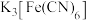 溶液 溶液 |
| D | 比较 和 和 酸性强弱 酸性强弱 | 用 试纸测定等浓度 试纸测定等浓度 和 和 溶液的 溶液的 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-03-02更新
|
166次组卷
|
2卷引用:湖南省长沙市宁乡市第一高级中学2021届高三新高考第一次模拟考试化学试卷
名校
解题方法
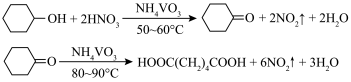
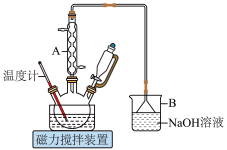
9 . 1,6己二酸是常用的化工原料,在高分子材料、医药、润滑剂的制造等方面都有重要作用。实验室利用图中的装置(夹持装置已省略),以环己醇和硝酸为反应物制备1,6己二酸。反应原理为:
实验步骤如下:
Ⅰ.向三颈烧瓶中加入0.03 g NH4VO3固体和18 mL浓HNO3(略过量),向恒压滴液漏斗中加入6 mL环己醇
Ⅱ.将三颈烧瓶放入水浴中,电磁搅拌并加热至50℃。移去水浴,打开恒压滴液漏斗活塞滴加5~6滴环己醇,观察到三颈烧瓶中产生红棕色气体时,开始慢慢加入余下的环己醇。调节滴加环己醇的速度,使三颈烧瓶内温度维持在50~60 ℃之间,直至环己醇全部滴加完毕
Ⅲ.将三颈烧瓶放入80~90 ℃水浴中加热10 min,至几乎无红棕色气体导出为止。然后迅速将三颈烧瓶中混合液倒入100 mL烧杯中,冷却至室温后,有白色晶体析出,减压过滤,___________,干燥,得到粗产品
Ⅳ.1,6-己二酸粗产品的提纯
(1)仪器A的名称为___________ ,其作用是___________ 。
(2)B中发生反应的离子方程式为___________ (其中一种产物为亚硝酸盐)
(3)若步骤Ⅱ中控制水浴温度不当,未滴加环己醇前就会观察到红棕色气体生成,原因为___________ ,滴加环己醇的过程中,若温度过高,可用冷水浴冷却维持50~60 ℃,说明该反应的ΔH___________ 0(填“>”或“<”)。
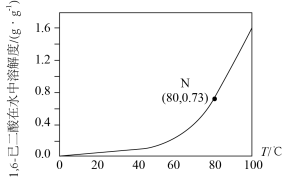
(4)将步骤Ⅲ补充完整:___________ 。步骤Ⅳ提纯方法的名称为___________ 。如图为1,6己二酸在水中的溶解度曲线,80 ℃时1,6-己二酸水溶液的密度为ρ g·mL-1;该溶液的物质的量浓度为___________ 。
| 试剂 | 相对分子质量 | 密度/(g·mL-1) | 熔点/℃ | 沸点/℃ | 溶解性 |
| 环己醇 | 100 | 0.962 | 25.9 | 161.8 | 可溶于水、乙醇、乙醚 |
| 1,6-己二酸 | 146 | 1.360 | 152 | 330.5 | 微溶于冷水,易溶于乙醇 |
| NH4VO3 | 117 | 2.326 | 210(分解) | — | 微溶于冷水,易溶于热水 |
Ⅰ.向三颈烧瓶中加入0.03 g NH4VO3固体和18 mL浓HNO3(略过量),向恒压滴液漏斗中加入6 mL环己醇
Ⅱ.将三颈烧瓶放入水浴中,电磁搅拌并加热至50℃。移去水浴,打开恒压滴液漏斗活塞滴加5~6滴环己醇,观察到三颈烧瓶中产生红棕色气体时,开始慢慢加入余下的环己醇。调节滴加环己醇的速度,使三颈烧瓶内温度维持在50~60 ℃之间,直至环己醇全部滴加完毕
Ⅲ.将三颈烧瓶放入80~90 ℃水浴中加热10 min,至几乎无红棕色气体导出为止。然后迅速将三颈烧瓶中混合液倒入100 mL烧杯中,冷却至室温后,有白色晶体析出,减压过滤,___________,干燥,得到粗产品
Ⅳ.1,6-己二酸粗产品的提纯
(1)仪器A的名称为
(2)B中发生反应的离子方程式为
(3)若步骤Ⅱ中控制水浴温度不当,未滴加环己醇前就会观察到红棕色气体生成,原因为
(4)将步骤Ⅲ补充完整:
| A.46.07% | B.57.08% | C.63.03% | D.74.61% |
您最近一年使用:0次
2024-02-29更新
|
349次组卷
|
8卷引用:东北三省三校(哈师大附中、东北师大附中、辽宁省实验中学)2021届高三第一次联合模拟考试(3月)理综化学试题
东北三省三校(哈师大附中、东北师大附中、辽宁省实验中学)2021届高三第一次联合模拟考试(3月)理综化学试题(已下线)重点7 化学实验综合题-2021年高考化学【热点·重点·难点】专练(山东专用)(已下线)押山东卷第20题 化学实验综合题-备战2021年高考化学临考题号押题(山东卷)(已下线)3.5.2 有机合成路线的设计与实施-2021-2022学年高二化学课后培优练(人教版2019选择性必修3)(已下线)05 以分离提纯为主线的有机制备类综合实验 (解析)-备战2023年高考化学大题逐空突破系列(全国通用)(已下线)题型三 以分离提纯为主的有机制备类实验-备战2024年高考化学答题技巧与模板构建河南省南阳市邓州市第六高级中学校2023-2024学年高二下学期开学测试化学试题四川省成都市第七中学林荫校区2023-2024学年高三下学期4月月考理科综合试卷-高中化学
名校
10 . 某晶体立方晶胞如图所示。已知图中微粒1的分数坐标是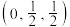 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 。下列说法正确的是
。下列说法正确的是
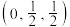 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 。下列说法正确的是
。下列说法正确的是
A. 周围距离最近且相等的 周围距离最近且相等的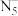 个数是6 个数是6 |
B.微粒2的分数坐标是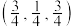 |
| C.已知银与铜位于同一族,银元素位于元素周期表的d区 |
D.若晶胞边长为a pm,则晶体密度为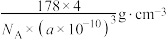 |
您最近一年使用:0次
2024-02-25更新
|
1280次组卷
|
6卷引用:湖南省株洲市第一中学2021届高三下学期第二次模拟检测化学试题
湖南省株洲市第一中学2021届高三下学期第二次模拟检测化学试题广西柳州高中、南宁三中名校联盟2023-2024学年高三一轮复习诊断联考化学试题(已下线)专题04 物质结构与性质 元素推断-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)江西省南昌市2024届高三下学期第三次模拟测试化学试题(已下线)选择题11-14安徽省蚌埠第二中学2023-2024学年高二下学期3月月考化学试题



