解题方法
1 . 某有机物M的结构简式如图所示,下列说法正确的是


| A.M中含有3种含氧官能团 |
| B.M能发生水解反应 |
| C.M分子中所有原子均在同一平面上 |
| D.1molM与足量的H2反应,最多消耗5molH2 |
您最近一年使用:0次
2022-02-13更新
|
585次组卷
|
4卷引用:广西北海市2021-2022学年高三上学期第一次化学模拟考试理综化学试题
广西北海市2021-2022学年高三上学期第一次化学模拟考试理综化学试题天津市红桥区2021届高三第二次质量调查(二模)化学试题(已下线)二轮拔高卷2-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(上海卷)湖北省新高考联考协作体2021-2022学年高三下学期2月联考化学试题
2 . C、Si、Ge、Sn是同族元素,该族元素单质及其化合物在材料、医药等方面有重要应用。请回答下列问题:
(1)科学家常利用___________ 区分晶体SiO2和非晶体SiO2.,基态Ge原子价电子排布图为___________ ,第四周期与基态Ge原子具有相同数目未成对电子数的元素有___________ (填元素符号)。
(2)SnCl2极易水解生成Sn(OH)Cl沉淀,Sn(OH)Cl中四种元素电负性由小到大的顺序为___________ 。SnO2是一种重要的半导体传感器材料,用来制备灵敏度高的气敏传感器,SnO2与熔融NaOH反应生成Na2SnO3,Na2SnO3中阴离子的空间构型为___________ 。
(3)灰锡的晶体结构与金刚石相似(如图所示),其中A处原子的原子分数坐标为(0,0,0)。
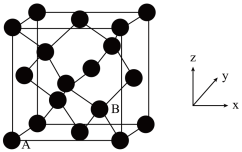
①B处原子的原子分数坐标为___________ 。
②已知灰锡的密度为ρg·m-3,设NA为阿伏加德罗常数的值,根据硬球接触模型,则Sn原子半径r(Sn)=___________ pm(可只列式不计算)。
(1)科学家常利用
(2)SnCl2极易水解生成Sn(OH)Cl沉淀,Sn(OH)Cl中四种元素电负性由小到大的顺序为
(3)灰锡的晶体结构与金刚石相似(如图所示),其中A处原子的原子分数坐标为(0,0,0)。

①B处原子的原子分数坐标为
②已知灰锡的密度为ρg·m-3,设NA为阿伏加德罗常数的值,根据硬球接触模型,则Sn原子半径r(Sn)=
您最近一年使用:0次
3 . 设计如下实验装置制备硫代硫酸钠晶体(Na2S2O3·5H2O)(夹持仪器略),总反应为2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2.已知硫代硫酸钠晶体在中性或碱性溶液中较稳定,酸性溶液中产生浑浊。
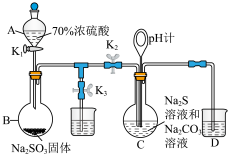
(1)仪器A的名称为___________ ,烧瓶B中制备SO2的化学方程式为___________ ,A中使用浓硫酸的质量分数为70%的原因是___________ 。
(2)Na2S2O3的制备:先组装好仪器,然后检验装置的气密性,将所需药品加入各仪器装置;打开K2,关闭K3,调节K1使硫酸缓缓滴下,导管口有气泡冒出,pH计读数逐渐减小,当pH计读数接近7时,必须立即打开K3,关闭K1、K2,原因是___________ (用离子方程式解释)。
(3)充分反应后,将C中溶液经过一系列操作可得硫代硫酸钠晶体。准确称取7.00g产品,溶于蒸馏水配成100.00 mL,溶液,取20.00 mL注入锥形瓶,以淀粉作指示剂,用0.10 mol/L标准碘溶液滴定。已知:2S2O +I2(aq)=S4O
+I2(aq)=S4O 后(无色)+2I-(aq)。
后(无色)+2I-(aq)。
①标准碘溶液应盛放在___________ (填“酸式”或“碱式”)滴定管中。
②第一次滴定开始和结束时,滴定管中的液面如图,则消耗标准碘溶液的体积为___________ mL。
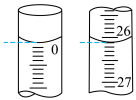
③重复上述操作三次,记录另两次数据如表中所示,则产品中Na2S2O3·5H2O(M=248 g·mol-1)的质量分数为___________ %。
(4)Na2S2O3有还原性,可作脱氯剂。向Na2S2O3溶液中通入少量Cl2,预测S2O 转变为SO
转变为SO ,设计实验方案验证该预测:取少量反应后的溶液于试管中,
,设计实验方案验证该预测:取少量反应后的溶液于试管中,___________ 。

(1)仪器A的名称为
(2)Na2S2O3的制备:先组装好仪器,然后检验装置的气密性,将所需药品加入各仪器装置;打开K2,关闭K3,调节K1使硫酸缓缓滴下,导管口有气泡冒出,pH计读数逐渐减小,当pH计读数接近7时,必须立即打开K3,关闭K1、K2,原因是
(3)充分反应后,将C中溶液经过一系列操作可得硫代硫酸钠晶体。准确称取7.00g产品,溶于蒸馏水配成100.00 mL,溶液,取20.00 mL注入锥形瓶,以淀粉作指示剂,用0.10 mol/L标准碘溶液滴定。已知:2S2O
 +I2(aq)=S4O
+I2(aq)=S4O 后(无色)+2I-(aq)。
后(无色)+2I-(aq)。①标准碘溶液应盛放在
②第一次滴定开始和结束时,滴定管中的液面如图,则消耗标准碘溶液的体积为

③重复上述操作三次,记录另两次数据如表中所示,则产品中Na2S2O3·5H2O(M=248 g·mol-1)的质量分数为
| 滴定次输 | 滴定前/mL | 滴定后/mL |
| 第二次 | 1.56 | 30.30 |
| 第三次 | 0.22 | 26.34 |
(4)Na2S2O3有还原性,可作脱氯剂。向Na2S2O3溶液中通入少量Cl2,预测S2O
 转变为SO
转变为SO ,设计实验方案验证该预测:取少量反应后的溶液于试管中,
,设计实验方案验证该预测:取少量反应后的溶液于试管中,
您最近一年使用:0次
解题方法
4 . 锌-空气燃料电池是一种低能耗电池,在生产生活中应用广泛,其装置示意图如图所示。下列说法错误的是
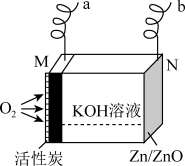

| A.充电时,a与电源正极相连 |
| B.放电时,M极每消耗16gO2,理论上N极质量增加16g |
| C.充电时,N极的电极反应式为ZnO+2H++2e-=Zn+H2O |
| D.放电过程中,KOH溶液浓度不变 |
您最近一年使用:0次
名校
5 . 三氧化二镍(Ni2O3)是一种灰黑色无气味有光泽的块状物,易碎成细粉末,常用于制造高能电池。工业上以金属镍废料(含有少量铁、铝等杂质)生产NiCl2,继而生产Ni2O3的工艺流程如下:
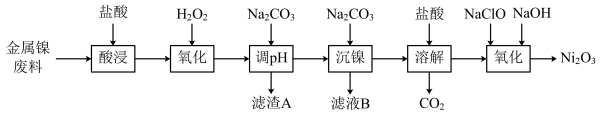
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
回答下列问题:
(1)Ni2O3中Ni元素的化合价为___________ ;为了提高金属镍废料浸出的速率,在“酸浸”时可采取的措施有:___________ (任写一种)。
(2)“酸浸”后的酸性溶液中加入H2O2的目的是___________ (用语言叙述)。
(3)“沉镍”前需加Na2CO3控制溶液pH范围为___________ ;滤渣A为___________ 。
(4)“氧化”时生成Ni2O3的离子方程式为___________ 。
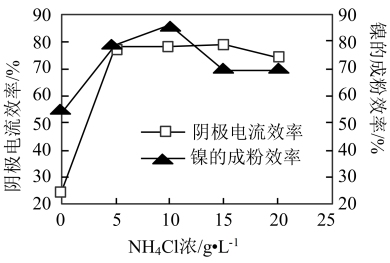
(5)工业上用镍为阳极,电解0.05~0.1 mol·L-1 NiCl2溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉。当其他条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图所示,则NH4Cl的浓度最好控制为_______ 。

下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
| 开始沉淀的pH | 1.1 | 6.5 | 3.5 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.7 | 4.7 | 9.2 |
(1)Ni2O3中Ni元素的化合价为
(2)“酸浸”后的酸性溶液中加入H2O2的目的是
(3)“沉镍”前需加Na2CO3控制溶液pH范围为
(4)“氧化”时生成Ni2O3的离子方程式为
(5)工业上用镍为阳极,电解0.05~0.1 mol·L-1 NiCl2溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉。当其他条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图所示,则NH4Cl的浓度最好控制为

您最近一年使用:0次
2021-11-24更新
|
593次组卷
|
3卷引用:广西北海市2021-2022学年高三上学期第一次化学模拟考试理综化学试题
名校
6 . 短周期主族元素X、Y、Z、W、Q、R的原子序数依次增大,其中只有Z和W是金属元素。X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z的原子半径是短周期主族元素中最大的,Q与Y同族。下列说法一定正确的是
| A.简单离子半径的大小顺序:W>Q>R>Y |
| B.W的最高价氧化物的水化物是两性氢氧化物 |
| C.X的最简单氢化物沸点低于Y的最简单氢化物沸点 |
| D.Z2Y2和QY2均具有漂白性,且漂白原理相同 |
您最近一年使用:0次
2021-11-24更新
|
970次组卷
|
6卷引用:广西北海市2021-2022学年高三上学期第一次化学模拟考试理综化学试题
广西北海市2021-2022学年高三上学期第一次化学模拟考试理综化学试题(已下线)解密05 物质结构 元素周期律(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)押江苏卷第5题 物质结构与元素周期律 -备战2022年高考化学临考题号押题(江苏卷)(已下线)查补易混易错点06 物质结构 元素周期律-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)查补易混易错点06 物质结构 元素周期律-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)安徽师范大学附属中学2022届高三下学期第十六次综合测试理综化学试题
7 . 下列实验仪器使用或实验操作正确的是
| A.用pH试纸测量某新制氯水的pH为3 |
| B.饱和氟化铵溶液需保存在橡胶塞棕色玻璃细口瓶中 |
| C.取出试剂瓶中的金属钠,切取少量后把剩余的金属钠放回原试剂瓶 |
| D.用瓷坩埚进行熔融碳酸钠 |
您最近一年使用:0次
8 . 设NA为阿伏加德罗常数的值。下列有关叙述正确的是
A.84gMgCO3和NaHCO3混合固体中的CO 离子数为NA 离子数为NA |
| B.1 mol Na2O2与足量CO2充分反应后转移电子数为2NA |
| C.标准状况下,2.24LCHCl3含有的共价键数为0.4NA |
| D.1L1mol/L的NaClO溶液中,ClO-的数目小于NA |
您最近一年使用:0次
解题方法
9 . 自古以来,化学与人类生产、生活密切相关,下列有关说法错误的是
| A.杜康用高粱酿酒的原理,是通过蒸馏法将高粱中的乙醇分离出来 |
| B.制造新版人民币票面文字等处的油墨中所含有的Fe3O4是一种磁性物质 |
| C.“深海勇士”号潜水艇使用的锂离子电池是一种二次电池 |
| D.唐代诗人刘禹锡的《浪淘沙》中“美人首饰侯王印,尽是沙中浪底来”不涉及氧化还原反应 |
您最近一年使用:0次
10 . 在催化剂作用下H2(g)可将烟气中的SO2(g)还原成S(s)。回答下列问题:
(1)已知:
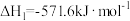

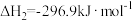
则H2(g)还原烟气中的SO2(g)的热化学方程式为___________ 。
(2)在容积为10L的容器中充入1mol SO2(g)与2mol H2(g)的混合气体,发生反应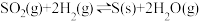
 。
。
①恒容时,反应经过4s后达到平衡,此时测得H2O(g)的物质的量为1.2mol。则0~4s内,v(H2)=___________ mol/(L·s),平衡时,c(SO2)=___________ mol/L;若平衡后升高温度,SO2的转化率将___________ (填“增 大”“减小”或“不变”)。
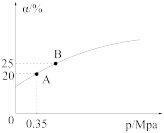
②恒温时,压强p与SO2的平衡转化率α如图所示,该温度下,该反应的平衡常数K=___________ L/mol;平衡状态由A变到B,平衡常数K(A) ___________ (填“>”“<”或“=”)K(B)。
③若在恒温恒容密闭容器中发生上述反应,下列可作为该反应达到平衡状态的标志是___________ (填标号)。
A.压强不再变化
B.密度不再变化
C.气体的平均相对分子质量不再变化
D.SO2的消耗速率与H2的消耗速率之比为1∶2
(1)已知:

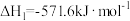

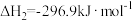
则H2(g)还原烟气中的SO2(g)的热化学方程式为
(2)在容积为10L的容器中充入1mol SO2(g)与2mol H2(g)的混合气体,发生反应
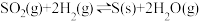
 。
。①恒容时,反应经过4s后达到平衡,此时测得H2O(g)的物质的量为1.2mol。则0~4s内,v(H2)=
②恒温时,压强p与SO2的平衡转化率α如图所示,该温度下,该反应的平衡常数K=

③若在恒温恒容密闭容器中发生上述反应,下列可作为该反应达到平衡状态的标志是
A.压强不再变化
B.密度不再变化
C.气体的平均相对分子质量不再变化
D.SO2的消耗速率与H2的消耗速率之比为1∶2
您最近一年使用:0次
2021-11-02更新
|
551次组卷
|
4卷引用:广西北海市2021-2022学年高三上学期第一次化学模拟考试理综化学试题



