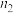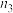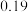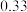9-10高二下·北京·期末
名校
1 . 如图所示,三个烧瓶中分别充满NO2气体并分别装在盛有水的三个烧杯中,在①烧杯中加入CaO,在②烧杯中不加其他任何物质,在③烧杯中加入NH4Cl晶体,发现①中红棕色变深,③中红棕色变浅。已知:2NO2(红棕色) N2O4(无色),下列叙述正确的是
N2O4(无色),下列叙述正确的是
 N2O4(无色),下列叙述正确的是
N2O4(无色),下列叙述正确的是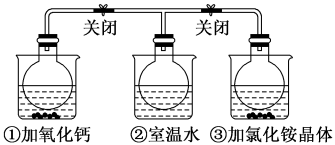
A.2NO2 N2O4是吸热反应 N2O4是吸热反应 |
| B.NH4Cl溶于水时吸收热量 |
| C.①烧瓶中平衡时混合气体的平均相对分子质量增大 |
| D.③烧瓶中气体的压强增大 |
您最近一年使用:0次
2022-08-28更新
|
1134次组卷
|
23卷引用:2010年北京市八一中学高二第二学期期末考试化学试卷
(已下线)2010年北京市八一中学高二第二学期期末考试化学试卷2018版化学(苏教版)高考总复习专题七课时跟踪训练--化学平衡的移动新疆生产建设兵团第二中学2017-2018学年高二上学期第四次月考(期末)化学试题【全国百强校】辽宁省鞍山市第一中学2018-2019学年高二下学期开学考试化学试题新疆自治区生产建设兵团第二中学2018-2019学年高二第一次月考化学试题陕西省延安市第一中学2019-2020学年高二上学期期中考试化学试题(已下线)专题7.2 化学平衡状态 化学平衡移动(练)-《2020年高考一轮复习讲练测》云南省普洱市江城县第一中学2019—2020学年高二上学期期末考试化学试题四川省泸州市泸县第二中学2019-2020学年高二下学期第一次在线月考化学试题黑龙江省大庆市第四中学2019-2020学年高二上学期第一次检测化学试题(已下线)2.3.2+影响化学平衡状态的因素-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)安徽省蚌埠田家炳中学2020-2021学年高二10月月考化学试题江西省上饶市2020-2021学年高二上学期期末教学质量测试化学试题江西省赣州市第一中学2020-2021学年高二下学期开学测试化学试题河南省信阳高级中学2020-2021学年高二下学期回顾测试化学试题福建省三明第一中学2021-2022学年高二上学期第一次月考化学试题福建省莆田市擢英中学2021-2022学年高二上学期第一次月考化学试卷(已下线)2.2.2 浓度商、温度对化学平衡的影响-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)黑龙江省伊春市伊美区第二中学2021-2022学年高二上学期期中考试化学试题广东省深圳市宝安区宝安中学2022-2023学年高一上学期期中考试化学试题新疆奇台县第一中学2022-2023学年高二上学期期中考试化学试题山东省淄博市部分学校联考2022-2023学年高一下学期4月期中考试化学试题(已下线)选择题11-15
名校
2 . 一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+O2(g) 2SO3(g)(正反应放热),测得反应的相关数据如下:
2SO3(g)(正反应放热),测得反应的相关数据如下:
下列说法正确的是
 2SO3(g)(正反应放热),测得反应的相关数据如下:
2SO3(g)(正反应放热),测得反应的相关数据如下:| 容器1 | 容器2 | 容器3 | |
| 反应温度T/K | 700 | 700 | 800 |
| 反应物投入量 | 2molSO2、1molO2 | 4molSO3 | 2molSO2、1molO2 |
| 平衡v正(SO2)/mol/(L·s) | v1 | v2 | v3 |
| 平衡c(SO3)mol/L | c1 | c2 | c3 |
| 平衡体系总压强p/Pa | p1 | p2 | p3 |
| 物质的平衡转化率/α | α1(SO2) | α2(SO3) | α3(SO2) |
| 平衡常数K | K1 | K2 | K3 |
| A.v1<v2,c2<2c1 | B.K1>K3,p2>2p3 |
| C.v1>v3,α1(SO2)>α3(SO2) | D.c2>2c3,α2(SO3)+α3(SO2)<1 |
您最近一年使用:0次
2021-08-14更新
|
1551次组卷
|
25卷引用:天津市静海区第一中学2020届高三下学期第六周周末训练化学试题
天津市静海区第一中学2020届高三下学期第六周周末训练化学试题人教版(2019)高二选择性必修第一册 第二章 化学反应速率与化学平衡 第二节 化学平衡 高考帮人教版(2019)高二化学选择性必修1第二章 化学反应速率与化学平衡 过高考 3年真题强化闯关浙江省诸暨市2019-2020学年高二上学期期末考试化学试题宁夏银川一中2020-2021学年高二上学期期末考试化学试题浙江省宁波市九校2020-2021学年高二上学期期末联考化学试题(已下线)【绍兴新东方】绍兴高中化学00008(已下线)【浙江新东方】高中化学20210304-010(已下线)专题06 化学反应速率和化学平衡——备战2021年高考化学纠错笔记(已下线)解密09 化学反应速率与平衡(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密09 化学反应速率与平衡(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)考点18 化学平衡状态 化学平衡移动-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点18 化学平衡状态 化学平衡移动-备战2022年高考化学一轮复习考点帮(浙江专用)四川省蓬安中学校2019-2020学年高二上学期开学考试化学试题(已下线)课时36 化学平衡及平衡移动-2022年高考化学一轮复习小题多维练(全国通用)福建省龙岩市武平县第一中学2021-2022学年高二上学期9月月考化学试题广西浦北中学2021-2022学年高二上学期第一次月考化学试题(已下线)2.3.3 温度变化对化学平衡的影响-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)(已下线)2.3.2 压强变化对化学平衡的影响-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)吉林省长春市第二中学2021-2022学年高二上学期第一次月考化学试题江西省吉安一中2021-2022学年高二上学期第一次段考化学试题江西省九江市第一中学2021-2022学年高二上学期期中考试化学试题江西省宜春市八校2022-2023学年高二上学期12月联考化学试题河北省部分学校2023-2024学年高二上学期10月联考化学试题安徽省当涂第一中学2023-2024学年高二上学期10月月考化学试题
19-20高三·江苏苏州·期末
名校
3 . 铁及其化合物在处理工业废水、废气过程中发挥着重要作用。
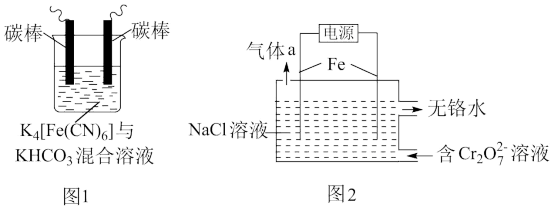
(1)用铁的化合物除硫化氢:2[Fe(CN)6]3-+ 2 +HS- =2[Fe(CN)6]4-+ 2
+HS- =2[Fe(CN)6]4-+ 2 +S↓,可通过图1使[Fe(CN)6]3-再生,电解时,阳极的电极反应式为
+S↓,可通过图1使[Fe(CN)6]3-再生,电解时,阳极的电极反应式为_______ ;电解过程中阴极区溶液的pH_______ (填“变大”、 “变小”或“不变")。
(2)以铁为电极电解除铬,如图2
已知: + H2O=2
+ H2O=2 +2H+
+2H+
氧化性: >
>
①电解过程中主要反应之一: +6Fe2++17H2O= 2Cr(OH)3↓+6Fe(OH)3↓+10H+;气体a主要成分是
+6Fe2++17H2O= 2Cr(OH)3↓+6Fe(OH)3↓+10H+;气体a主要成分是_______ 。
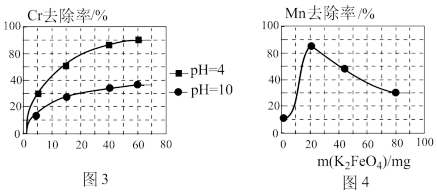
②电解过程中,不同pH时,通电时间与Cr元素的去除率关系如图3所示,pH=10相比pH=4,Cr元素的去除率偏低的原因可能是_______ 。
(3)高铁酸钾(K2FeO4)除锰
已知:K2FeO4具有强氧化性,极易溶于水
①在酸性条件下,能与废水中的Mn2+反应生成Fe(OH)3和MnO2沉淀来除锰,该反应的离子方程式_______ 。
②用K2FeO4处理1L 50 mg/L的含Mn2+废水,Mn元素的去除率与K2FeO4量的关系如图4所示,当K2FeO4超过20 mg时,Mn元素的去除率下降的原因可能是_______ 。

(1)用铁的化合物除硫化氢:2[Fe(CN)6]3-+ 2
 +HS- =2[Fe(CN)6]4-+ 2
+HS- =2[Fe(CN)6]4-+ 2 +S↓,可通过图1使[Fe(CN)6]3-再生,电解时,阳极的电极反应式为
+S↓,可通过图1使[Fe(CN)6]3-再生,电解时,阳极的电极反应式为(2)以铁为电极电解除铬,如图2
已知:
 + H2O=2
+ H2O=2 +2H+
+2H+氧化性:
 >
>
①电解过程中主要反应之一:
 +6Fe2++17H2O= 2Cr(OH)3↓+6Fe(OH)3↓+10H+;气体a主要成分是
+6Fe2++17H2O= 2Cr(OH)3↓+6Fe(OH)3↓+10H+;气体a主要成分是②电解过程中,不同pH时,通电时间与Cr元素的去除率关系如图3所示,pH=10相比pH=4,Cr元素的去除率偏低的原因可能是

(3)高铁酸钾(K2FeO4)除锰
已知:K2FeO4具有强氧化性,极易溶于水
①在酸性条件下,能与废水中的Mn2+反应生成Fe(OH)3和MnO2沉淀来除锰,该反应的离子方程式
②用K2FeO4处理1L 50 mg/L的含Mn2+废水,Mn元素的去除率与K2FeO4量的关系如图4所示,当K2FeO4超过20 mg时,Mn元素的去除率下降的原因可能是
您最近一年使用:0次
2021-03-25更新
|
449次组卷
|
5卷引用:【苏州新东方】化学试卷
(已下线)【苏州新东方】化学试卷(已下线)2.3.1 浓度变化对化学平衡的影响-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)湖北省武汉市蔡甸区汉阳一中2021-2022学年高二上学期12月月考化学试题湖北省武汉市部分重点中学2021-2022学年高二上学期12月联考化学试题江苏省常州市第一中学2023-2024学年高二上学期11月期中考试化学试题
名校
解题方法
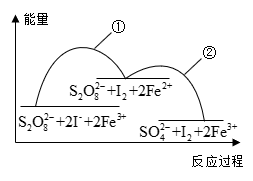
4 . 已知反应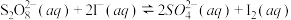 ,若往该溶液中加入含
,若往该溶液中加入含 的某溶液,反应机理:
的某溶液,反应机理:
①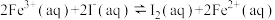
②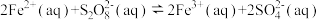
下列说法错误的是
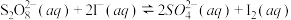 ,若往该溶液中加入含
,若往该溶液中加入含 的某溶液,反应机理:
的某溶液,反应机理:①
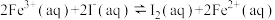
②
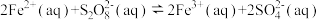
下列说法错误的是

A. 是该反应的催化剂,加入 是该反应的催化剂,加入 后降低了该反应的活化能 后降低了该反应的活化能 |
| B.往该溶液中滴加淀粉溶液,溶液变蓝,适当升温,蓝色加深 |
C.步骤①中 和 和 的总能量低于 的总能量低于 和 和 的总能量 的总能量 |
D.增大 浓度或 浓度或 浓度,反应①、反应②的反应速率均加快 浓度,反应①、反应②的反应速率均加快 |
您最近一年使用:0次
2020-12-18更新
|
1476次组卷
|
8卷引用:山东省菏泽市2020-2021学年高二上学期期中考试化学试题(A)
山东省菏泽市2020-2021学年高二上学期期中考试化学试题(A)山西省怀仁市第一中学云东校区2020-2021学年高二上学期第三次月考化学试题(已下线)押全国卷理综第13题 反应机理图分析、能垒图分析等创新题型及阿伏伽德罗常数-备战2021年高考化学临考题号押题(课标全国卷)(已下线)2.4 化学反应的调控-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)河南省南阳市第一中学校2022-2023学年高二上学期开学考试化学试题(已下线)【2022】【高二上】【期中考】【高中化学】60(已下线)【2022】【高二化学】【期中考】-179北京市第五十五中学2022-2023学年高三上学期期中考试化学试题
5 . 如图表示 时合成氨反应的能量变化曲线图,据图回答下列问题:
时合成氨反应的能量变化曲线图,据图回答下列问题:

(1)若反应中生成2mol氨,则反应____ (填“吸收”或“放出”)____ kJ热量。
(2)图甲中曲线____ (填“a”或“b”)表示加入铁触媒(催化剂)的能量变化曲线,铁触媒能加快反应速率的原理是____ 。
(3)合成氨反应中平衡混合物中氨气的体积分数与压强、温度的关系如图所示。若曲线a对应的温度为500℃,则曲线b对应的温度可能是____ 。
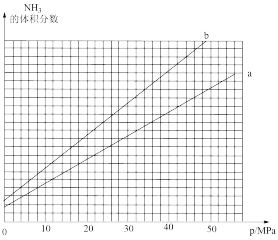
A.600℃ B.550℃ C.500℃ D.450℃
(4)合成氨所需的氢气可由甲烷与水反应制备,发生的反应为

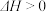 。一定条件下,在1L容器中发生上述反应,各物质的物质的量浓度的变化如表所示:
。一定条件下,在1L容器中发生上述反应,各物质的物质的量浓度的变化如表所示:
①表中x=____ ;前2min内 的平均反应速率为
的平均反应速率为______ 。
②3~4min内,反应过程中氢气浓度量增大的原因可能是____ 。
A.升高温度 B.使用催化剂 C.充入氢气
 时合成氨反应的能量变化曲线图,据图回答下列问题:
时合成氨反应的能量变化曲线图,据图回答下列问题:
(1)若反应中生成2mol氨,则反应
(2)图甲中曲线
(3)合成氨反应中平衡混合物中氨气的体积分数与压强、温度的关系如图所示。若曲线a对应的温度为500℃,则曲线b对应的温度可能是

A.600℃ B.550℃ C.500℃ D.450℃
(4)合成氨所需的氢气可由甲烷与水反应制备,发生的反应为


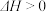 。一定条件下,在1L容器中发生上述反应,各物质的物质的量浓度的变化如表所示:
。一定条件下,在1L容器中发生上述反应,各物质的物质的量浓度的变化如表所示:
| 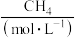 |  | 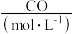 | 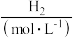 |
0 |
|
| 0 | 0 |
2 |
|
|
|
|
3 |
|
|
|
|
4 |
|
|
|
|
①表中x=
 的平均反应速率为
的平均反应速率为②3~4min内,反应过程中氢气浓度量增大的原因可能是
A.升高温度 B.使用催化剂 C.充入氢气
您最近一年使用:0次
名校
6 . 某温度下,在一容积可变的容器中,反应2A(g)+B(g)  2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol。保持温度和压强不变,再向平衡混合物中分别加入3mol、1mol、3mol的A、B、C再达平衡,与之前相比平衡
2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol。保持温度和压强不变,再向平衡混合物中分别加入3mol、1mol、3mol的A、B、C再达平衡,与之前相比平衡
 2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol。保持温度和压强不变,再向平衡混合物中分别加入3mol、1mol、3mol的A、B、C再达平衡,与之前相比平衡
2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol。保持温度和压强不变,再向平衡混合物中分别加入3mol、1mol、3mol的A、B、C再达平衡,与之前相比平衡| A.向右移动 | B.向左移动 | C.不移动 | D.无法判断 |
您最近一年使用:0次
2020-08-10更新
|
830次组卷
|
6卷引用:河南省鹤壁市高级中学2020-2021学年高二上学期阶段性检测(一)化学试题
河南省鹤壁市高级中学2020-2021学年高二上学期阶段性检测(一)化学试题(已下线)第二章 化学反应速率和化学平衡(能力提升)-2020-2021学年高二化学单元测试定心卷(人教版选修4)(已下线)2.3.3+化学平衡常数-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)(已下线)2.3.1化学平衡状态(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)(已下线)选择性必修1 期中检测(能力提升卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)吉林省乾安县第七中学2021-2022学年高二上学期第一次质量检测化学试题
真题
名校
7 . 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
(1)“滤渣1”含有S和__________________________ ;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式____________________________________________________ 。
(2)“氧化”中添加适量的MnO2的作用是将________________________ 。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______ ~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________ 。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_____________________________________________________________________ 。
(6)写出“沉锰”的离子方程式___________________________________________________ 。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y= 时,z=
时,z=___________ 。
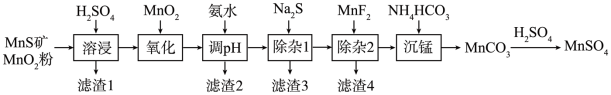
| 金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和
(2)“氧化”中添加适量的MnO2的作用是将
(3)“调pH”除铁和铝,溶液的pH范围应调节为
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是
(6)写出“沉锰”的离子方程式
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=
 时,z=
时,z=
您最近一年使用:0次
2019-06-09更新
|
19601次组卷
|
29卷引用:2019年全国统一高考化学试题(新课标Ⅲ)
2019年全国统一高考化学试题(新课标Ⅲ)河北省张家口市第四中学2018-2019学年高二下学期6月月考理科综合化学试题 河北省辛集中学2020届高三上学期入学考试化学试题安徽省阜阳市颍上二中等三校2020届高三上学期入学考试化学试题甘肃省高台县第一中学2020届高三上学期期中考试化学试题山东省滕州市第一中学2020届高三3月线上模拟考试化学试题(已下线)专题七 工艺流程题(真题汇编)-2020年高考二轮模块化复习之《元素化合物》名师讲案与提分特训河北省承德市围场卉原中学2020届高三模拟自测联考试卷理综化学试卷2020届四川省成都市第七中学高三三月份网络教学质量监测卷化学试题(已下线)专题6.1 无机化工流程题(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升四川省宜宾市叙州区第一中学校2020届高三下学期第四学月考试理综化学试题黑龙江省大庆市第四中学2020届高三下学期4月月考理综化学试题四川省宜宾市叙州区第二中学校2020届高三第一次高考适应性考试理综化学试题河南省信阳市罗山县2021届高三第一次调研(8月联考)化学试题鲁科版(2019)选择性必修1 第3章 物质在水溶液中的行为 第3节 沉淀溶解平衡高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第三章素养检测(已下线)押全国卷理综第27题 工业流程-备战2021年高考化学临考题号押题(课标全国卷)江西省宜春市第九中学2021-2022学年高三上学期10月月考化学试题天津市第二十五中学2021-2022学年高三上学期第一次月考化学试题(已下线)专题11 无机工艺流程题—2022年高考化学二轮复习讲练测(全国版)-讲义(已下线)押全国卷理综第27题 工业流程-备战2022年高考化学临考题号押题(全国卷)(已下线)回归教材重难点08 化学工艺流程分析-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)专题16工艺流程题-五年(2018~2022)高考真题汇编(全国卷)四川省泸州市泸县第五中学2022届高三高考适应性考试理综化学试题(已下线)专题18 工艺流程题(已下线)T26-工业流程题黑龙江省七台河市勃利县高级中学2022-2023学年高三上学期11月期中考试化学试题陕西省西安市周至县第六中学2023-2024学年高三上学期11月期中化学试题河南省济源市高级中学2023-2024学年高三上学期高考模拟检测(10月)理科综合试题-高中化学
名校
8 . 在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C(s)+2NO(g) CO2(g)+N2(g),平衡时c(NO)与温度T的关系如下图所示,则下列说法
CO2(g)+N2(g),平衡时c(NO)与温度T的关系如下图所示,则下列说法不 正确的是
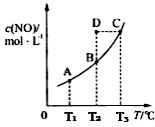
 CO2(g)+N2(g),平衡时c(NO)与温度T的关系如下图所示,则下列说法
CO2(g)+N2(g),平衡时c(NO)与温度T的关系如下图所示,则下列说法
| A.该反应正反应的△H<0 |
| B.若状态A、B的逆反应速率分别为v逆(A)、v逆(B),则v逆(A)>v逆(B) |
| C.在T2时,若反应体系处于状态D,则此时v正>v逆 |
| D.若状态B、C、D的压强分别为PB、PC、PD,则 PC>PD=PB |
您最近一年使用:0次
2019-02-06更新
|
824次组卷
|
6卷引用:【全国百强校】湖北省荆州中学2018-2019学年高二上学期期末考试化学试题
【全国百强校】湖北省荆州中学2018-2019学年高二上学期期末考试化学试题湖北省利川市第五中学2019-2020学年高二12月月考化学试题夯基提能2020届高三化学选择题对题专练——选修4化学反应原理—— 化学平衡的图像分析(强化练习)辽宁省葫芦岛市普通高中2019-2020高二上学期期末质量测试化学试题(已下线)第02章 化学反应速率和化学平衡(A卷基础篇)——2020-2021学年高二化学选修四同步单元AB卷(人教版)吉林油田高级中学2019-2020学年高一下学期期末考试化学试题
名校
9 . 碳酸二甲酯【CO(OCH3)2】是一种无毒、环保性能优异、用途广泛的化工原料。在催化剂作用下,可由甲醇和CO2直接合成:CO2+2CH3OH→CO(OCH3)2+H2O。某研究小组在某温度下,在0.1L恒容密闭容器中投入2.5 mol CH3OH(g)、适量CO2和6×10-5mol催化剂,研究反应时间对甲醇转化数(TON)的影响,其变化曲线如图所示。计算公式为:TON=转化的甲醇的物质的量/催化剂的物质的量。下列说法不正确的是


| A.在该温度下,最佳反应时间是10h |
| B.4~10h内碳酸二甲酯的平均反应速率是7.5×10-4mol·L-1·h-1 |
| C.向反应体系中添加催化剂,一定能提高反应的TON |
| D.该合成方法可以利用廉价的甲醇把影响环境的温室气体CO2转化为资源,在资源循环利用和环境保护方面具有重要意义 |
您最近一年使用:0次
2019-02-05更新
|
568次组卷
|
4卷引用:【全国百强校】浙江省嘉兴市第一中学2019届高三上学期期末考试化学试题
【全国百强校】浙江省嘉兴市第一中学2019届高三上学期期末考试化学试题(已下线)【浙江新东方】【2020】【高二上】【期中】【HD-LP409】【化学】(已下线)【浙江新东方】99(鲁科版2019)必修第二册 第2章 化学键 化学反应规律 第3节 化学反应的快慢和限度 第1课时 化学反应的快慢
10 . 下列事实不能用勒夏特列原理解释的是
①溴水中有下列平衡Br2+H2O HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
②工业合成氨反应N2(g) +3H2(g) 2NH3(g) △H<0,为提高氨的产率,实际生产中采取高温、高压的措施
2NH3(g) △H<0,为提高氨的产率,实际生产中采取高温、高压的措施
③反应2 NO2(g) N2O4(g)达平衡后,缩小容器体积可使体系颜色先变深后变浅
N2O4(g)达平衡后,缩小容器体积可使体系颜色先变深后变浅
④对于2HI(g) H2(g) +I2(g),达平衡后,缩小容器体积可使体系颜色变深
H2(g) +I2(g),达平衡后,缩小容器体积可使体系颜色变深
①溴水中有下列平衡Br2+H2O
 HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅②工业合成氨反应N2(g) +3H2(g)
 2NH3(g) △H<0,为提高氨的产率,实际生产中采取高温、高压的措施
2NH3(g) △H<0,为提高氨的产率,实际生产中采取高温、高压的措施③反应2 NO2(g)
 N2O4(g)达平衡后,缩小容器体积可使体系颜色先变深后变浅
N2O4(g)达平衡后,缩小容器体积可使体系颜色先变深后变浅④对于2HI(g)
 H2(g) +I2(g),达平衡后,缩小容器体积可使体系颜色变深
H2(g) +I2(g),达平衡后,缩小容器体积可使体系颜色变深| A.①② | B.②③ | C.③④ | D.②④ |
您最近一年使用:0次