名校
1 . 下列实验过程不能达到实验目的的是
| 选项 | 实验目的 | 实验过程 |
| A | 提高饱和氯水中的HClO浓度 | 向饱和氯水中加入碳酸钙粉末并通入适量Cl2,然后过滤 |
| B | 证明压强对平衡移动产生影响 | 向充有NO2和N2O4混合气体的恒容透明密闭容器中充入氦气增大压强,观察现象 |
| C | 探究浓度对化学平衡的影响 | 试管中盛有0.1 mol·L−1 K2Cr2O7溶液,向其中滴加10滴6 mol·L−1 NaOH溶液,观察到溶液黄色加深 |
| D | 比较CdS(黄色)与CuS(黑色)的溶解度[已知Ksp(CdS)>Ksp(CuS)] | 向H2S溶液中滴加0.01mol·L-1的CdSO4溶液至沉淀不再增加,然后滴入几滴0.01 mol·L-1CuSO4溶液,观察沉淀颜色变化 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-02-07更新
|
137次组卷
|
2卷引用:四川省成都石室中学2023-2024学年高二上学期期中考试化学试卷
2 . 下列实验方案设计、现象和结论都正确的是
| 选项 | 实验目的 | 方案设计 | 现象和结论 |
| A | 探究反应物浓度对化学反应速率的影响 | 分别取 溶液和 溶液和 溶液、5mL蒸馏水于两支试管中,然后同时加入 溶液、5mL蒸馏水于两支试管中,然后同时加入 溶液 溶液 | 前者出现浑浊的时间更短,说明增大 浓度,可以加快反应速率影响 浓度,可以加快反应速率影响 |
| B | 探究反应物浓度对化学平衡的影响 | 取一支试管,加入 溶液,再向试管中滴加5~10滴 溶液,再向试管中滴加5~10滴 溶液。已知: 溶液。已知: | 溶液由黄色变为橙色,说明增大氢离子浓度,平衡向生成 的方向移动 的方向移动 |
| C | 探究生成物浓度对化学平衡的影响 | 向 溶液加入1滴KSCN溶液,再加入少量KCl溶液 溶液加入1滴KSCN溶液,再加入少量KCl溶液 | 若溶液先变血红色,加入KCl溶液后血红色变浅,说明增大生成物浓度,平衡逆向移动 |
| D | 探究催化剂对化学反应速率的影响 | 向两支盛有少量 溶液的试管中分别加入5滴 溶液的试管中分别加入5滴 溶液和5滴 溶液和5滴 溶液 溶液 | 加入 溶液的试管生成气体的速率比加入 溶液的试管生成气体的速率比加入 溶液的快,说明 溶液的快,说明 对 对 分解的催化效果强 分解的催化效果强 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-12-13更新
|
175次组卷
|
2卷引用:浙江省浙东北联盟(ZDB)2023-2024学年高二上学期期中考试化学试题
22-23高二上·浙江杭州·期中
3 . 下列实验方案设计、现象和结论都正确的是
| 实验目的 | 方案设计 | 现象和结论 | |
| A | 探究反应物浓度对化学反应速率的影响 | 分别取10mL 0.lmol/LNa2S2O3溶液和5mL 0. lmol/L Na2S2O3溶液、5mL蒸馏水于两支试管中,然后同时加入10mL 0.1mol/LH2SO4溶液 | 前者出现浑浊的时间更短,说明增大Na2S2O3浓度,可以加快反应速率 |
| B | 探究压强对化学反应速率的影响 | 在容积不变的密闭容器中发生反应:N2(g) +3H2(g) 2NH3(g) 向其中通入氩气,反应速率不变 2NH3(g) 向其中通入氩气,反应速率不变 | 化学反应速率不受压强影响 |
| C | 探究温度对化学反应速率的影响 | 将装有NO2和N2O4混合气体的连同球分别浸泡在冰水和热水中2NO2(g)(红棕色) N2O4(g)(无色),△H< 0 N2O4(g)(无色),△H< 0 | 热水中气体颜色浅,冰水中颜色深 |
| D | 探究KI与FeCl3反应的限度 | 取1mL.0.1mol/LKI溶液于试管中,加入5mL0.1mol/L FeCl3溶液,充分反应后滴入5滴15%KSCN溶液 | 若溶液变血红色,则KI与FeCl3的反应有一定限度 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
4 . 为达到相应实验目的,下列实验设计可行的是
| 编号 | 实验目的 | 实验过程 |
| A | 探究浓度对化学平衡移动的影响 | 向盛有 5 mL 0. 1 mol/ L K2Cr2O7溶液的试管中滴入 5~15滴浓硫酸,振荡 |
| B | 观察 Fe(OH)2颜色 | 向盛有FeSO4溶液的试管中滴入氨水,立即振荡 |
| C | 检验K+ | 用玻璃棒蘸取待测液在无色火焰上灼烧,观察现象 |
| D | 探究浓度对反应速率的影响 | 向 2 支盛有 2 mL 0. 01 mol/ L H2C2O4溶液的试管中分别加入4mL 0.01mol/ L 和0. 02 mol/ L KMnO4溶液,观察现象 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-11-12更新
|
393次组卷
|
4卷引用:四川省成都市2019-2020学年高二下学期期末摸底考试化学试题
四川省成都市2019-2020学年高二下学期期末摸底考试化学试题(已下线)2.3.1 浓度对化学平衡的影响(基础练)——2020-2021学年高二化学上学期十分钟同步课堂专练(苏教版选修4)四川省宜宾市叙州区第二中学校2021届高三上学期阶段一考试理综化学试题浙江杭州师范大学附属实验学校2020-2021学年高二12月测试化学试题
名校
解题方法
5 . 下列有关实验现象和解释或结论都正确的组合是
| 选项 | 实验操作 | 现象 | 解释或结论 |
A | 相同条件下,分别测量0.1molL1和0.01molL1醋酸溶液的导电性 | 前者的导电性强 | 醋酸浓度越大,电离程度越大 |
B | 向FeCl3和KSCN的混合溶液中加入KCl固体 | 血红色溶液变浅 | 增大KCl的浓度,使得平衡逆向移动 |
C | 两支试管各盛4mL0.1mol/L酸性高锰酸钾溶液,分别加入2mL0.1mol/L草酸溶液和2mL0.2mol/L草酸溶液 | 加入0.2mol/L草酸溶液的试管中,高锰酸钾溶液褪色更快 | 反应物浓度越大,反应速率越快 |
D | 把充有NO2和N2O4的平衡球装置分别放入热水和冷水中 | 热水中颜色更深 | 其他条件不变时,温度升高,平衡向吸热反应方向移动 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-09-04更新
|
592次组卷
|
4卷引用:湖南师范大学附属中学2023-2024学年高二上学期入学考试化学试题
6 . 为探讨化学平衡移动原理与氧化还原反应规律的联系,小睿同学通过改变浓度研究:“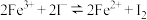 ”反应中Fe3+和Fe2+的相互转化。实验如下:
”反应中Fe3+和Fe2+的相互转化。实验如下:
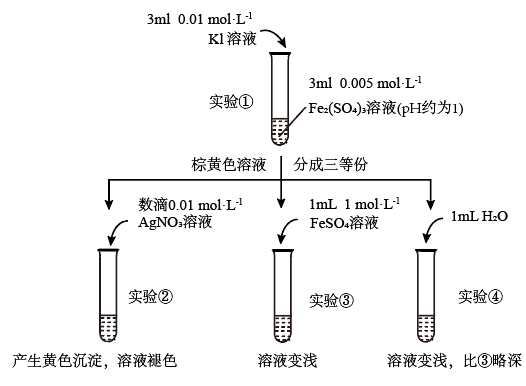
(1)待实验①溶液颜色不再改变时,再进行实验②③④,目的是使实验①的反应达到_______ 。
(2)实验④是实验③的_______ 试验,目的是_______ 。
(3)实验②的颜色变化表明平衡逆向移动,Fe2+向Fe3+转化。根据氧化还原反应的规律,该同学推测实验②中Fe2+向Fe3+转化的原因:外加Ag+使c(I-)降低,导致 的还原性弱于Fe2+,用如图装置(a、b均为石墨电极)进行实验验证。
的还原性弱于Fe2+,用如图装置(a、b均为石墨电极)进行实验验证。
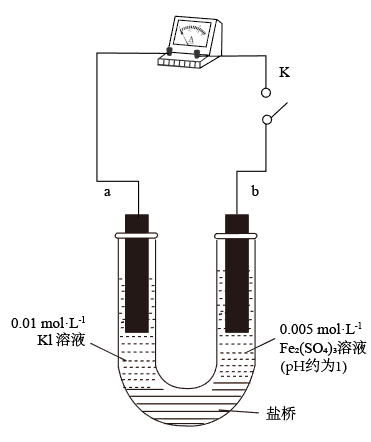
①K闭合时,指针向右偏转,b作_______ 极。
②当指针归零(反应达到平衡)后,向U形管左管滴加0.01 mol/LAgNO3溶液,产生的现象证实了其推测,该现象是_______ 。
(4)按照(3)的原理,该同学用上图装置再进行实验,证实了实验③中Fe2+向Fe3+转化的原因。
①转化原因是_______ 。
②与(3)实验对比,不同的操作是_______ 。
(5)实验①中,还原性:I->Fe2+,而实验②③中,还原性:Fe2+>I-,将(3)和(4)作对比,得出的结论是_______ 。
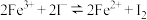 ”反应中Fe3+和Fe2+的相互转化。实验如下:
”反应中Fe3+和Fe2+的相互转化。实验如下:
(1)待实验①溶液颜色不再改变时,再进行实验②③④,目的是使实验①的反应达到
(2)实验④是实验③的
(3)实验②的颜色变化表明平衡逆向移动,Fe2+向Fe3+转化。根据氧化还原反应的规律,该同学推测实验②中Fe2+向Fe3+转化的原因:外加Ag+使c(I-)降低,导致
 的还原性弱于Fe2+,用如图装置(a、b均为石墨电极)进行实验验证。
的还原性弱于Fe2+,用如图装置(a、b均为石墨电极)进行实验验证。
①K闭合时,指针向右偏转,b作
②当指针归零(反应达到平衡)后,向U形管左管滴加0.01 mol/LAgNO3溶液,产生的现象证实了其推测,该现象是
(4)按照(3)的原理,该同学用上图装置再进行实验,证实了实验③中Fe2+向Fe3+转化的原因。
①转化原因是
②与(3)实验对比,不同的操作是
(5)实验①中,还原性:I->Fe2+,而实验②③中,还原性:Fe2+>I-,将(3)和(4)作对比,得出的结论是
您最近一年使用:0次
2021-04-26更新
|
285次组卷
|
3卷引用:江苏省昆山市2020-2021学年高二下学期期中教学质量调研化学试题
江苏省昆山市2020-2021学年高二下学期期中教学质量调研化学试题(已下线)2.3.2 影响化学平衡状态的因素-2021-2022学年高二化学课后培优练(人教版选修4)江西省吉安市(吉安县三中、泰和二中、安福二中、井大附中 )2021-2022学年高二上学期9月联考化学试题



