名校
解题方法
1 . 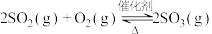
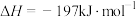 该反应在工业制备硫酸中有重要应用。下列叙述正确的是
该反应在工业制备硫酸中有重要应用。下列叙述正确的是
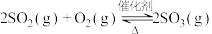
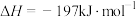 该反应在工业制备硫酸中有重要应用。下列叙述正确的是
该反应在工业制备硫酸中有重要应用。下列叙述正确的是| A.达到反应限度时,反应放出197kJ的热量 |
B.提高反应温度,可实现 的完全转化 的完全转化 |
C.工业生产中可通过增大 浓度来提升 浓度来提升 转化率 转化率 |
D.工业制备硫酸过程中将生成的 用水吸收制得 用水吸收制得 |
您最近一年使用:0次
2023-05-17更新
|
362次组卷
|
2卷引用:辽宁省辽东区域教育科研共同体2022--2023学年高一下学期期中调研化学试题
名校
2 . 可逆反应2SO2+O2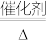 2SO3 △H<0,开始把2molSO2和1molO2充入容积为2L的恒容密闭容器中,在500℃条件下达化学平衡,下列说法中正确的是
2SO3 △H<0,开始把2molSO2和1molO2充入容积为2L的恒容密闭容器中,在500℃条件下达化学平衡,下列说法中正确的是
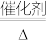 2SO3 △H<0,开始把2molSO2和1molO2充入容积为2L的恒容密闭容器中,在500℃条件下达化学平衡,下列说法中正确的是
2SO3 △H<0,开始把2molSO2和1molO2充入容积为2L的恒容密闭容器中,在500℃条件下达化学平衡,下列说法中正确的是| A.升高温度平衡向正反应方向移动 |
| B.增大压强SO2的转化率增大 |
| C.加入催化剂平衡不发生移动,但反应速率加快 |
| D.只增大SO2浓度平衡不移动 |
您最近一年使用:0次
名校
解题方法
3 . 铁元素及其化合物在生活生产中有广泛的用途。回答下列问题:
(1)Fe3+与SCN-的反应常用来检验Fe3+的存在: Fe3+ + 3SCN- Fe(SCN)3
Fe(SCN)3
若溶液中含有Fe3+,则加入KSCN溶液后的现象为_________ 向加入KSCN后的混合溶液中再加入少量NaOH固体,观察到的现象是_____________ ,产生该现象的原因是________________ 。
(2)向FeSO4溶液中滴入NaOH溶液,会观察到先产生白色沉淀,后迅速变为灰绿色,久置后变为红褐色,用化学方程式说明产生该现象的原因__________________ 。
(3)FeCl3溶液常被用作蚀刻剂腐蚀印刷电路板: 2Fe3++ Cu==2Fe2+ + Cu2+在过量FeCl3溶液腐蚀印刷电路板后的溶液中,加入过量铁粉,依次发生______ 、________ 两个反应(写离子方程式),若最后溶液中有固体剩余,则溶液中不可能含有的离子是____ 。
(4)FeCl2溶液在空气中容易被氧化,0.1 mol· L-1的FeCl2溶液暴露在空气中,20min 后,Fe2+的浓度变为0.05 mol· L-1,则20 min内,以Fe2+ 表示的平均反应速率为_____________ 若要验证该溶液中Fe2+未被完全氧化,则可以需要加入_____ 若出现_________ 现象,则证明Fe2+未被完全氧化。
(5)下列有关铁及其化合物的说法正确的是________
A.铁是第四周期第VIIIB族元素
B.亚铁盐只有还原性,没有氧化性
C.铁粉和铜粉的混合物可用磁铁吸引的方法分离
D.工业上通常采用电解法来冶炼单质铁
E.Fe3O4是一种纯净物
F.铁粉和氧化铝的混合物是一种铝热剂
(1)Fe3+与SCN-的反应常用来检验Fe3+的存在: Fe3+ + 3SCN-
 Fe(SCN)3
Fe(SCN)3 若溶液中含有Fe3+,则加入KSCN溶液后的现象为
(2)向FeSO4溶液中滴入NaOH溶液,会观察到先产生白色沉淀,后迅速变为灰绿色,久置后变为红褐色,用化学方程式说明产生该现象的原因
(3)FeCl3溶液常被用作蚀刻剂腐蚀印刷电路板: 2Fe3++ Cu==2Fe2+ + Cu2+在过量FeCl3溶液腐蚀印刷电路板后的溶液中,加入过量铁粉,依次发生
(4)FeCl2溶液在空气中容易被氧化,0.1 mol· L-1的FeCl2溶液暴露在空气中,20min 后,Fe2+的浓度变为0.05 mol· L-1,则20 min内,以Fe2+ 表示的平均反应速率为
(5)下列有关铁及其化合物的说法正确的是
A.铁是第四周期第VIIIB族元素
B.亚铁盐只有还原性,没有氧化性
C.铁粉和铜粉的混合物可用磁铁吸引的方法分离
D.工业上通常采用电解法来冶炼单质铁
E.Fe3O4是一种纯净物
F.铁粉和氧化铝的混合物是一种铝热剂
您最近一年使用:0次
4 . SO2与O2在一定条件下合成SO3的反应,达到平衡时变化关系如图所示,下列说法错误的是
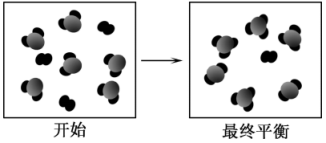

A.反应的方程式为2SO2+O2 2SO3 2SO3 |
| B.达到平衡时SO2与O2的转化率之比为1:1 |
| C.达到平衡时,断开SO2的硫氧键的个数是断开O2的氧氧键个数的4倍 |
| D.达到平衡时,增大SO2的物质的量浓度可提高反应物的转化率 |
您最近一年使用:0次



