解题方法
1 . 乙烯是一种基本化工原料,广泛应用于高新材料合成、医药合成等。工业上,乙烯的制备途径有多种。回答下列问题:
(1)二氧化碳催化加氢制备乙烯
反应原理: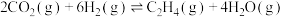
 。已知相关物质的标准摩尔生成焓数据如表所示[标准摩尔生成焓(
。已知相关物质的标准摩尔生成焓数据如表所示[标准摩尔生成焓( )是指在标准压力下,一定温度时,由元素最稳定的单质合成1摩尔物质时的反应焓变]。
)是指在标准压力下,一定温度时,由元素最稳定的单质合成1摩尔物质时的反应焓变]。
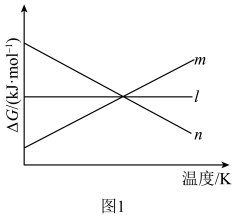
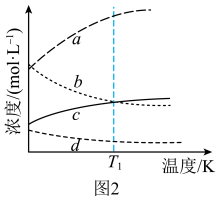
①△H=______ ;△G随着温度变化的三种趋势如图1所示,能用来表示该反应的曲线是________ (填字母标号)。 和3mol
和3mol  ,发生上述反应。平衡体系中各成分的浓度随温度的变化如图2所示。则图中代表
,发生上述反应。平衡体系中各成分的浓度随温度的变化如图2所示。则图中代表 的曲线是
的曲线是______ (填字母标号); K时,该反应的化学平衡常数
K时,该反应的化学平衡常数
___________ 。
主反应:
副反应:
某温度下,向0.5L恒容密闭容器中充入1mol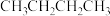 (g),发生上述反应。保持温度不变,正丁烷与乙烯的浓度随时间的变化关系如图3所示。
(g),发生上述反应。保持温度不变,正丁烷与乙烯的浓度随时间的变化关系如图3所示。
①反应开始至达平衡过程中,副反应平均反应速率v(丙烯)=_______ 。
②平衡时乙烯的选择性η(乙烯)=_________ 。
[已知选择性 ]
]
③第12min时,其他条件不变,扩大容器容积至1L,至14min体系再次达到平衡,请在图3中画出乙烯的浓度随时间的变化曲线示意图_________ 。
(1)二氧化碳催化加氢制备乙烯
反应原理:
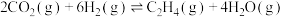
 。已知相关物质的标准摩尔生成焓数据如表所示[标准摩尔生成焓(
。已知相关物质的标准摩尔生成焓数据如表所示[标准摩尔生成焓( )是指在标准压力下,一定温度时,由元素最稳定的单质合成1摩尔物质时的反应焓变]。
)是指在标准压力下,一定温度时,由元素最稳定的单质合成1摩尔物质时的反应焓变]。物质 |
|
|
|
|
|
| 0 | 52.3 |
|
 和3mol
和3mol  ,发生上述反应。平衡体系中各成分的浓度随温度的变化如图2所示。则图中代表
,发生上述反应。平衡体系中各成分的浓度随温度的变化如图2所示。则图中代表 的曲线是
的曲线是 K时,该反应的化学平衡常数
K时,该反应的化学平衡常数
主反应:

副反应:

某温度下,向0.5L恒容密闭容器中充入1mol
 (g),发生上述反应。保持温度不变,正丁烷与乙烯的浓度随时间的变化关系如图3所示。
(g),发生上述反应。保持温度不变,正丁烷与乙烯的浓度随时间的变化关系如图3所示。①反应开始至达平衡过程中,副反应平均反应速率v(丙烯)=
②平衡时乙烯的选择性η(乙烯)=
[已知选择性
 ]
]③第12min时,其他条件不变,扩大容器容积至1L,至14min体系再次达到平衡,请在图3中画出乙烯的浓度随时间的变化曲线示意图

您最近半年使用:0次
2 . 探究外界因素对化学平衡的影响
Ⅰ. 利用“[Cu(H2O)4]2+(蓝色)+4Cl- [CuCl4]2-(黄色)+4H2O ΔH > 0”探究温度和浓度对化学平衡的影响。
[CuCl4]2-(黄色)+4H2O ΔH > 0”探究温度和浓度对化学平衡的影响。
实验过程:常温下,将CuCl2溶于水中得到CuCl2浓溶液,获得黄绿色溶液。并平均分为5份置于5个试管中并标记为a、b、c、d、e号试管
(1)b号试管的实验现象为________ ,c号试管相对于a号试管来说,c的溶液由黄绿色变为________ (填“蓝”或“黄”)色。对比a、b、c三支试管颜色变化,得到的结论是________________ 。
(2)对比a、d、e三支试管颜色变化,得到的结论是________ 。
Ⅱ.利用2N2O5(g) 4NO2(g) +O2(g)探究压强对化学平衡的影响。(已知:N2O5是一种无色气体)
4NO2(g) +O2(g)探究压强对化学平衡的影响。(已知:N2O5是一种无色气体)
在初始体积为V 的、无色透明的、带有活塞的石英玻璃容器中充入一定量N2O5,将温度升到一定温度并保持不变使其充分反应,如下图所示。
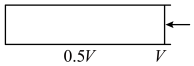
(3)待反应充分反应后,将容器的容积压缩为0.5V,可以观察到“混合气体颜色先快速变深,然后缓慢变浅”,说明该反应的平衡________ (填“正向”、“逆向”或“不”)移动;再将容积扩大到V,可以观察到“混合气体颜色先快速变浅,然后缓慢加深”,说明该反应的平衡________ (填“正向”、“逆向”或“不”)移动;
(4)通过上述实验,压强对化学平衡的影响是:________ 。
Ⅰ. 利用“[Cu(H2O)4]2+(蓝色)+4Cl-
 [CuCl4]2-(黄色)+4H2O ΔH > 0”探究温度和浓度对化学平衡的影响。
[CuCl4]2-(黄色)+4H2O ΔH > 0”探究温度和浓度对化学平衡的影响。实验过程:常温下,将CuCl2溶于水中得到CuCl2浓溶液,获得黄绿色溶液。并平均分为5份置于5个试管中并标记为a、b、c、d、e号试管
| 试管编号 | 处理方式 |
| a | 加入1ml 的水 |
| b | 加入1mL 0.1mol·L-1 AgNO3溶液(足量)充分反应 |
| c | 加入1ml 0.1mol·L-1 NaCl溶液(足量)充分反应 |
| d | 加入1mL 的水 并置于50℃的热水浴中充分反应 |
| e | 加入1mL 的水 并置于冰水浴中充分反应 |
(1)b号试管的实验现象为
(2)对比a、d、e三支试管颜色变化,得到的结论是
Ⅱ.利用2N2O5(g)
 4NO2(g) +O2(g)探究压强对化学平衡的影响。(已知:N2O5是一种无色气体)
4NO2(g) +O2(g)探究压强对化学平衡的影响。(已知:N2O5是一种无色气体)在初始体积为V 的、无色透明的、带有活塞的石英玻璃容器中充入一定量N2O5,将温度升到一定温度并保持不变使其充分反应,如下图所示。

(3)待反应充分反应后,将容器的容积压缩为0.5V,可以观察到“混合气体颜色先快速变深,然后缓慢变浅”,说明该反应的平衡
(4)通过上述实验,压强对化学平衡的影响是:
您最近半年使用:0次
名校
解题方法
3 . 德国化学家Haber因发明合成氨技术获得1918年诺贝尔化学奖,如图为恒温恒压下的密闭容器进行合成氨反应的 图象,下列说法正确的是
图象,下列说法正确的是
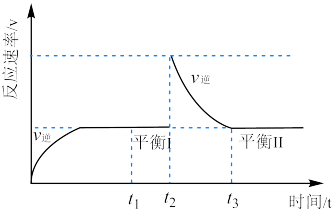
 图象,下列说法正确的是
图象,下列说法正确的是
| A.氢气的体积分数:平衡Ⅰ>平衡Ⅱ |
B. 时段, 时段, |
C. 时刻改变的条件是向密闭容器中充入 时刻改变的条件是向密闭容器中充入 |
D.平衡常数: |
您最近半年使用:0次
名校
4 . Ⅰ.在硫酸工业中,通过下列反应使SO2转化为SO3:其中一步反应为2SO2(g)+O2(g)  2SO3(g) ΔH= −196.6kJ·mol-1。
2SO3(g) ΔH= −196.6kJ·mol-1。
(1)利用下表实验数据回答问题:
①应选择的温度是___________ 。
②应采用的压强是___________ ,理由是___________ 。
③实际生产中原料气含SO2为7%(体积分数)、O2为11%。O2相对过量的理由是___________ 。
Ⅱ.在一定温度下,将4.0 mol SO2与2.0 mol O2的混合气体充入容积为2 L的密闭容器中发生反应:2SO2(g)+O2(g) 2SO3(g),经过2 min达到平衡状态,SO2的平衡转化率90.0%。
2SO3(g),经过2 min达到平衡状态,SO2的平衡转化率90.0%。
(2)①该温度下此反应的化学平衡常数为K=___________ 。
②在相同温度下,某容器内c(SO2) = c(O2) = c(SO3) = 1.0 mol·L-1,则此时反应速率 v(正)___________ v(逆) (填“>”、“<”或“=”)。
Ⅲ.下图表示在密闭容器中反应:2SO2+O2 2SO3 ΔH<0 达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况。
2SO3 ΔH<0 达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况。
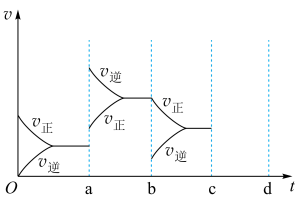
(3)若在c时刻压缩体积增大压强,请在图上将反应速率和化学平衡变化情况画在c~d处(每一时刻只改变浓度、温度、压强、催化剂条件之一)________ 。
 2SO3(g) ΔH= −196.6kJ·mol-1。
2SO3(g) ΔH= −196.6kJ·mol-1。(1)利用下表实验数据回答问题:
| 温度 | 平衡时SO2的转化率(%) | ||||
| 1×105Pa | 5×105Pa | 1×106Pa | 5×106Pa | 1×107Pa | |
| 450℃ | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 550℃ | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
②应采用的压强是
③实际生产中原料气含SO2为7%(体积分数)、O2为11%。O2相对过量的理由是
Ⅱ.在一定温度下,将4.0 mol SO2与2.0 mol O2的混合气体充入容积为2 L的密闭容器中发生反应:2SO2(g)+O2(g)
 2SO3(g),经过2 min达到平衡状态,SO2的平衡转化率90.0%。
2SO3(g),经过2 min达到平衡状态,SO2的平衡转化率90.0%。(2)①该温度下此反应的化学平衡常数为K=
②在相同温度下,某容器内c(SO2) = c(O2) = c(SO3) = 1.0 mol·L-1,则此时反应速率 v(正)
Ⅲ.下图表示在密闭容器中反应:2SO2+O2
 2SO3 ΔH<0 达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况。
2SO3 ΔH<0 达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况。
(3)若在c时刻压缩体积增大压强,请在图上将反应速率和化学平衡变化情况画在c~d处(每一时刻只改变浓度、温度、压强、催化剂条件之一)
您最近半年使用:0次
解题方法
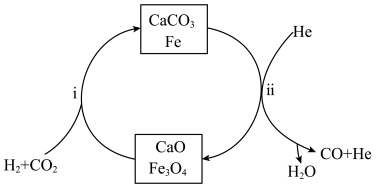
5 . “碳达峰、碳中和”是我国社会发展重大战略之一, 的综合利用是实现“碳达峰、碳中和”的有效途径,以下为常见的两种利用
的综合利用是实现“碳达峰、碳中和”的有效途径,以下为常见的两种利用 的方法。
的方法。
方法I: 加氢制备合成气
加氢制备合成气
在一定温度、压强为 条件下,
条件下, 和
和 按照1:1投料,反应经图所示过程,可实现二氧化碳的高效转化。
按照1:1投料,反应经图所示过程,可实现二氧化碳的高效转化。
相关化学键的键能数据如下表:
(1)该反应的热化学方程式为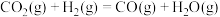
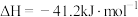 ,则
,则
______ 。
(2)有关该反应的说法错误的是_______(填标号)。
(3)反应i达到平衡后通入 ,有利于反应ii的进行,结合平衡移动原理,解释原因
,有利于反应ii的进行,结合平衡移动原理,解释原因_____________________________________________ 。
方法II: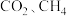 重整制备合成气
重整制备合成气
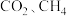 重整制备合成气时发生的反应主要有:
重整制备合成气时发生的反应主要有:
主反应: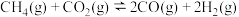

副反应: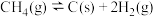
(4)在一定条件下,向 的恒容密闭容器中通入
的恒容密闭容器中通入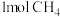 和
和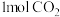 ,只发生主反应,测得平衡时压强变为原来的1.5倍,则该反应的平衡常数
,只发生主反应,测得平衡时压强变为原来的1.5倍,则该反应的平衡常数
__________ 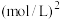 。
。
(5)主反应的反应速率 ,
, ,
,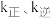 符合阿伦尼乌斯公式
符合阿伦尼乌斯公式 (Ea为活化能、T为温度,R、C为常数),实验测得
(Ea为活化能、T为温度,R、C为常数),实验测得 的实验数据如图所示,则该反应正反应的活化能为
的实验数据如图所示,则该反应正反应的活化能为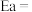
________  ,升高温度时,
,升高温度时,
_____ (填“增大”、“减小”或“不变”)。
(6)一定条件下重整反应中会因发生副反应产生积碳而导致催化剂活性降低,若向容器中通入过量水蒸气可以清除积碳,反应的化学方程式为__________ , 的值
的值__________ (填“增大”、“减小”或“不变”)。
 的综合利用是实现“碳达峰、碳中和”的有效途径,以下为常见的两种利用
的综合利用是实现“碳达峰、碳中和”的有效途径,以下为常见的两种利用 的方法。
的方法。方法I:
 加氢制备合成气
加氢制备合成气在一定温度、压强为
 条件下,
条件下, 和
和 按照1:1投料,反应经图所示过程,可实现二氧化碳的高效转化。
按照1:1投料,反应经图所示过程,可实现二氧化碳的高效转化。相关化学键的键能数据如下表:

化学键 |
|
|
|
|
键能E/( | 745 | a | 1046 | 436 |
(1)该反应的热化学方程式为
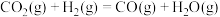
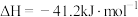 ,则
,则
(2)有关该反应的说法错误的是_______(填标号)。
| A.当装置内的气体压强不变时,反应达到平衡状态 |
B.若在反应中能及时分离出 ,可以提高 ,可以提高 的转化率 的转化率 |
C.反应ii的总反应为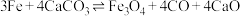 |
D.选择合适的催化剂会提高平衡时 的产率 的产率 |
(3)反应i达到平衡后通入
 ,有利于反应ii的进行,结合平衡移动原理,解释原因
,有利于反应ii的进行,结合平衡移动原理,解释原因方法II:
 重整制备合成气
重整制备合成气 重整制备合成气时发生的反应主要有:
重整制备合成气时发生的反应主要有:主反应:
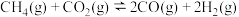

副反应:
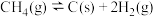
(4)在一定条件下,向
 的恒容密闭容器中通入
的恒容密闭容器中通入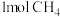 和
和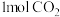 ,只发生主反应,测得平衡时压强变为原来的1.5倍,则该反应的平衡常数
,只发生主反应,测得平衡时压强变为原来的1.5倍,则该反应的平衡常数
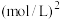 。
。(5)主反应的反应速率
 ,
, ,
,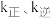 符合阿伦尼乌斯公式
符合阿伦尼乌斯公式 (Ea为活化能、T为温度,R、C为常数),实验测得
(Ea为活化能、T为温度,R、C为常数),实验测得 的实验数据如图所示,则该反应正反应的活化能为
的实验数据如图所示,则该反应正反应的活化能为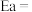
 ,升高温度时,
,升高温度时,

(6)一定条件下重整反应中会因发生副反应产生积碳而导致催化剂活性降低,若向容器中通入过量水蒸气可以清除积碳,反应的化学方程式为
 的值
的值
您最近半年使用:0次
名校
6 . 下列实验方案设计、现象和结论都正确的是
| 选项 | 目的 | 方案设计和现象 | 结论 |
| A | 证明 是弱电解质 是弱电解质 | 用pH计分别测量醋酸溶液和盐酸的pH,醋酸溶液的pH大 |  是弱电解质 是弱电解质 |
| B | 探究压强对化学平衡的影响 | 先将注射器充满 气体,然后将活塞往里推,注射器内气体颜色加深 气体,然后将活塞往里推,注射器内气体颜色加深 | 加压,平衡向生成 气体的方向移动 气体的方向移动 |
| C | 探究浓度对化学平衡的影响 | 向 (黄色)溶液中缓慢滴加硫酸,溶液由黄色变为橙色 (黄色)溶液中缓慢滴加硫酸,溶液由黄色变为橙色 | 增大 浓度,平衡向生成 浓度,平衡向生成 (橙色)方向移动 (橙色)方向移动 |
| D | 比较 、 、 催化分解 催化分解 的效率 的效率 | 向两份等浓度、等体积且等温的过氧化氢溶液中分别加入2滴等浓度的 溶液和 溶液和 溶液,前者产生气泡较快 溶液,前者产生气泡较快 | 催化效率: |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
7 . 恒温恒容条件下,反应 分两步进行,①
分两步进行,① 、②
、② 的能量-反应过程图如下所示。
的能量-反应过程图如下所示。
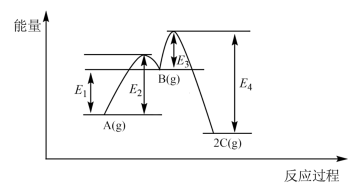
下列有关该反应的叙述正确的是
 分两步进行,①
分两步进行,① 、②
、② 的能量-反应过程图如下所示。
的能量-反应过程图如下所示。
下列有关该反应的叙述正确的是
A.加入催化剂, 减小 减小 |
B.总反应的能量变化为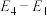 |
C.起始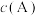 越大,A的转化率越高 越大,A的转化率越高 |
| D.反应②在升高温度时,平衡向逆反应方向移动 |
您最近半年使用:0次
名校
8 . 化学与生产、生活密切相关。下列事实与平衡无关的是
| A.肥皂水呈碱性 |
| B.工业合成氨中分离出氨气 |
| C.第19届杭州亚运公开幕式采用电子烟花 |
| D.用饱和氯化铵溶液清洗金属器皿表面的锈迹 |
您最近半年使用:0次
名校
9 . 根据实验目的,下列实验及现象、结论正确的是
| 选项 | 实验目的 | 实验及现象 | 结论 |
| A | 探究温度对平衡移动的影响 | 向试管中加入2mL CuCl2溶液,CuCl2溶液存在 CuCl2溶液,CuCl2溶液存在   ,加热试管,溶液由蓝绿色变为黄绿色 ,加热试管,溶液由蓝绿色变为黄绿色 | 其他条件不变时,升高温度,平衡向吸热反应方向移动 |
| B | 探究氢离子浓度对 、 、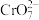 相互转化的影响 相互转化的影响 | 向2mL K2Cr2O7溶液中滴加5~10滴 K2Cr2O7溶液中滴加5~10滴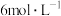 NaOH溶液,溶液变为黄色 NaOH溶液,溶液变为黄色 | 其他条件不变时,减小氢离子浓度,平衡向生成 的方向移动 的方向移动 |
| C | 探究压强对平衡移动的影响 | 用注射器吸入20mLNO2和N2O4混合气体,向内推动注射器,混合气体颜色加深 | 其他条件不变时,加压,平衡向生成NO2的方向移动 |
| D | 验证CH3COOH和H2CO3的酸性 | 向盛有2mL1mol/L的Na2CO3溶液中,逐滴加入同体积同浓度的CH3COOH溶液,无气泡产生 | 酸性强弱: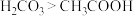 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
10 . 如图表示 2A(g)  B(g)(吸热反应),达到平衡后,t1时间改变某个反应条件时,所引起正、逆反应速率的变化情况,按图分析,所改变的外界条件可能是
B(g)(吸热反应),达到平衡后,t1时间改变某个反应条件时,所引起正、逆反应速率的变化情况,按图分析,所改变的外界条件可能是
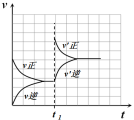
 B(g)(吸热反应),达到平衡后,t1时间改变某个反应条件时,所引起正、逆反应速率的变化情况,按图分析,所改变的外界条件可能是
B(g)(吸热反应),达到平衡后,t1时间改变某个反应条件时,所引起正、逆反应速率的变化情况,按图分析,所改变的外界条件可能是 
| A.升高温度 | B.降低温度 | C.增大A的浓度 | D.增大B的浓度 |
您最近半年使用:0次



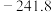




 )
)

