名校
解题方法
1 . 聚醋酸乙烯酯难溶于水,可用作白乳胶、塑料薄膜和涂料等,用它可得到聚乙烯醇,聚乙烯醇水溶液可用作医用滴眼液。合成路线如下:
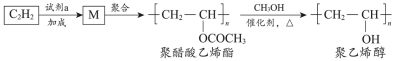
已知: (R’、
(R’、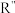 不同的羟基)
不同的羟基)
下列说法不正确 的是

已知:
 (R’、
(R’、 不同的羟基)
不同的羟基)下列说法
| A.试剂a是乙酸 |
| B.通过增加甲醇用量可提高聚乙烯醇的产率 |
| C.由M转化为聚醋酸乙烯酯的过程中发生了缩聚反应 |
| D.由聚醋酸乙烯酯转化为聚乙烯醇过程中还会生成乙酸甲酯 |
您最近一年使用:0次
解题方法
2 . 肉桂酸是香料、化妆品、医药、塑料和感光树脂等的重要原料。实验室可用苯甲醛和乙酸酐、醋酸钠等原料经下列反应制取肉桂酸,其中苯甲醛为无色油状液体。已知:
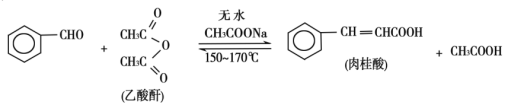
I.合成:反应装置如图所示。向三颈烧瓶中先后加入研细的无水醋酸钠、4.8g苯甲醛和5.6g乙酸酐,振荡使之混合均匀。在150~170℃加热1小时,保持微沸状态。
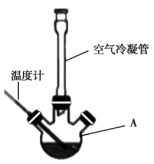
(1)仪器A的名称为____ 。
(2)空气冷凝管的作用是____ ,该装置加热要控制反应呈微沸状态,如果剧烈沸腾,会导致肉桂酸产率降低,可能的原因是____ 。
(3)不能把无水CH3COONa换成CH3COONa•3H2O的原因是____ 。
II.粗品精制:已知水蒸气蒸馏是分离提纯有机化合物的重要方法之一,在水蒸气蒸馏操作中,水蒸气起到载热体和降低沸点的作用,可使待提纯的有机物在低于100℃的情况下随水蒸气一起被蒸馏出来,从而达到分离提纯的目的。
将上述反应后得到的混合物趁热倒入圆底烧瓶中,进行下列操作:
a.在搅拌下,向反应液中加入20mL水
b.再慢慢加入碳酸钠溶液
c.然后进行水蒸气蒸馏
d.待烧瓶内溶液冷却至室温,在搅拌下,加入盐酸酸化,析出大量晶体,过滤,洗涤,干燥。
(4)饱和Na2CO3溶液的作用有____ 。水蒸气蒸馏可除去的杂质是____ ;如何判断蒸馏终点____ 。
(5)若得到的肉桂酸晶体产品不纯,应采用____ 法可得到纯度更高的产品。
(6)若最后得到纯净的肉桂酸5.2g,则该反应中的产率是____ (保留两位有效数字)。

| 苯甲醛 | 乙酸酐 | 肉桂酸 | 乙酸 | |
| 溶解度(25℃,g/100g水) | 0.3 | 遇水易水解成乙酸 | 0.04 | 互溶 |
| 沸点(℃) | 179.6 | 138.6 | 300 | 118 |
| 相对分子质量 | 106 | 102 | 148 | 60 |

(1)仪器A的名称为
(2)空气冷凝管的作用是
(3)不能把无水CH3COONa换成CH3COONa•3H2O的原因是
II.粗品精制:已知水蒸气蒸馏是分离提纯有机化合物的重要方法之一,在水蒸气蒸馏操作中,水蒸气起到载热体和降低沸点的作用,可使待提纯的有机物在低于100℃的情况下随水蒸气一起被蒸馏出来,从而达到分离提纯的目的。
将上述反应后得到的混合物趁热倒入圆底烧瓶中,进行下列操作:
a.在搅拌下,向反应液中加入20mL水
b.再慢慢加入碳酸钠溶液
c.然后进行水蒸气蒸馏
d.待烧瓶内溶液冷却至室温,在搅拌下,加入盐酸酸化,析出大量晶体,过滤,洗涤,干燥。
(4)饱和Na2CO3溶液的作用有
(5)若得到的肉桂酸晶体产品不纯,应采用
(6)若最后得到纯净的肉桂酸5.2g,则该反应中的产率是
您最近一年使用:0次
2022-09-05更新
|
260次组卷
|
2卷引用:山东省泰安市2021-2022学年高二下学期期末考试化学试题
名校
解题方法
3 . 将CO2转化成C2H4可以变废为宝、改善环境。以CO2、C2H6为原料合成C2H4涉及的主要反应如下:
Ⅰ.CO2(g) + C2H6(g) C2H4(g)+H2O(g)+CO(g) ∆H = +177 kJ·mol-1(主反应)
C2H4(g)+H2O(g)+CO(g) ∆H = +177 kJ·mol-1(主反应)
Ⅱ.C2H6(g) CH4(g)+H2(g)+C(s) ∆H = +9kJ·mol-1 (副反应)
CH4(g)+H2(g)+C(s) ∆H = +9kJ·mol-1 (副反应)
(1)反应I的反应历程可分为如下两步:
i.C2H6(g) C2H4(g)+H2(g) ∆H1 = +136 kJ·mol-1(反应速率较快)
C2H4(g)+H2(g) ∆H1 = +136 kJ·mol-1(反应速率较快)
ii.H2(g)+CO2(g) H2O(g)+CO(g) ∆H2 (反应速率较慢)
H2O(g)+CO(g) ∆H2 (反应速率较慢)
①∆H2 =______ kJ·mol-1
②相比于提高c(C2H6),提高c(CO2) 对反应I速率影响更大,原因是______ 。
(2)0.1 MPa时向密闭容器中充入CO2和C2H6,温度对催化剂K-Fe-Mn/Si-2 性能的影响如图所示:
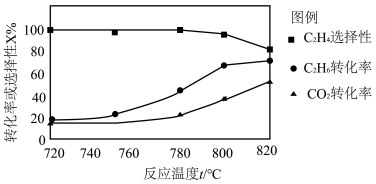
① 工业生产中反应I选择800℃,原因是______ 。
② 800℃时,不同的CO2和C2H6体积比对反应影响的实验数据如下表:
a. 随 增大, CO2转化率将
增大, CO2转化率将______ (填“增大”或“减小”)。
b. 解释 对产物中C2H4的质量分数影响的原因:
对产物中C2H4的质量分数影响的原因:______ 。
(3)我国科学家使用电化学的方法(装置如图)

用C2H6 和CO2合成了C2H4。
①N是电源的______ 极。
②阳极电极反应式是______ 。
Ⅰ.CO2(g) + C2H6(g)
 C2H4(g)+H2O(g)+CO(g) ∆H = +177 kJ·mol-1(主反应)
C2H4(g)+H2O(g)+CO(g) ∆H = +177 kJ·mol-1(主反应)Ⅱ.C2H6(g)
 CH4(g)+H2(g)+C(s) ∆H = +9kJ·mol-1 (副反应)
CH4(g)+H2(g)+C(s) ∆H = +9kJ·mol-1 (副反应)(1)反应I的反应历程可分为如下两步:
i.C2H6(g)
 C2H4(g)+H2(g) ∆H1 = +136 kJ·mol-1(反应速率较快)
C2H4(g)+H2(g) ∆H1 = +136 kJ·mol-1(反应速率较快)ii.H2(g)+CO2(g)
 H2O(g)+CO(g) ∆H2 (反应速率较慢)
H2O(g)+CO(g) ∆H2 (反应速率较慢)①∆H2 =
②相比于提高c(C2H6),提高c(CO2) 对反应I速率影响更大,原因是
(2)0.1 MPa时向密闭容器中充入CO2和C2H6,温度对催化剂K-Fe-Mn/Si-2 性能的影响如图所示:

① 工业生产中反应I选择800℃,原因是
② 800℃时,不同的CO2和C2H6体积比对反应影响的实验数据如下表:
 | 平衡时有机产物的质量分数 | |
| CH4 | C2H4 | |
| 15.0/15.0 | 7.7 | 92.3 |
| 20.0/10.0 | 6.4 | 93.6 |
| 24.0 /6.0 | 4.5 | 95.5 |
 增大, CO2转化率将
增大, CO2转化率将b. 解释
 对产物中C2H4的质量分数影响的原因:
对产物中C2H4的质量分数影响的原因:(3)我国科学家使用电化学的方法(装置如图)

用C2H6 和CO2合成了C2H4。
①N是电源的
②阳极电极反应式是
您最近一年使用:0次
2020-11-09更新
|
274次组卷
|
4卷引用:北京市北京交通大学附属中学2020-2021学年高二上学期期末练习化学试题
4 . CO2是一种常用的化工原料。
Ⅰ.以CO2与NH3为原料可以合成尿素[CO(NH2)2]。合成尿素的反应为2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g)。
CO(NH2)2(s)+H2O(g)。
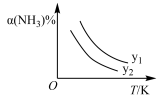
(1)在不同温度及不同y值下合成尿素,达到平衡时,氨气转化率变化情况如图所示。该反应的ΔH_____ 0(填“>”、“<”或“=”,下同),若y表示压强,则y1_______ y2 , 若y表示反应开始时的水碳比[n(NH3)/n(CO2)],则y1_______ y2。
(2)t℃时,若向容积为2L的密闭容器中加入3molNH3和1molCO2,达到平衡时,容器内压强为开始时的0.75倍。若保持条件不变,再向该容器中加入0.5molCO2和1molH2O,NH3的转化率将__________ (填“增大”、“减小”或“不变”)。
Ⅱ.CO2与H2反应可用于生产甲醇。
(3)已知氢气与甲醇的燃烧热分别为-285.8 kJ·mol-1、-726.5kJ·mol-1,则CO2与H2反应产生液态甲醇与液态水的热化学方程式为________________ 。
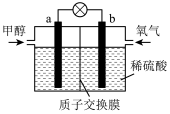
(4)下图是某甲醇燃料电池工作的示意图。质子交换膜(只有质子能够通过)左右两侧的溶液均为1L 2mol·L-1 H2SO4溶液。电极a上发生的电极反应式为________________________ ,当电池中有1mol e-发生转移时左右两侧溶液的质量之差为______ g (假设反应物耗尽,忽略气体的溶解)。
Ⅰ.以CO2与NH3为原料可以合成尿素[CO(NH2)2]。合成尿素的反应为2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(g)。
CO(NH2)2(s)+H2O(g)。 (1)在不同温度及不同y值下合成尿素,达到平衡时,氨气转化率变化情况如图所示。该反应的ΔH

(2)t℃时,若向容积为2L的密闭容器中加入3molNH3和1molCO2,达到平衡时,容器内压强为开始时的0.75倍。若保持条件不变,再向该容器中加入0.5molCO2和1molH2O,NH3的转化率将
Ⅱ.CO2与H2反应可用于生产甲醇。
(3)已知氢气与甲醇的燃烧热分别为-285.8 kJ·mol-1、-726.5kJ·mol-1,则CO2与H2反应产生液态甲醇与液态水的热化学方程式为
(4)下图是某甲醇燃料电池工作的示意图。质子交换膜(只有质子能够通过)左右两侧的溶液均为1L 2mol·L-1 H2SO4溶液。电极a上发生的电极反应式为

您最近一年使用:0次
2019-02-20更新
|
136次组卷
|
2卷引用:福建省泉州市泉港区第一中学2018-2019学年高二上学期期末考试化学试题



