名校
1 . 在双碳目标驱动下,大批量氢燃料客车在2022年北京冬奥会上投入使用。氢源的获取和利用成为科学研究热点。回答下列问题:
Ⅰ.氢源的获取:电解液氨制氢
氨分子中具有较高的含氢量,因此是制氢的优选原料。现以液氨为原料,使用 非水电解质电解制氢。(已知:电解过程中电解液内含氮微粒只有
非水电解质电解制氢。(已知:电解过程中电解液内含氮微粒只有 、
、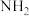 和
和 )
)
(1)产生 的电极反应式为
的电极反应式为______ 。
Ⅱ.氢源的利用: 还原
还原 制甲醇
制甲醇
(2)800℃时, 还原
还原 反应的热化学方程式及其平衡常数如下:
反应的热化学方程式及其平衡常数如下:
反应1:
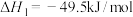

反应2: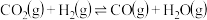

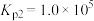
反应3: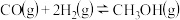

______ 
(3)800℃时,正反应进行的程度“反应2”______ “反应1”(选填“>”或“<”),判断依据是______ 。
(4)反应1在一定条件下建立平衡,关于反应1的相关描述正确的是______。
(5)某温度下,向2L恒容密闭容器中充入0.5mol 和0.9mol
和0.9mol 发生反应1和反应2,经过5min达到平衡状态,反应过程中
发生反应1和反应2,经过5min达到平衡状态,反应过程中 和
和 的物质的量随时间变化情况如下图所示:
的物质的量随时间变化情况如下图所示:
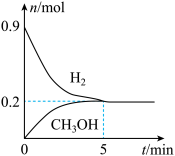
平衡时, 的转化率为
的转化率为______ ,该温度下,反应2的化学平衡常数
______ 。
(6) 用途广泛,写出基于其物理性质的一种用途:
用途广泛,写出基于其物理性质的一种用途:______ 。
Ⅰ.氢源的获取:电解液氨制氢
氨分子中具有较高的含氢量,因此是制氢的优选原料。现以液氨为原料,使用
 非水电解质电解制氢。(已知:电解过程中电解液内含氮微粒只有
非水电解质电解制氢。(已知:电解过程中电解液内含氮微粒只有 、
、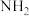 和
和 )
)(1)产生
 的电极反应式为
的电极反应式为Ⅱ.氢源的利用:
 还原
还原 制甲醇
制甲醇(2)800℃时,
 还原
还原 反应的热化学方程式及其平衡常数如下:
反应的热化学方程式及其平衡常数如下:反应1:


反应2:
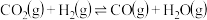

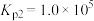
反应3:
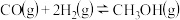


(3)800℃时,正反应进行的程度“反应2”
(4)反应1在一定条件下建立平衡,关于反应1的相关描述正确的是______。
| A.使用高效催化剂可降低反应的活化能,增大活化分子百分数,加快化学反应速率 |
| B.该反应的反应物总能量小于生成物总能量 |
| C.容器内气体的平均相对分子质量不再改变说明反应达到了平衡 |
D.增大压强,反应1的化学平衡常数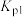 变小 变小 |
 和0.9mol
和0.9mol 发生反应1和反应2,经过5min达到平衡状态,反应过程中
发生反应1和反应2,经过5min达到平衡状态,反应过程中 和
和 的物质的量随时间变化情况如下图所示:
的物质的量随时间变化情况如下图所示:
平衡时,
 的转化率为
的转化率为
(6)
 用途广泛,写出基于其物理性质的一种用途:
用途广泛,写出基于其物理性质的一种用途:
您最近一年使用:0次
2 . 甲醇是重要的化上原料,研究甲醇的制备及用途在工业上有重要的意义。回答下列问题:
(1)一种重要的工业制备甲醇的反应为
 。
。
已知:①

②
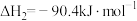
该制备反应的
______ 。升高温度,该制备反应的 的平衡转化率
的平衡转化率______ (填“增大”“减小”或“不变”)。
(2)已知反应 的
的 ,
, ,其中
,其中 、
、 分别为正、逆反应速率常数,p为气体分压(分压=总压/物质的量分数)。
分别为正、逆反应速率常数,p为气体分压(分压=总压/物质的量分数)。
在540K下,按初始投料比 、
、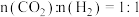 、
、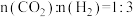 ,得到不同压强条件下
,得到不同压强条件下 的平衡转化率关系图:
的平衡转化率关系图:
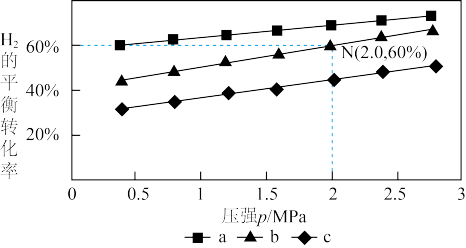
①a、b、c各曲线所表示的投料比由大到小的顺序为______ (用字母表示)。
②N点在b曲线上,540K时的压强平衡常数
______  (用平衡分压代替平衡浓度计算)。
(用平衡分压代替平衡浓度计算)。
③540K条件下,某容器测得某时刻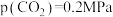 ,
, ,
,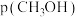
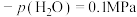 ,此时
,此时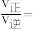
______ (保留两位小数)。
(3)甲醇催化可制取丙烯,反应为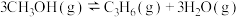 ,反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arrhenius经验公式为
,反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arrhenius经验公式为 (
( 为活化能,k为速率常数,R和C为常数)。该反应的活化能
为活化能,k为速率常数,R和C为常数)。该反应的活化能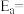
______  。
。
(4)Kistiakowsky曾研究了NOCl光化学分解反应。在一定频率(v)光的照射下,反应的机理为:
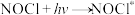

其中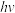 表示一个光子能量,
表示一个光子能量, 表示NOCl的激发态。则吸收1mol光子可分解
表示NOCl的激发态。则吸收1mol光子可分解______ mol NOCl。
(5)在饱和 电解液中,电解活化的
电解液中,电解活化的 也可以制备
也可以制备 ,其原理如图所示,则阴极的电极反应式为
,其原理如图所示,则阴极的电极反应式为______ 。
(1)一种重要的工业制备甲醇的反应为

 。
。已知:①


②

该制备反应的

 的平衡转化率
的平衡转化率(2)已知反应
 的
的 ,
, ,其中
,其中 、
、 分别为正、逆反应速率常数,p为气体分压(分压=总压/物质的量分数)。
分别为正、逆反应速率常数,p为气体分压(分压=总压/物质的量分数)。在540K下,按初始投料比
 、
、 、
、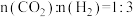 ,得到不同压强条件下
,得到不同压强条件下 的平衡转化率关系图:
的平衡转化率关系图:
①a、b、c各曲线所表示的投料比由大到小的顺序为
②N点在b曲线上,540K时的压强平衡常数

 (用平衡分压代替平衡浓度计算)。
(用平衡分压代替平衡浓度计算)。③540K条件下,某容器测得某时刻
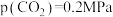 ,
, ,
,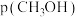
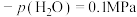 ,此时
,此时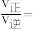
(3)甲醇催化可制取丙烯,反应为
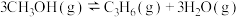 ,反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arrhenius经验公式为
,反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arrhenius经验公式为 (
( 为活化能,k为速率常数,R和C为常数)。该反应的活化能
为活化能,k为速率常数,R和C为常数)。该反应的活化能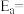
 。
。
(4)Kistiakowsky曾研究了NOCl光化学分解反应。在一定频率(v)光的照射下,反应的机理为:
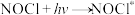

其中
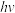 表示一个光子能量,
表示一个光子能量, 表示NOCl的激发态。则吸收1mol光子可分解
表示NOCl的激发态。则吸收1mol光子可分解(5)在饱和
 电解液中,电解活化的
电解液中,电解活化的 也可以制备
也可以制备 ,其原理如图所示,则阴极的电极反应式为
,其原理如图所示,则阴极的电极反应式为
您最近一年使用:0次
3 . 甲醇是一种用途非常广泛的基础化工原料,可通过下列反应合成:
Ⅰ.CO(g)+2H2(g) CH3OH(g)△H1
CH3OH(g)△H1
Ⅱ.CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H2
CH3OH(g)+H2O(g)△H2
Ⅲ.CO(g)+H2O(g) CO2(g)+H2(g)△H3
CO2(g)+H2(g)△H3
回答下列问题
(1)反应(Ⅰ)的△S________ (填“>”或“<”)0,△H1=________ (用△H2、△H3表示)。
(2)上述反应的平衡常数的自然对数值lnKP(KP为以分压表示的平衡常数)与温度的关系如图甲所示
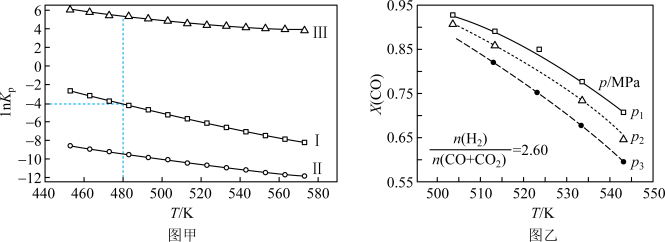
①反应(Ⅱ)的△H________ (填“>”或“<”)0。
②480K时,lnKP(Ⅰ)+lnKp(Ⅱ)+lnKp(Ⅲ)=________ 。
③某温度下,向某恒容密闭容器中充入0.1 molCO和0.2molH2发生反应(Ⅰ),达到平衡时,CO的转化率为90%,若平衡时总压强5MPa,则KP=________ (KP为以分压表示的平衡常数,分压=总压×物质的量分数)。
(3)若用CO和CO2混合气体合成甲醇,起始时均控制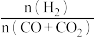 =2.60,CO的平衡转化率X(CO)与温度及压强的关系如图乙所示。下列说法正确的是
=2.60,CO的平衡转化率X(CO)与温度及压强的关系如图乙所示。下列说法正确的是_____ (填字母)。
A p1<p2<p3
B 升高温度,反应速率和X(CO)均减小
C 起始时若p2=7.2MPa,则H2的分压为5.2MPa
D 其他条件不变,增大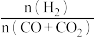 ,X(CO)增大
,X(CO)增大
Ⅰ.CO(g)+2H2(g)
 CH3OH(g)△H1
CH3OH(g)△H1Ⅱ.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)△H2
CH3OH(g)+H2O(g)△H2Ⅲ.CO(g)+H2O(g)
 CO2(g)+H2(g)△H3
CO2(g)+H2(g)△H3回答下列问题
(1)反应(Ⅰ)的△S
(2)上述反应的平衡常数的自然对数值lnKP(KP为以分压表示的平衡常数)与温度的关系如图甲所示

①反应(Ⅱ)的△H
②480K时,lnKP(Ⅰ)+lnKp(Ⅱ)+lnKp(Ⅲ)=
③某温度下,向某恒容密闭容器中充入0.1 molCO和0.2molH2发生反应(Ⅰ),达到平衡时,CO的转化率为90%,若平衡时总压强5MPa,则KP=
(3)若用CO和CO2混合气体合成甲醇,起始时均控制
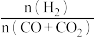 =2.60,CO的平衡转化率X(CO)与温度及压强的关系如图乙所示。下列说法正确的是
=2.60,CO的平衡转化率X(CO)与温度及压强的关系如图乙所示。下列说法正确的是A p1<p2<p3
B 升高温度,反应速率和X(CO)均减小
C 起始时若p2=7.2MPa,则H2的分压为5.2MPa
D 其他条件不变,增大
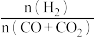 ,X(CO)增大
,X(CO)增大
您最近一年使用:0次



