名校
解题方法
1 . 中国科学家首次实现了二氧化碳到淀粉的从头合成,相关成果由国际知名学术期刊《科学》在线发表,因此CO2的捕集及其资源化利用成为科学家研究的重要课题。
I.二氧化碳合成“合成气”
(1)捕获的高浓度CO2能与CH4制备合成气(CO、H2),该过程主要涉及以下反应:
①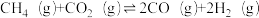 ;△H1
;△H1
②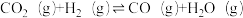 ;△H2
;△H2
③ ;△H3
;△H3
④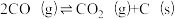 ;△H4
;△H4
根据盖斯定律,反应①的△H1=_____________ (写出代数式即可)。
Ⅱ.二氧化碳合成低碳烯烃
(2)用可再生能源电还原CO2时,采用高浓度的K+抑制酸性电解液中的析氢反应来提高乙烯的生成率,装置如图1所示。阴极发生的反应为____________ ;
每转移1mol电子,阳极生成____________ L气体(标准状况)。
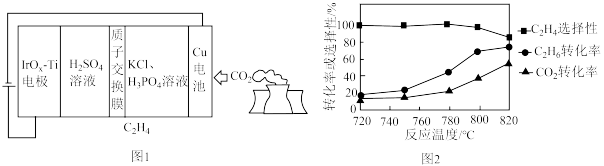
(3)以CO2、C2H6为原料合成C2H4涉及的主要反应如下:
A.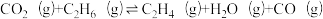 ;
; (主反应)
(主反应)
B.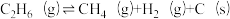 ;
;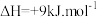 (副反应)
(副反应)
其中,反应A的反应历程可分为如下两步:
A. ;△H1(反应速率较快)
;△H1(反应速率较快)
B. ;
;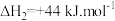 (反应速率较慢)
(反应速率较慢)
相比于提高c(C2H6),则提高c(CO2)对反应A速率影响更大,原因是____________ 。
向恒压密闭容器中充入CO2和C2H6合成C2H4,发生主反应,温度对催化剂KFeMn/Si2性能的影响如图2所示,工业生产综合各方面的因素,反应选择800℃的原因是____________ 。
Ⅲ.二氧化碳合成甲醇
主反应: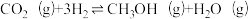 ;
;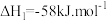
副反应: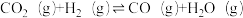 ;
;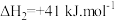
某一刚性容器中充入1molCO2和3molH2,在催化剂存在条件下进行反应,测得温度与平衡转化率、产物选择性的关系如图3所示。已知:CH3OH选择性=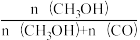
(4)240℃平衡时,生成的CH3OH的物质的量是____________ 。

Ⅳ、新型二氧化碳固定法
(5)某课题组设计一种新型的固定CO2方法,如图4所示。若原料用 ,则产物为
,则产物为____________ 。
I.二氧化碳合成“合成气”
(1)捕获的高浓度CO2能与CH4制备合成气(CO、H2),该过程主要涉及以下反应:
①
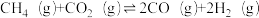 ;△H1
;△H1②
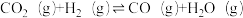 ;△H2
;△H2③
 ;△H3
;△H3④
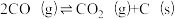 ;△H4
;△H4根据盖斯定律,反应①的△H1=
Ⅱ.二氧化碳合成低碳烯烃
(2)用可再生能源电还原CO2时,采用高浓度的K+抑制酸性电解液中的析氢反应来提高乙烯的生成率,装置如图1所示。阴极发生的反应为
每转移1mol电子,阳极生成
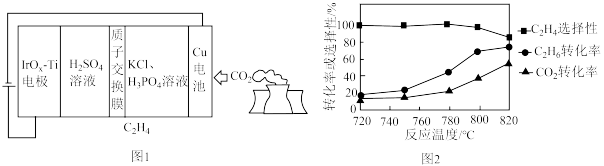
(3)以CO2、C2H6为原料合成C2H4涉及的主要反应如下:
A.
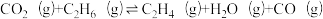 ;
; (主反应)
(主反应)B.
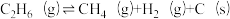 ;
;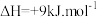 (副反应)
(副反应)其中,反应A的反应历程可分为如下两步:
A.
 ;△H1(反应速率较快)
;△H1(反应速率较快)B.
 ;
;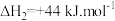 (反应速率较慢)
(反应速率较慢)相比于提高c(C2H6),则提高c(CO2)对反应A速率影响更大,原因是
向恒压密闭容器中充入CO2和C2H6合成C2H4,发生主反应,温度对催化剂KFeMn/Si2性能的影响如图2所示,工业生产综合各方面的因素,反应选择800℃的原因是
Ⅲ.二氧化碳合成甲醇
主反应:
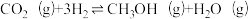 ;
;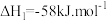
副反应:
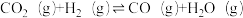 ;
;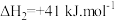
某一刚性容器中充入1molCO2和3molH2,在催化剂存在条件下进行反应,测得温度与平衡转化率、产物选择性的关系如图3所示。已知:CH3OH选择性=
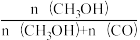
(4)240℃平衡时,生成的CH3OH的物质的量是

Ⅳ、新型二氧化碳固定法
(5)某课题组设计一种新型的固定CO2方法,如图4所示。若原料用
 ,则产物为
,则产物为
您最近一年使用:0次
2 . 当前,二氧化碳排放量逐年增加,CO2的利用和转化成为研究热点。
(1)二氧化碳加氢合成二甲醚反应包括三个相互关联的反应过程:
反应I CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)∆H=—49.01 kJ·mol-1
反应II 2CH3OH(g)⇌CH3OCH3(g)+H2O(g)∆H=—24.52 kJ·mol-1
反应Ⅲ CO2(g)+H2(g)⇌CO (g)+H2O(g)∆H= + 41.17 kJ·mol-1
在压强30MPa, =4,不同温度下CO2的平衡转化率、CO的选择性和CH3OCH3的选择性如图所示(选择性是指生成某物质消耗的CO2占CO2消耗总量的百分比):
=4,不同温度下CO2的平衡转化率、CO的选择性和CH3OCH3的选择性如图所示(选择性是指生成某物质消耗的CO2占CO2消耗总量的百分比):
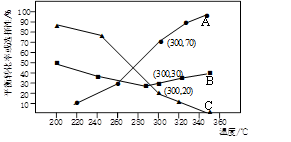
①图中三支曲线中,代表CH3OCH3选择性的是_______ (填A、B、C)。
②根据图中数据计算300℃时,CH3OCH3的平衡产率为_______ 。
(2)研究表明,Pb对不同原子的结合能力具有差异性,CO2在Pb表面电还原生成HCOOH的机理如图:
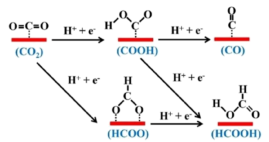
①用简洁的语言描述图中涉及的转化过程_______ 。
②为了深入理解CO2还原反应的机制,我们研究了不同条件下的反应路径以揭示不同影响因素的作用:结果表明在气相条件下,CO几乎不会生成,可能的原因是_______ 。
(3)根据热力学模拟结果,当ZnI2分解反应体系中存在CO2时,可显著提高ZnI2的分解率。
已知:Ⅰ.ZnI2+CO2=ZnO+I2+CO,碘量可通过电位滴定法测定。
Ⅱ.气流床实验系统可用于进行ZnI2-CO2反应实验研究,实验中,需要根据研究目的设计固体反应物与载气Ar、反应气体CO2的流量,使固体反应物的进料速率与质量流量满足一定关系,从而实现对初始反应物摩尔比的控制。请设计实验验证:CO2可提高ZnI2的分解率,且CO2比例越大,ZnI2的分解率越大_______ 。(可使用的试剂有纯Ar气、50%CO2载气、100%CO2载气)
(1)二氧化碳加氢合成二甲醚反应包括三个相互关联的反应过程:
反应I CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)∆H=—49.01 kJ·mol-1
反应II 2CH3OH(g)⇌CH3OCH3(g)+H2O(g)∆H=—24.52 kJ·mol-1
反应Ⅲ CO2(g)+H2(g)⇌CO (g)+H2O(g)∆H= + 41.17 kJ·mol-1
在压强30MPa,
 =4,不同温度下CO2的平衡转化率、CO的选择性和CH3OCH3的选择性如图所示(选择性是指生成某物质消耗的CO2占CO2消耗总量的百分比):
=4,不同温度下CO2的平衡转化率、CO的选择性和CH3OCH3的选择性如图所示(选择性是指生成某物质消耗的CO2占CO2消耗总量的百分比):
①图中三支曲线中,代表CH3OCH3选择性的是
②根据图中数据计算300℃时,CH3OCH3的平衡产率为
(2)研究表明,Pb对不同原子的结合能力具有差异性,CO2在Pb表面电还原生成HCOOH的机理如图:

①用简洁的语言描述图中涉及的转化过程
②为了深入理解CO2还原反应的机制,我们研究了不同条件下的反应路径以揭示不同影响因素的作用:结果表明在气相条件下,CO几乎不会生成,可能的原因是
(3)根据热力学模拟结果,当ZnI2分解反应体系中存在CO2时,可显著提高ZnI2的分解率。
已知:Ⅰ.ZnI2+CO2=ZnO+I2+CO,碘量可通过电位滴定法测定。
Ⅱ.气流床实验系统可用于进行ZnI2-CO2反应实验研究,实验中,需要根据研究目的设计固体反应物与载气Ar、反应气体CO2的流量,使固体反应物的进料速率与质量流量满足一定关系,从而实现对初始反应物摩尔比的控制。请设计实验验证:CO2可提高ZnI2的分解率,且CO2比例越大,ZnI2的分解率越大
您最近一年使用:0次
名校
解题方法
3 . 甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用 或
或 来生产燃料甲醇。
来生产燃料甲醇。
(1)已知:
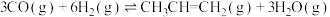
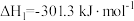

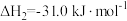
则 与
与 合成气态甲醇的热化学方程式为
合成气态甲醇的热化学方程式为___________ 。
(2)制备甲醇的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
①反应的平衡常数
___________ (用 、
、 表示),500℃时
表示),500℃时
___________ 。
②500℃时,测得反应III在某时刻 、
、 、
、 、
、 的浓度(
的浓度( )分别为0.8、0.1、0.3、0.15,则此时
)分别为0.8、0.1、0.3、0.15,则此时
___________  (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
③500℃时,2L密闭容器中投入amol 、bmol
、bmol 发生反应I,测得平街时
发生反应I,测得平街时 、
、 的浓度(
的浓度( )分别为0.2、0.1则:
)分别为0.2、0.1则:
___________ ,平衡时 的转化率为
的转化率为___________ 。若向平衡后的容器中再投入anol 、bmol
、bmol ,达平衡后,
,达平衡后, 的体积分数与原平衡相比
的体积分数与原平衡相比___________ (填“增大”、“减小”或“不变”)
(3)某科研小组在500℃、 作催化剂的条件下依据反应I合成甲醇,研究了
作催化剂的条件下依据反应I合成甲醇,研究了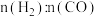 分别为
分别为 、
、 时
时 的转化率变化情况,如图所示:
的转化率变化情况,如图所示:
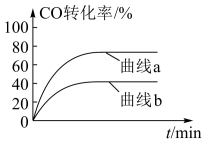
则图中表示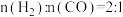 的变化曲线为
的变化曲线为___________ (填“曲线a”或“曲线b”),原因是___________ 。
 或
或 来生产燃料甲醇。
来生产燃料甲醇。(1)已知:
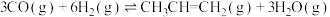
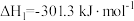

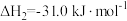
则
 与
与 合成气态甲醇的热化学方程式为
合成气态甲醇的热化学方程式为(2)制备甲醇的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
| 化学反应 | 平衡常数 | 温度/℃ | |
| 500 | 800 | ||
I. |  | 2.5 | 0.15 |
II. |  | 1.0 | 2.50 |
III.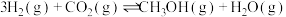 |  | ||

 、
、 表示),500℃时
表示),500℃时
②500℃时,测得反应III在某时刻
 、
、 、
、 、
、 的浓度(
的浓度( )分别为0.8、0.1、0.3、0.15,则此时
)分别为0.8、0.1、0.3、0.15,则此时
 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。③500℃时,2L密闭容器中投入amol
 、bmol
、bmol 发生反应I,测得平街时
发生反应I,测得平街时 、
、 的浓度(
的浓度( )分别为0.2、0.1则:
)分别为0.2、0.1则:
 的转化率为
的转化率为 、bmol
、bmol ,达平衡后,
,达平衡后, 的体积分数与原平衡相比
的体积分数与原平衡相比(3)某科研小组在500℃、
 作催化剂的条件下依据反应I合成甲醇,研究了
作催化剂的条件下依据反应I合成甲醇,研究了 分别为
分别为 、
、 时
时 的转化率变化情况,如图所示:
的转化率变化情况,如图所示:
则图中表示
 的变化曲线为
的变化曲线为
您最近一年使用:0次
解题方法
4 . 甲醇(CH3OH)和二甲醚(CH3OCH3)被称为21世纪的新型燃料。以CH4和H2O为原料制备二甲醚和甲醇的工业流程如下
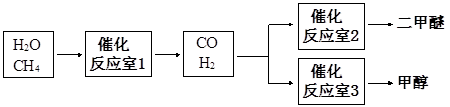
(1)写出催化反应室1中在一定条件下进行的化学方程式:______________ 。
(2)在压强为0.1MPa条件下,反应室3(容积为VL)中amolCO与2amolH2在催化剂作用下反应生成甲醇:CO(g) +2H2(g) CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,
CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,
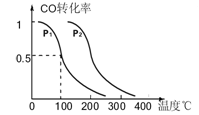
则:①P1_______ P2。(填“<”、“>”或“=”)
②在其它条件不变的情况下,反应室3再增加a mol CO与2a mol H2,达到新平衡时,CO的转化率______ 。(填“增大”、“减小”或“不变”)
③在P1压强下,100℃时,反应:CH3OH(g) CO(g)+2H2(g)的平衡常数为
CO(g)+2H2(g)的平衡常数为____ 。(用含a、V的代数式表示)。
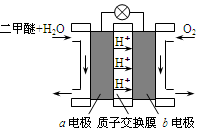
(3)下图为绿色电源“二甲醚燃料电池”的工作原理示意图,a电极的电极反应式为___ 。
(4)水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g) CH3OH(g);ΔH=-90.8 kJ·mol-1
CH3OH(g);ΔH=-90.8 kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g);ΔH=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g);ΔH=-23.5kJ·mol-1
③CO(g)+H2O(g) CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
则反应:3H2(g) +3CO(g) CH3OCH3(g)+CO2(g)的ΔH=
CH3OCH3(g)+CO2(g)的ΔH=_________ 。
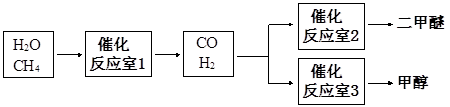
(1)写出催化反应室1中在一定条件下进行的化学方程式:
(2)在压强为0.1MPa条件下,反应室3(容积为VL)中amolCO与2amolH2在催化剂作用下反应生成甲醇:CO(g) +2H2(g)
 CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,
CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,
则:①P1
②在其它条件不变的情况下,反应室3再增加a mol CO与2a mol H2,达到新平衡时,CO的转化率
③在P1压强下,100℃时,反应:CH3OH(g)
 CO(g)+2H2(g)的平衡常数为
CO(g)+2H2(g)的平衡常数为(3)下图为绿色电源“二甲醚燃料电池”的工作原理示意图,a电极的电极反应式为

(4)水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)
 CH3OH(g);ΔH=-90.8 kJ·mol-1
CH3OH(g);ΔH=-90.8 kJ·mol-1②2CH3OH(g)
 CH3OCH3(g)+H2O(g);ΔH=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g);ΔH=-23.5kJ·mol-1③CO(g)+H2O(g)
 CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1则反应:3H2(g) +3CO(g)
 CH3OCH3(g)+CO2(g)的ΔH=
CH3OCH3(g)+CO2(g)的ΔH=
您最近一年使用:0次



