1 . 综合利用含碳资源、促进碳中和在保护生态环境等方面具有重要意义。回答下列问题:
(1)中国科学院在国际上宣布首次实现CO2到淀粉的全合成,其中前两步涉及的反应如图1所示。_______ (用△H1、△H2、△H3、△H4表示)。
②反应I进行时,同时发生反应:2CO2(g)+6H2(g) C2H4(g)+4H2O(g)。在1L恒容密闭容器中充入4.0molCO2和6.0molH2,一定温度下,达到平衡时,c(CO2)=c(H2O)=2.4mol/L,请回答下列问题:反应I的平衡常数的表达式K=
C2H4(g)+4H2O(g)。在1L恒容密闭容器中充入4.0molCO2和6.0molH2,一定温度下,达到平衡时,c(CO2)=c(H2O)=2.4mol/L,请回答下列问题:反应I的平衡常数的表达式K=_______ 。CH3OH物质的量分数为_______ %(计算结果保留1位小数)。
(2)乙烯是合成工业的重要原料,一定条件下可发生反应:3C2H4(g) 2C3H6(g)分别在不同温度、不同催化剂下,保持其他初始条件不变,重复实验,经相同时间测得C2H4体积分数与温度的关系如图2所示。
2C3H6(g)分别在不同温度、不同催化剂下,保持其他初始条件不变,重复实验,经相同时间测得C2H4体积分数与温度的关系如图2所示。_______ V逆(填“>”“<”或“=”),根据图中所给信息,应选择的反应条件为_______ 。
(3)CO2氧化1-丁烯脱氢生产1,3-丁二烯,其反应原理为:CH2=CHCH2CH3(g)+CO2(g)→CH2=CHCH=CH2(g)+H2O(g)+CO(g)氧化脱氢反应可能的反应路径有两种,如图3所示:_______ (填化学式)。
②若为“两步路径”,在温度和总压相同时,1-丁烯氧化脱氢的平衡转化率高于直接脱氢的原因是_______ 。
(1)中国科学院在国际上宣布首次实现CO2到淀粉的全合成,其中前两步涉及的反应如图1所示。
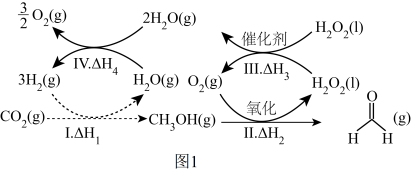
②反应I进行时,同时发生反应:2CO2(g)+6H2(g)
 C2H4(g)+4H2O(g)。在1L恒容密闭容器中充入4.0molCO2和6.0molH2,一定温度下,达到平衡时,c(CO2)=c(H2O)=2.4mol/L,请回答下列问题:反应I的平衡常数的表达式K=
C2H4(g)+4H2O(g)。在1L恒容密闭容器中充入4.0molCO2和6.0molH2,一定温度下,达到平衡时,c(CO2)=c(H2O)=2.4mol/L,请回答下列问题:反应I的平衡常数的表达式K=(2)乙烯是合成工业的重要原料,一定条件下可发生反应:3C2H4(g)
 2C3H6(g)分别在不同温度、不同催化剂下,保持其他初始条件不变,重复实验,经相同时间测得C2H4体积分数与温度的关系如图2所示。
2C3H6(g)分别在不同温度、不同催化剂下,保持其他初始条件不变,重复实验,经相同时间测得C2H4体积分数与温度的关系如图2所示。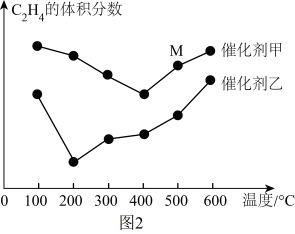
(3)CO2氧化1-丁烯脱氢生产1,3-丁二烯,其反应原理为:CH2=CHCH2CH3(g)+CO2(g)→CH2=CHCH=CH2(g)+H2O(g)+CO(g)氧化脱氢反应可能的反应路径有两种,如图3所示:
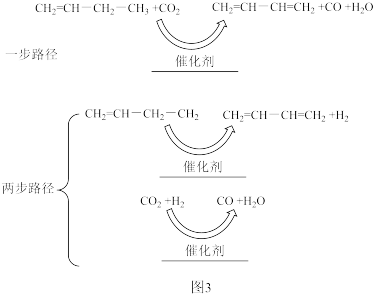
②若为“两步路径”,在温度和总压相同时,1-丁烯氧化脱氢的平衡转化率高于直接脱氢的原因是
您最近一年使用:0次
名校
解题方法
2 . 氨是工农业生产中的重要原料,研究氨的合成和转化是一项重要的科研课题。回答下列问题:
(1)已知:工业合成氨合成塔中每产生2molNH3,放出92.2kJ热量,

则1molN-H键断裂吸收的能量为___________ kJ。
(2)在密闭容器中合成氨气,有利于加快反应速率且能提高H2转化率的措施是___________(填字母)
(3)将0.6molN2和0.8molH2充入恒容密闭容器中,在不同温度下,平衡时NH3的体积分数随压强变化的曲线如图。
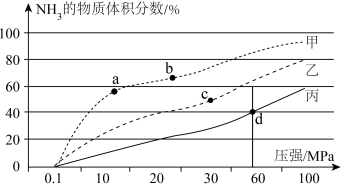
甲、乙、丙中温度从高到低的顺序是___________ 。d点N2的转化率是___________ ,d点Kp=___________ (Kp是以平衡分压表示的平衡常数,平衡分压=平衡时各组分的物质的量分数×总压)。
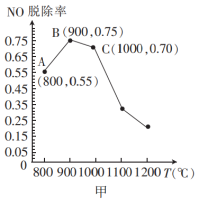
(4)催化氧化法消除NO反应原理为:6NO+4NH3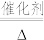 5N2+6H2O。不同温度条件下,氨气与一氧化氮的物质的量之比为2:1时,得到NO脱除率曲线如图甲所示。脱除NO的最佳温度是
5N2+6H2O。不同温度条件下,氨气与一氧化氮的物质的量之比为2:1时,得到NO脱除率曲线如图甲所示。脱除NO的最佳温度是___________ 。在温度超过1000°C时NO脱除率骤然下降的原因可能是___________ 。
(5)研究发现NH3与NO的反应历程如图乙所示。下列说法正确的是___________(填字母)。

(1)已知:工业合成氨合成塔中每产生2molNH3,放出92.2kJ热量,

则1molN-H键断裂吸收的能量为
(2)在密闭容器中合成氨气,有利于加快反应速率且能提高H2转化率的措施是___________(填字母)
| A.升高反应温度 | B.增大反应的压强 |
| C.及时移走生成的NH3 | D.增加H2的物质的量 |

甲、乙、丙中温度从高到低的顺序是
(4)催化氧化法消除NO反应原理为:6NO+4NH3
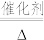 5N2+6H2O。不同温度条件下,氨气与一氧化氮的物质的量之比为2:1时,得到NO脱除率曲线如图甲所示。脱除NO的最佳温度是
5N2+6H2O。不同温度条件下,氨气与一氧化氮的物质的量之比为2:1时,得到NO脱除率曲线如图甲所示。脱除NO的最佳温度是
(5)研究发现NH3与NO的反应历程如图乙所示。下列说法正确的是___________(填字母)。

| A.该反应历程中形成了非极性键和极性键 |
| B.每生成2molN2,转移的电子总数为8NA |
| C.Fe2+能降低总反应的活化能,提高反应速率 |
| D.该反应历程中存在:NO+Fe2+-NH2=Fe2++N2↑+H2O |
您最近一年使用:0次
2023-04-16更新
|
542次组卷
|
4卷引用:2024届四川省泸县第五中学高三上学期一诊模拟考试理综试题
2024届四川省泸县第五中学高三上学期一诊模拟考试理综试题广西壮族自治区2023届高三下学期第三次联合调研考试理综化学试题(已下线)化学-2023年高考押题预测卷03(山东卷)(含考试版、全解全析、参考答案、答题卡)(已下线)山东省枣庄市2022-2023学年高三下学期二模考试化学试题变式题(原理综合题)
名校
3 . 汽车尾气(主要成分为NOx和CO)已成为主要的空气污染物来源之一,有发生光化学烟雾污染的潜在危险。
(1)某小组同学为研究光化学烟雾的形成进行了模拟实验。测得烟雾的主要成分为CxHy(烃)、NO、NO2、O3、PAN (CH3COOONO2),各种物质的相对浓度随时间的变化如右图。根据图中数据,下列推论最不合理的是_____ 。(填选项序号字母)

a.NO的消失的速率比CxHy快 b.NO生成NO2
c.CxHy及NO2可以生成PAN及O3 d.O3生成PAN
(2)一定条件下,将2 mol NO与2 mol O2置于恒容密闭容器中发生反应2NO(g)+O2(g) 2NO2(g),下列可判断反应达平衡的是
2NO2(g),下列可判断反应达平衡的是_____ 。(填选项序号字母)
a.体系压强保持不变 b.混合气体密度保持不变
c.NO和O2的物质的量之比保持不变 d.每消耗2 mol NO同时生成2 mol NO2
(3)高温下N2和O2发生N2(g)+O2(g) 2NO(g)反应,是导致汽车尾气中含有NO的原因之一。
2NO(g)反应,是导致汽车尾气中含有NO的原因之一。
①右图是T1、T2两种不同温度下,一定量的NO发生分解过程中N2的体积分数随时间变化的图象,据此判断反应N2(g)+O2(g) 2NO(g)为
2NO(g)为_____ (填“吸热”或“放热”)反应。

②2000℃时,向容积为2 L的密闭容器中充入10 mol N2与5 mol O2,达到平衡后NO的物质的量为2 mol,则此刻反应的平衡常数K=_____ 。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为_____ 。

③汽车净化装置里装有含Pd化合物的催化剂,气体在催化剂表面吸附与解吸作用的机理如右图所示。写出其变化的总化学反应方程式:_____ 。
(4)为减少汽车尾气中NOx的排放,常采用CxHy(烃)催化还原NOx消除氮氧化物的污染。
例如:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2
若16 g CH4还原NO2至N2,共放出热量867 kJ,则ΔH2=_____ 。若用标准状况下4.48 L CH4还原NO2至N2,共转移的电子总数为_____ (阿伏伽德罗常数的值用NA表示)。
(1)某小组同学为研究光化学烟雾的形成进行了模拟实验。测得烟雾的主要成分为CxHy(烃)、NO、NO2、O3、PAN (CH3COOONO2),各种物质的相对浓度随时间的变化如右图。根据图中数据,下列推论最不合理的是

a.NO的消失的速率比CxHy快 b.NO生成NO2
c.CxHy及NO2可以生成PAN及O3 d.O3生成PAN
(2)一定条件下,将2 mol NO与2 mol O2置于恒容密闭容器中发生反应2NO(g)+O2(g)
 2NO2(g),下列可判断反应达平衡的是
2NO2(g),下列可判断反应达平衡的是a.体系压强保持不变 b.混合气体密度保持不变
c.NO和O2的物质的量之比保持不变 d.每消耗2 mol NO同时生成2 mol NO2
(3)高温下N2和O2发生N2(g)+O2(g)
 2NO(g)反应,是导致汽车尾气中含有NO的原因之一。
2NO(g)反应,是导致汽车尾气中含有NO的原因之一。①右图是T1、T2两种不同温度下,一定量的NO发生分解过程中N2的体积分数随时间变化的图象,据此判断反应N2(g)+O2(g)
 2NO(g)为
2NO(g)为
②2000℃时,向容积为2 L的密闭容器中充入10 mol N2与5 mol O2,达到平衡后NO的物质的量为2 mol,则此刻反应的平衡常数K=

③汽车净化装置里装有含Pd化合物的催化剂,气体在催化剂表面吸附与解吸作用的机理如右图所示。写出其变化的总化学反应方程式:
(4)为减少汽车尾气中NOx的排放,常采用CxHy(烃)催化还原NOx消除氮氧化物的污染。
例如:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2
若16 g CH4还原NO2至N2,共放出热量867 kJ,则ΔH2=
您最近一年使用:0次
2018-01-25更新
|
1001次组卷
|
3卷引用:四川省资阳市高中2018届高三第二次诊断性考试理科综合化学试题
四川省资阳市高中2018届高三第二次诊断性考试理科综合化学试题【全国百强校】四川省棠湖中学2019届高三二诊模拟理综-化学试题(已下线)练习2 盖斯定律与化学反应热的计算-2020-2021学年【补习教材·寒假作业】高二化学(人教版2019)



