1 . 硫代硫酸钠(Na2SO3)可用作定影剂、还原剂。现有某种硫代硫酸钠样品,为了测定该样品纯度,设计如下实验:
(1)溶液配制:称取10.00 g该硫代硫酸钠样品,用新煮沸并冷却的蒸馏水在烧杯中溶解,完全溶解后,冷却至室温,再用___________ 引流,将溶液全部转移至100 mL的容量瓶中,加蒸馏水至离容量瓶刻度线1~2 cm处,改用___________ 定容,定容时,视线与___________ 相切。
(2)滴定:取0.10 mol/L的硫酸酸化的K2Cr2O7标准溶液20. 00 mL,加入过量KI,发生反应: +6I— +14H+=3I2+2Cr3++7H2O,然后加入淀粉溶液作为指示剂,用硫代硫酸钠样品溶液滴定至终点,发生反应:I2+2
+6I— +14H+=3I2+2Cr3++7H2O,然后加入淀粉溶液作为指示剂,用硫代硫酸钠样品溶液滴定至终点,发生反应:I2+2 =
=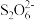 +2I—。
+2I—。
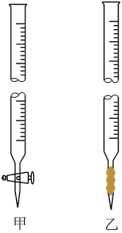
①取用硫酸酸化的K2Cr2O7标准溶液可选用的仪器是___________ (填“甲”或“ 乙”)。
②滴定终点时溶液的颜色变化是___________ 。
③下列操作可能使测量结果偏高的是___________ (填字母)。
A.盛装硫代硫酸钠样品溶液的滴定管没有润洗
B.锥形瓶中残留少量水
C.读数时,滴定前仰视,滴定后俯视
D.盛装硫代硫酸钠样品溶液的滴定管滴定前尖嘴处有气泡,滴定后气泡消失
④平行滴定3次,样品溶液的平均用量为20.00 mL,则样品纯度为___________ %。
(1)溶液配制:称取10.00 g该硫代硫酸钠样品,用新煮沸并冷却的蒸馏水在烧杯中溶解,完全溶解后,冷却至室温,再用
(2)滴定:取0.10 mol/L的硫酸酸化的K2Cr2O7标准溶液20. 00 mL,加入过量KI,发生反应:
 +6I— +14H+=3I2+2Cr3++7H2O,然后加入淀粉溶液作为指示剂,用硫代硫酸钠样品溶液滴定至终点,发生反应:I2+2
+6I— +14H+=3I2+2Cr3++7H2O,然后加入淀粉溶液作为指示剂,用硫代硫酸钠样品溶液滴定至终点,发生反应:I2+2 =
=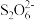 +2I—。
+2I—。
①取用硫酸酸化的K2Cr2O7标准溶液可选用的仪器是
②滴定终点时溶液的颜色变化是
③下列操作可能使测量结果偏高的是
A.盛装硫代硫酸钠样品溶液的滴定管没有润洗
B.锥形瓶中残留少量水
C.读数时,滴定前仰视,滴定后俯视
D.盛装硫代硫酸钠样品溶液的滴定管滴定前尖嘴处有气泡,滴定后气泡消失
④平行滴定3次,样品溶液的平均用量为20.00 mL,则样品纯度为
您最近一年使用:0次
2024-03-18更新
|
44次组卷
|
2卷引用:青海省海南州贵德高级中学2022-2023学年高二下学期期末考试化学试卷
名校
解题方法
2 . 用标准的盐酸滴定未知浓度的NaOH溶液,下列操作不会引起实验误差的是
| A.用蒸馏水洗净酸式滴定管后,装入标准盐酸进行滴定 |
| B.用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,后装入NaOH溶液进行滴定 |
| C.用蒸馏水洗净锥形瓶后,加入10.00mLNaOH溶液,再加入适量蒸馏水进行滴定 |
| D.用酚酞作指示剂滴至红色刚变无色时即停止加盐酸 |
您最近一年使用:0次
2024-01-03更新
|
128次组卷
|
52卷引用:青海省西宁市普通高中五校2020-2021学年高二上学期期末联考化学试题
青海省西宁市普通高中五校2020-2021学年高二上学期期末联考化学试题(已下线)2011-2012学年云南省昆明三中高二下学期期末考试化学试卷(已下线)2014~2015学年黑龙江省哈六中高二上学期期中化学试卷2015-2016学年甘肃省永昌一中高二上学期期末化学试卷2015-2016学年黑龙江大庆一中高二下假期验收化学试卷2015-2016学年内蒙古杭锦后旗奋斗中学高二下期中化学卷2015-2016学年新疆农业大学附中高二下学期期中化学试卷2016-2017学年西藏拉萨北京实验中学高二上期末化学卷河北省深州中学2016-2017学年高二下学期期末考试化学试题黑龙江省大庆中学2017-2018学年高二上学期期末考试化学试题山东省滨州市2017-2018学年高二年级上学期期末考试化学试题北京师范大学附属中学2017-2018学年高二上学期期末考试化学试题山东省菏泽市第一中学老校区2018-2019学年高二上学期期末模拟化学试题福建省晋江市季延中学2018-2019学年高二上学期期末考试化学试题【校级联考】河南省商丘市九校2018-2019学年高二上学期期末联考化学试题【全国百强校】甘肃省静宁县第一中学2018-2019学年高二(普通班)上学期期末考试化学试题【全国百强校】甘肃省静宁县第一中学2018-2019学年高二(实验班)上学期期末考试化学试题【全国百强校】贵州省遵义航天高级中学2018-2019学年高二下学期第一次(3月)月考化学试题云南省玉溪市景东一中2018-2019学年高二6月份考试化学试题(已下线)2019年10月12日 《每日一题》选修4-周末培优河北省鸡泽县第一中学2019-2020学年高二10月月考化学试题吉林省汪清县第六中学2019-2020学年高二上学期期中考试化学试题湖南省长沙市长郡中学2019-2020学年高二上学期期中考试化学试题甘肃省白银市会宁县第四中学2019-2020学年高二上学期期末期末考试化学试题湖南省张家界市2019-2020学年高二上学期期末考试化学试题黑龙江省牡丹江市第三高级中学2019-2020学年高二上学期期末考试化学试题甘肃省甘南藏族自治州合作第一中学2019-2020学年高二上学期期末考试化学试题湖南省衡阳市欧阳遇实验中学2018-2019学年高二下学期期末考试化学试题北京市中央民族大学附属中学2019-2020学年高二下学期期末考试化学试题湖北省黄冈市黄梅国际育才高级中学2019-2020学年高二上学期9月月考化学试题鲁科版(2019)选择性必修1 模块综合测评人教版(2019)高二选择性必修第一册 模块综合测评安徽涡阳县育萃中学2020-2021学年高二上学期第二次月考化学试题(已下线)3.2.2 酸碱中和滴定(练习)-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)河南省焦作市博爱县英才学校2020-2021学年高二上学期11月月考化学试题内蒙古包头市第一中学2020-2021学年高二上学期期中考试化学试题河南省名校联盟2020-2021学年高二下学期开学考试化学试题(已下线)课时41 酸碱中和滴定及拓展应用-2022年高考化学一轮复习小题多维练(全国通用)云南省玉溪市峨山一中2021—2022学年高二下学期3月月考化学试题(已下线)第31练 水的电离和溶液的pH-2023年高考化学一轮复习小题多维练(全国通用)湖南省长沙市长郡梅溪湖中学2021-2022学年高二下学期入学考试化学试题山东省滨州市沾化区实验高级中学2022-2023学年高三上学期开学考试化学试题江苏省徐州市沛县树恩高级中学2021-2022学年高二下学期期中测试化学试题河南新密市实验高级中学2022-2023学年高二上学期第七次段考化学试题 中国人民大学附属中学2022-2023学年高二上学期限时练习 2(12月考题)化学试题第3课时 酸碱中和滴定西省西安市铁一中学2023-2024学年高二上学期期中质量检测化学试题广东省湛江市第二十一中学2023-2024学年高二上学期期中考试化学试题湖北省恩施土家族苗族自治州高级中学2023-2024学年高二上学期期中考试化学试题天津市耀华中学2023-2024学年高二上学期11月期中化学试题山东省淄博市沂源县第一中学2023-2024学年高二上学期期中考试化学试题河北省石家庄市辛集市2023-2024学年高二上学期2月期末考试化学试题
名校
3 . 某学生用 的标准
的标准 溶液滴定未知浓度的盐酸,其操作为如下几步:
溶液滴定未知浓度的盐酸,其操作为如下几步:
①用蒸馏水洗涤碱式滴定管,并立即注入 溶液至“0”刻度线以上
溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④移取 待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数。
请回答:
(1)如图中甲为_______ 滴定管,乙为_______ 滴定管(填“酸式”或“碱式”)
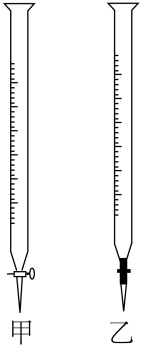
(2)以上步骤有错误的是_______ (填编号),该错误操作会导致测定结果_______ (填“偏大”、“偏小”或“无影响”);
(3)判断滴定终点的现象是:_______ 。
(4)如图是某次滴定时的滴定管中的液面,其读数为_______  。
。

(5)根据下列数据:请计算待测盐酸溶液的浓度:_______  。
。
 的标准
的标准 溶液滴定未知浓度的盐酸,其操作为如下几步:
溶液滴定未知浓度的盐酸,其操作为如下几步:①用蒸馏水洗涤碱式滴定管,并立即注入
 溶液至“0”刻度线以上
溶液至“0”刻度线以上②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④移取
 待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液⑤用标准液滴定至终点,记下滴定管液面读数。
请回答:
(1)如图中甲为

(2)以上步骤有错误的是
(3)判断滴定终点的现象是:
(4)如图是某次滴定时的滴定管中的液面,其读数为
 。
。
(5)根据下列数据:请计算待测盐酸溶液的浓度:
 。
。| 滴定次数 | 待测体积 | 标准烧碱体积 | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 21.40 |
| 第二次 | 20.00 | 1.00 | 24.10 |
| 第三次 | 20.00 | 4.00 | 25.00 |
您最近一年使用:0次
名校
解题方法
4 . 实验室用标准KMnO4溶液滴定未知浓度的FeSO4溶液,下列说法或操作正确的是
| A.滴定前锥形瓶用FeSO4溶液润洗2~3次 |
| B.将标准KMnO4溶液置于碱式滴定管中备用 |
| C.滴定前俯视读数、滴定后仰视读数会导致滴定结果偏高 |
| D.当锥形瓶内溶液颜色由浅绿色变为紫红色时,立即记下滴定管液面所在刻度 |
您最近一年使用:0次
2023-01-15更新
|
161次组卷
|
4卷引用:青海省西宁市大通县2023-2024学年高二上学期期末考试化学试题
5 . 某学生用已知物质的量浓度的 标难溶液来测定未知物质的量浓度的盐酸时,选择酚酞作指示剂。请回答下列问题:
标难溶液来测定未知物质的量浓度的盐酸时,选择酚酞作指示剂。请回答下列问题:
(1)配制 标准溶液。配制所需的玻璃仪器有:烧杯、量筒,玻璃棒、
标准溶液。配制所需的玻璃仪器有:烧杯、量筒,玻璃棒、___________ 、___________ 。
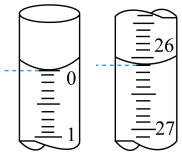
(2)若滴定开始和结束时,碱式滴定管中的液面如图所示,所用NaOH标准溶液的体积为___________  。
。
(3)滴定过程中边滴加边摇动锥形瓶,直到加入半滴 溶液后,
溶液后,___________ ,表明已经到达滴定终点。
(4)某学生根据3次实验分别记录有关数据如表所示:
依据表中数据计算该盐酸的物质的量浓度为___________  。
。
(5)在上述实验中,下列操作会造成测定结果偏低的有___________ (填字母)。
a、滴定结束后盛装标准液的滴定管有气泡
b、锥形瓶水洗后未干燥
c、碱式滴定管水洗后未用标准溶液润洗
d、滴定终点时俯视读数
(6)有一支 的酸式滴定管,其中盛有溶液,液面恰好在
的酸式滴定管,其中盛有溶液,液面恰好在 刻度处,现把管内液体全部放出,得到液体的体积是
刻度处,现把管内液体全部放出,得到液体的体积是___________ (填字母)。
a、不能确定 b、 c、
c、 d、大于
d、大于
 标难溶液来测定未知物质的量浓度的盐酸时,选择酚酞作指示剂。请回答下列问题:
标难溶液来测定未知物质的量浓度的盐酸时,选择酚酞作指示剂。请回答下列问题:(1)配制
 标准溶液。配制所需的玻璃仪器有:烧杯、量筒,玻璃棒、
标准溶液。配制所需的玻璃仪器有:烧杯、量筒,玻璃棒、(2)若滴定开始和结束时,碱式滴定管中的液面如图所示,所用NaOH标准溶液的体积为
 。
。
(3)滴定过程中边滴加边摇动锥形瓶,直到加入半滴
 溶液后,
溶液后,(4)某学生根据3次实验分别记录有关数据如表所示:
| 滴定次数 | 待测盐酸的体积 | 标准 溶液体积 溶液体积 | |
| 滴定前的刻度/mL | 滴定后的刻度 | ||
| 第一次 | 25.00 | 0.00 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 |
| 第三次 | 25.00 | 0.22 | 26.31 |
 。
。(5)在上述实验中,下列操作会造成测定结果偏低的有
a、滴定结束后盛装标准液的滴定管有气泡
b、锥形瓶水洗后未干燥
c、碱式滴定管水洗后未用标准溶液润洗
d、滴定终点时俯视读数
(6)有一支
 的酸式滴定管,其中盛有溶液,液面恰好在
的酸式滴定管,其中盛有溶液,液面恰好在 刻度处,现把管内液体全部放出,得到液体的体积是
刻度处,现把管内液体全部放出,得到液体的体积是a、不能确定 b、
 c、
c、 d、大于
d、大于
您最近一年使用:0次
2022-12-11更新
|
124次组卷
|
2卷引用:青海省西宁市海湖中学2022-2023学年高二上学期期末考试化学试题
名校
解题方法
6 . 滴定分析法是一种精度很高的定量分析法。以酚酞为指示剂,用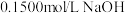 标准溶液滴定某未知浓度的盐酸溶液,下列说法错误的是
标准溶液滴定某未知浓度的盐酸溶液,下列说法错误的是
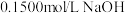 标准溶液滴定某未知浓度的盐酸溶液,下列说法错误的是
标准溶液滴定某未知浓度的盐酸溶液,下列说法错误的是| A.用酸式滴定管盛装待测液 |
| B.装液之前需润洗碱式滴定管 |
| C.指示剂多加不影响测定结果 |
| D.滴定终点时,溶液颜色由无色变为粉红色 |
您最近一年使用:0次
2022-01-14更新
|
1033次组卷
|
4卷引用:青海省西宁市城西区青海师范大学附属实验中学2022-2023学年高二上学期12月月考化学试题
名校
7 . 高锰酸钾是一种常见的氧化剂,工业上碱熔法利用软锰矿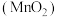 制备高锰酸钾的流程如下。某化学活动小组在实验室中模拟该流程制备高锰酸钾,并对产物中
制备高锰酸钾的流程如下。某化学活动小组在实验室中模拟该流程制备高锰酸钾,并对产物中 的质量分数进行测定。
的质量分数进行测定。
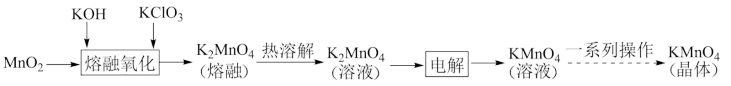
(1)“熔融氧化”步骤在坩埚中进行,则选用坩埚的材料为___________(填序号)。
(2)工业上电解制取 溶液时,生成的
溶液时,生成的___________ (填化学式)经回收可以返名回“熔融氧化”步骤循环利用。
(3)由 溶液获得
溶液获得 晶体的一系列操作为
晶体的一系列操作为___________ 、___________ 、过滤、洗涤、干燥。
(4)按下述步骤测定产物中 的质量分数:
的质量分数:
a.用分析天平准确称取 样品1.0000g,配制成250mL溶液;
样品1.0000g,配制成250mL溶液;
b.用分析天平准确称取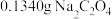 ,加入500mL的锥形瓶中,用100mL蒸馏水溶解,再加入
,加入500mL的锥形瓶中,用100mL蒸馏水溶解,再加入 硫酸10mL,加热到70~80℃;
硫酸10mL,加热到70~80℃;
c.趁热用高锰酸钾溶液进行滴定;
d.重复步骤b、c三次测定数据如下表,并进行数据处理。
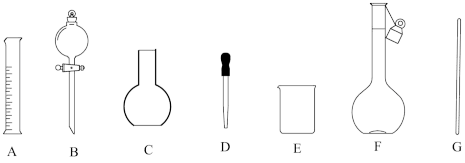
①配制 样品溶液时,下列玻璃仪器中不需要的有
样品溶液时,下列玻璃仪器中不需要的有___________ (填序号)。
②步骤b适宜选用的加热方式为___________ ,需趁热滴定是因为反应在常温下进行较慢,一般要求滴定结束时不低于60℃,但也不能温度过高,防止 部分分解导致测定结果
部分分解导致测定结果___________ (填“偏高”或“偏低”)。
③滴定终点现象为___________ ;产物中 的质量分数为
的质量分数为___________ 。
 制备高锰酸钾的流程如下。某化学活动小组在实验室中模拟该流程制备高锰酸钾,并对产物中
制备高锰酸钾的流程如下。某化学活动小组在实验室中模拟该流程制备高锰酸钾,并对产物中 的质量分数进行测定。
的质量分数进行测定。
(1)“熔融氧化”步骤在坩埚中进行,则选用坩埚的材料为___________(填序号)。
| A.陶瓷 | B.石英 | C.铁 | D.刚玉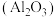 |
 溶液时,生成的
溶液时,生成的(3)由
 溶液获得
溶液获得 晶体的一系列操作为
晶体的一系列操作为(4)按下述步骤测定产物中
 的质量分数:
的质量分数:a.用分析天平准确称取
 样品1.0000g,配制成250mL溶液;
样品1.0000g,配制成250mL溶液;b.用分析天平准确称取
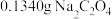 ,加入500mL的锥形瓶中,用100mL蒸馏水溶解,再加入
,加入500mL的锥形瓶中,用100mL蒸馏水溶解,再加入 硫酸10mL,加热到70~80℃;
硫酸10mL,加热到70~80℃;c.趁热用高锰酸钾溶液进行滴定;
d.重复步骤b、c三次测定数据如下表,并进行数据处理。
| 实验序号 | 1 | 2 | 3 |
消耗 样品溶液体积/mL 样品溶液体积/mL | 25.10 | 24.80 | 25.10 |
①配制
 样品溶液时,下列玻璃仪器中不需要的有
样品溶液时,下列玻璃仪器中不需要的有
②步骤b适宜选用的加热方式为
 部分分解导致测定结果
部分分解导致测定结果③滴定终点现象为
 的质量分数为
的质量分数为
您最近一年使用:0次
2022-01-09更新
|
127次组卷
|
2卷引用:青海省西宁市城西区青海师范大学附属实验中学2022-2023学年高二上学期12月月考化学试题
8 . EDTA二钠盐(用 表示)易溶于乙醇,微溶于冷水,广泛应用于滴定实验。
表示)易溶于乙醇,微溶于冷水,广泛应用于滴定实验。
EDTA的结构简式为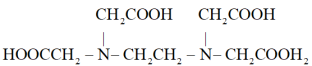 。
。
实验(一):制备 。
。
步骤1:称取一氯乙酸于三口瓶中,慢慢加入50%碳酸钠溶液,直至不再产生二氧化碳气泡为止。
步骤2:如图1所示,在50℃条件下保温2小时。
步骤3:将步骤2所得混合物倒入烧杯中,用浓盐酸调节pH至1.2,析出大量白色沉淀。
步骤4:从步骤3所得混合物中分离 ,如图2所示。
,如图2所示。

已知: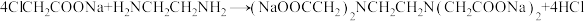 。
。
(1)图1中三口瓶采用___________ (填“酒精灯”或“热水浴”)加热。
(2)图1中仪器A的名称是___________ , 的作用是
的作用是___________ 。
(3)仪器B的作用是___________ ,进水口是___________ (填“a”或“b”)。
(4)用图2装置分离 的优点是
的优点是___________ 。
(5)分离出来的 用
用___________ (填“冷水”、“热水”或“酒精”)洗涤。
实验(二):用 溶液测定饮用水的总硬度
溶液测定饮用水的总硬度
饮用水的总硬度用 、
、 的总浓度表示。取VmL某饮用水于锥形瓶中,滴加EBT指示剂,用cmol/L的
的总浓度表示。取VmL某饮用水于锥形瓶中,滴加EBT指示剂,用cmol/L的 溶液滴定,三次平行实验测定数据如下:
溶液滴定,三次平行实验测定数据如下:
滴定反应: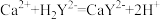 ,
,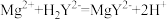 。
。
(6)该饮用水的总硬度为___________ mol/L。
(7)下列操作可能使测得的结果偏高的是___________(填标号)。
 表示)易溶于乙醇,微溶于冷水,广泛应用于滴定实验。
表示)易溶于乙醇,微溶于冷水,广泛应用于滴定实验。EDTA的结构简式为
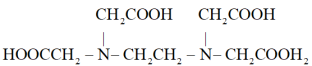 。
。实验(一):制备
 。
。步骤1:称取一氯乙酸于三口瓶中,慢慢加入50%碳酸钠溶液,直至不再产生二氧化碳气泡为止。
步骤2:如图1所示,在50℃条件下保温2小时。
步骤3:将步骤2所得混合物倒入烧杯中,用浓盐酸调节pH至1.2,析出大量白色沉淀。
步骤4:从步骤3所得混合物中分离
 ,如图2所示。
,如图2所示。
已知:
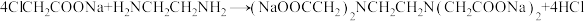 。
。(1)图1中三口瓶采用
(2)图1中仪器A的名称是
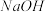 的作用是
的作用是(3)仪器B的作用是
(4)用图2装置分离
 的优点是
的优点是(5)分离出来的
 用
用实验(二):用
 溶液测定饮用水的总硬度
溶液测定饮用水的总硬度饮用水的总硬度用
 、
、 的总浓度表示。取VmL某饮用水于锥形瓶中,滴加EBT指示剂,用cmol/L的
的总浓度表示。取VmL某饮用水于锥形瓶中,滴加EBT指示剂,用cmol/L的 溶液滴定,三次平行实验测定数据如下:
溶液滴定,三次平行实验测定数据如下:| 实验 | 起始读数/mL | 终点读数/mL |
| Ⅰ | 0.25 | 26.54 |
| Ⅱ | 1.20 | 26.10 |
| Ⅲ | 0.40 | 25.50 |
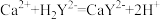 ,
,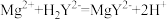 。
。(6)该饮用水的总硬度为
(7)下列操作可能使测得的结果偏高的是___________(填标号)。
A.盛装 溶液的滴定管没有润洗 溶液的滴定管没有润洗 | B.锥形瓶残留有蒸馏水 |
| C.开始时仰视读数,终点时俯视读数 | D.开始时滴定管充满溶液,终点时滴定管下端有气泡 |
您最近一年使用:0次
2021-12-21更新
|
271次组卷
|
5卷引用:青海省西宁市三县2021-2022学年高三上学期期末联考化学试题
名校
解题方法
9 . 某学生用0.2000 mol∙L−1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,注入0.2000 mol∙L−1的标准NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
⑥重复以上滴定操作2~3次。
请回答:
(1)以上步骤有错误的是(填编号)_______ ,该错误操作会导致测定结果_______ (填“偏大”、“偏小”或“无影响”)。
(2)步骤④中,量取20.00mL待测液应使用_______ (填仪器名称),在锥形瓶装液前,留有少量蒸馏水,测定结果_______ (填“大”、“偏小”或“无影响”)。
(3)步骤⑤滴定时眼睛应注视_______ ;判断到达滴定终点的依据是:_______ 。
(4)以下是实验数据记录表
根据上表记录数据,通过计算可得,该盐酸浓度为:_______ mol∙L−1
①用蒸馏水洗涤碱式滴定管,注入0.2000 mol∙L−1的标准NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
⑥重复以上滴定操作2~3次。
请回答:
(1)以上步骤有错误的是(填编号)
(2)步骤④中,量取20.00mL待测液应使用
(3)步骤⑤滴定时眼睛应注视
(4)以下是实验数据记录表
滴定次数 | 盐酸体积(mL) | NaOH溶液体积读数(mL) | |
滴定前 | 滴定后 | ||
1 | 20.00 | 0.00 | 18.10 |
2 | 20.00 | 0.00 | 16.30 |
3 | 20.00 | 0.00 | 16.22 |
您最近一年使用:0次
2021-03-03更新
|
139次组卷
|
2卷引用:青海省海南州贵德高级中学2020-2021学年高二下学期期中化学试题
解题方法
10 . 实验室中有一未知浓度的稀盐酸,某学生在实验室中进行测定盐酸的浓度的实验。请完成下列填空:
I、配制100mL0.10mol·L-1NaOH标准溶液。
II、取20.00mL待测盐酸放入锥形瓶中,并滴加2~3滴作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
(1)选择的指示剂是________ 溶液,滴定达到终点的标志是___________ 。
(2)根据上述数据,可计算出该盐酸的浓度约为_______ mol·L-1(保留两位有效数字)。
(3)排碱式滴定管中气泡应采用如图所示操作中的________ ,然后轻轻挤压玻璃球使尖嘴部分充满碱液。

(4)在上述实验中,下列操作会造成测定结果偏高的有______ (填字母序号)。
A.滴定终点读数时俯视
B.酸式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥
D.碱式滴定管尖嘴部分有气泡,滴定后消失
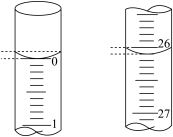
(5)若滴定开始和结束时,碱式滴定管中的液面如图所示:则起始读数为_____ mL,终点读数_____ mL;
I、配制100mL0.10mol·L-1NaOH标准溶液。
II、取20.00mL待测盐酸放入锥形瓶中,并滴加2~3滴作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
| 实验编号 | c(NaOH)mol·L-1 | NaOH溶液滴入的体积(mL) | 待测盐酸的体积(mL) |
| 1 | 0.10 | 23.90 | 20.00 |
| 2 | 0.10 | 24.00 | 20.00 |
| 3 | 0.10 | 24.10 | 20.00 |
(2)根据上述数据,可计算出该盐酸的浓度约为
(3)排碱式滴定管中气泡应采用如图所示操作中的

(4)在上述实验中,下列操作会造成测定结果偏高的有
A.滴定终点读数时俯视
B.酸式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥
D.碱式滴定管尖嘴部分有气泡,滴定后消失
(5)若滴定开始和结束时,碱式滴定管中的液面如图所示:则起始读数为

您最近一年使用:0次
2020-10-19更新
|
181次组卷
|
2卷引用:青海省西宁市湟源县第一中学2020-2021学年高二上学期期中考试化学试题



