1 . 侯氏制碱法为国民经济发展做出了重要贡献。某化学兴趣小组在实验室中模拟并改进侯氏制碱法制备少量 ,得到副产品
,得到副产品 和
和 ,流程如下图:
,流程如下图:
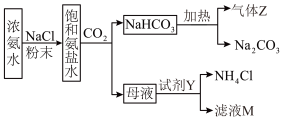
按要求回答下列问题。
(1)写出上图制备 总反应的化学方程式:
总反应的化学方程式:___________ 。
(2)制取 时为使下图A装置中分液漏斗内的稀盐酸顺利滴下,可将玻璃塞上的凹槽对准漏斗颈部的小孔或者
时为使下图A装置中分液漏斗内的稀盐酸顺利滴下,可将玻璃塞上的凹槽对准漏斗颈部的小孔或者___________ 。
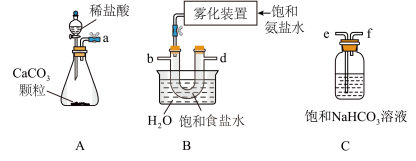
(3)制备 时,需将A装置产生的气体,与B、C装置导管进行连接,其接口顺序是a
时,需将A装置产生的气体,与B、C装置导管进行连接,其接口顺序是a___________ (按气流方向,用小写字母表示)。“雾化装置”的优点是___________ 。
(4)反应完成后,将装置B中混合物处理得到固体 和母液。
和母液。
①将固体 加热充分,并将产生的气体先通过足量的试剂X吸收水分,再通过足量
加热充分,并将产生的气体先通过足量的试剂X吸收水分,再通过足量 ,
, 增重0.14g。试剂X为
增重0.14g。试剂X为___________ ,产品 的质量为
的质量为___________ g。
②已知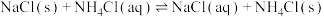 ;NaCl和
;NaCl和 溶解度曲线(如图)。
溶解度曲线(如图)。
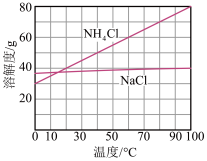
i.为使 沉淀从母液中充分析出,需向母液中加入的试剂Y为
沉淀从母液中充分析出,需向母液中加入的试剂Y为___________ ;
ii.得到副产品 所需的操作有
所需的操作有___________ 、___________ 、过滤、洗涤、干燥。
(5)题干实验流程中可以回收再利用的物质有___________ 。
(6)称量吸收了一定量水分的 粉末,配制成
粉末,配制成 标准溶液,用于滴定未知浓度盐酸的浓度。预测该标准液对滴定结果造成的影响是
标准溶液,用于滴定未知浓度盐酸的浓度。预测该标准液对滴定结果造成的影响是___________ (填“偏高”“偏低”“无影响”)。
 ,得到副产品
,得到副产品 和
和 ,流程如下图:
,流程如下图:
按要求回答下列问题。
(1)写出上图制备
 总反应的化学方程式:
总反应的化学方程式:(2)制取
 时为使下图A装置中分液漏斗内的稀盐酸顺利滴下,可将玻璃塞上的凹槽对准漏斗颈部的小孔或者
时为使下图A装置中分液漏斗内的稀盐酸顺利滴下,可将玻璃塞上的凹槽对准漏斗颈部的小孔或者
(3)制备
 时,需将A装置产生的气体,与B、C装置导管进行连接,其接口顺序是a
时,需将A装置产生的气体,与B、C装置导管进行连接,其接口顺序是a(4)反应完成后,将装置B中混合物处理得到固体
 和母液。
和母液。①将固体
 加热充分,并将产生的气体先通过足量的试剂X吸收水分,再通过足量
加热充分,并将产生的气体先通过足量的试剂X吸收水分,再通过足量 ,
, 增重0.14g。试剂X为
增重0.14g。试剂X为 的质量为
的质量为②已知
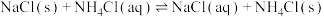 ;NaCl和
;NaCl和 溶解度曲线(如图)。
溶解度曲线(如图)。
i.为使
 沉淀从母液中充分析出,需向母液中加入的试剂Y为
沉淀从母液中充分析出,需向母液中加入的试剂Y为ii.得到副产品
 所需的操作有
所需的操作有(5)题干实验流程中可以回收再利用的物质有
(6)称量吸收了一定量水分的
 粉末,配制成
粉末,配制成 标准溶液,用于滴定未知浓度盐酸的浓度。预测该标准液对滴定结果造成的影响是
标准溶液,用于滴定未知浓度盐酸的浓度。预测该标准液对滴定结果造成的影响是
您最近一年使用:0次
解题方法
2 . 用标准的盐酸滴定未知浓度的NaOH溶液,下列各操作中,不会引起实验误差的是
| A.用蒸馏水洗净酸式滴定管后,装入标准盐酸进行滴定 |
| B.用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗后装入一定体积的NaOH溶液 |
| C.取10.00 mL NaOH溶液放入洗净的锥形瓶中,再加入适量蒸馏水 |
| D.取10.00 mL的NaOH溶液,放入锥形瓶后,把碱式滴定管尖嘴液滴吹去 |
您最近一年使用:0次
名校
解题方法
3 . 氮化锶( )是工业上生产荧光粉的原材料。已知:锶与氮气在加热条件下可生成氮化锶,氮化锶遇水剧烈反应产生氨气。
)是工业上生产荧光粉的原材料。已知:锶与氮气在加热条件下可生成氮化锶,氮化锶遇水剧烈反应产生氨气。
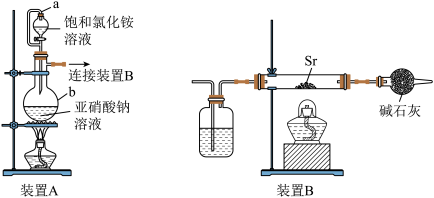
I.利用装置A和B制备
(1) 在元素周期表中的位置是
在元素周期表中的位置是____________________ 。
(2)装置A中仪器b的名称为_____________________ ,a导管的作用是_____________________ ﹔装置B中广口瓶盛放的试剂是_____________________ (填名称)。
(3)装置A制备 的化学方程式为
的化学方程式为_______________________________________ 。
(4)实验时先点燃装置__________ 处酒精灯(填“A”或“B”),一段时间后,点燃另一只酒精灯。
II.测定 产品的纯度
产品的纯度
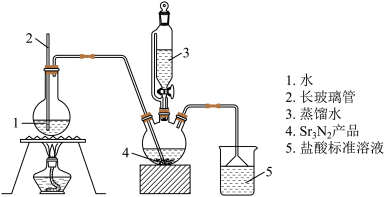
称取 产品,放入干燥的三颈瓶中,然后加入蒸馏水,通入水蒸气,将产生的氨全部蒸出,用
产品,放入干燥的三颈瓶中,然后加入蒸馏水,通入水蒸气,将产生的氨全部蒸出,用 的盐酸标准溶液完全吸收(吸收液体体积变化忽略不计)从烧杯中量取
的盐酸标准溶液完全吸收(吸收液体体积变化忽略不计)从烧杯中量取 的吸收液放入锥形瓶中,用
的吸收液放入锥形瓶中,用 标准溶液滴定过剩的
标准溶液滴定过剩的 ,到终点时消耗
,到终点时消耗 溶液(图中夹持装置略)
溶液(图中夹持装置略)
(5)三颈烧瓶中发生反应产生氨气的化学方程式为________________________ 。
(6)产品纯度为____________ (精确到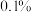 )。
)。
(7)下列实验操作可能使氮化锶( )测定结果偏低的_________________(填标号)。
)测定结果偏低的_________________(填标号)。
 )是工业上生产荧光粉的原材料。已知:锶与氮气在加热条件下可生成氮化锶,氮化锶遇水剧烈反应产生氨气。
)是工业上生产荧光粉的原材料。已知:锶与氮气在加热条件下可生成氮化锶,氮化锶遇水剧烈反应产生氨气。
I.利用装置A和B制备

(1)
 在元素周期表中的位置是
在元素周期表中的位置是(2)装置A中仪器b的名称为
(3)装置A制备
 的化学方程式为
的化学方程式为(4)实验时先点燃装置
II.测定
 产品的纯度
产品的纯度称取
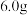 产品,放入干燥的三颈瓶中,然后加入蒸馏水,通入水蒸气,将产生的氨全部蒸出,用
产品,放入干燥的三颈瓶中,然后加入蒸馏水,通入水蒸气,将产生的氨全部蒸出,用 的盐酸标准溶液完全吸收(吸收液体体积变化忽略不计)从烧杯中量取
的盐酸标准溶液完全吸收(吸收液体体积变化忽略不计)从烧杯中量取 的吸收液放入锥形瓶中,用
的吸收液放入锥形瓶中,用 标准溶液滴定过剩的
标准溶液滴定过剩的 ,到终点时消耗
,到终点时消耗 溶液(图中夹持装置略)
溶液(图中夹持装置略)
(5)三颈烧瓶中发生反应产生氨气的化学方程式为
(6)产品纯度为
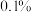 )。
)。(7)下列实验操作可能使氮化锶(
 )测定结果偏低的_________________(填标号)。
)测定结果偏低的_________________(填标号)。| A.锥形瓶洗涤干净后未干燥,直接装入待测液 |
B.滴定时未用 标准溶液润洗滴定管 标准溶液润洗滴定管 |
| C.滴定前滴定管尖嘴处有气泡,滴定结束后气泡消失 |
| D.读数时,滴定前平视,滴定后俯视 |
您最近一年使用:0次
2022-05-28更新
|
393次组卷
|
2卷引用:天津市新华中学2022届高三下学期高考校一模(统练8)化学试题
名校
解题方法
4 . (NH4)2Cr2O7用于有机合成催化剂,媒染剂,显影液等。某化学兴趣小组对(NH4)2Cr2O7的部分性质及组成进行探究。已知: (橙色)+H2O⇌2
(橙色)+H2O⇌2 (黄色)+2H+,回答下列问题:
(黄色)+2H+,回答下列问题:
(1)在试管中加入少量固体(NH4)2Cr2O7,滴加足量浓KOH溶液,振荡、微热,观察到的主要现象是固体溶解、__ 、__ 。
(2)为探究(NH4)2Cr2O7(摩尔质量252g/mol)的分解产物,按图连接好装置,在A中加入2.52g样品进行实验。
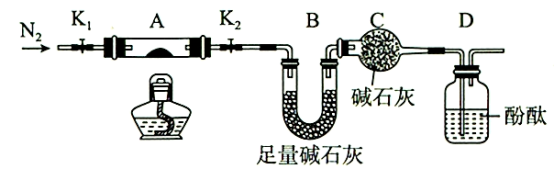
①实验操作步骤:a.打开K1和K2,缓缓通入N2→b,点燃酒精灯,加热→c,熄灭酒精灯→d.→e,关闭K1和K2→f,称量A和B,则d的操作为___ 。
②加热A至恒重,观察到D中溶液不变色,同时测得A、B中质量变化分别为1.00g、0.72g,写出重铬酸铵加热分解反应的化学方程式__ 。
(3)实验室常用甲醛法测定含(NH4)2Cr2O7的样品中氮的质量分数,其反应原理为:2Ba2++ +H2O=2BaCrO4+2H+;4
+H2O=2BaCrO4+2H+;4 +6HCHO=3H++6H2O+(CH2)6N4H+;(CH2)6N4H+⇌(CH2)6N4+H+,K=7×10-6,然后用NaOH标准溶液滴定反应生成的酸。
+6HCHO=3H++6H2O+(CH2)6N4H+;(CH2)6N4H+⇌(CH2)6N4+H+,K=7×10-6,然后用NaOH标准溶液滴定反应生成的酸。
实验步骤:
I.称取样品ag,配成250mL溶液。
II.量取25.00mL样品溶液,用氯化钡溶液使 完全沉淀后,加入10mL20%的中性甲醛溶液,摇匀、静置5min。
完全沉淀后,加入10mL20%的中性甲醛溶液,摇匀、静置5min。
III.以酚酞作指示剂,用cmol·L-1标准NaOH溶液滴定,记录数据。
IV.重复步骤II、III2~3次,处理数据。
①滴定终点的颜色变化_______ 。
②滴定操作使用的玻璃仪器主要有_______ 。
③步骤III发生反应的离子方程式是_______ 。
④若实验平均消耗NaOH溶液的体积为bmL,该样品中氮的质量分数的计算式为。_______ 。(用含a、b、c式子表示,需要化简)
⑤下列情况会导致测定结果偏低的是_______ 。(填序号)
a.若实验中使用的甲醛常混有微量甲酸
b.若步骤II没有静置5min
c.若滴定终点读数时,俯视标准液液面
 (橙色)+H2O⇌2
(橙色)+H2O⇌2 (黄色)+2H+,回答下列问题:
(黄色)+2H+,回答下列问题:(1)在试管中加入少量固体(NH4)2Cr2O7,滴加足量浓KOH溶液,振荡、微热,观察到的主要现象是固体溶解、
(2)为探究(NH4)2Cr2O7(摩尔质量252g/mol)的分解产物,按图连接好装置,在A中加入2.52g样品进行实验。

①实验操作步骤:a.打开K1和K2,缓缓通入N2→b,点燃酒精灯,加热→c,熄灭酒精灯→d.→e,关闭K1和K2→f,称量A和B,则d的操作为
②加热A至恒重,观察到D中溶液不变色,同时测得A、B中质量变化分别为1.00g、0.72g,写出重铬酸铵加热分解反应的化学方程式
(3)实验室常用甲醛法测定含(NH4)2Cr2O7的样品中氮的质量分数,其反应原理为:2Ba2++
 +H2O=2BaCrO4+2H+;4
+H2O=2BaCrO4+2H+;4 +6HCHO=3H++6H2O+(CH2)6N4H+;(CH2)6N4H+⇌(CH2)6N4+H+,K=7×10-6,然后用NaOH标准溶液滴定反应生成的酸。
+6HCHO=3H++6H2O+(CH2)6N4H+;(CH2)6N4H+⇌(CH2)6N4+H+,K=7×10-6,然后用NaOH标准溶液滴定反应生成的酸。实验步骤:
I.称取样品ag,配成250mL溶液。
II.量取25.00mL样品溶液,用氯化钡溶液使
 完全沉淀后,加入10mL20%的中性甲醛溶液,摇匀、静置5min。
完全沉淀后,加入10mL20%的中性甲醛溶液,摇匀、静置5min。III.以酚酞作指示剂,用cmol·L-1标准NaOH溶液滴定,记录数据。
IV.重复步骤II、III2~3次,处理数据。
①滴定终点的颜色变化
②滴定操作使用的玻璃仪器主要有
③步骤III发生反应的离子方程式是
④若实验平均消耗NaOH溶液的体积为bmL,该样品中氮的质量分数的计算式为。
⑤下列情况会导致测定结果偏低的是
a.若实验中使用的甲醛常混有微量甲酸
b.若步骤II没有静置5min
c.若滴定终点读数时,俯视标准液液面
您最近一年使用:0次
2021-05-28更新
|
140次组卷
|
7卷引用:天津市十二区县重点校2021届高三联考(一)化学试题
天津市十二区县重点校2021届高三联考(一)化学试题(已下线)2020年天津卷化学高考真题变式题13-16湖南省娄底市第五中学2021-2022学年高三下学期第三次模拟考试化学试题(已下线)【石家庄新东方】石家庄二中高三四校联考模拟化学(已下线)考点31 物质的制备 定量分析-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点34 物质的制备与合成-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点52 定量分析-备战2023年高考化学一轮复习考点帮(全国通用)
解题方法
5 . 下列有关仪器使用方法或实验操作正确的是
| A.洗净的锥形瓶和容量瓶用前必须干燥处理 |
| B.酸式滴定管装标准溶液前,必须先用该溶液润洗 |
| C.酸碱滴定实验中,用待滴定溶液润洗锥形瓶以减小实验误差 |
| D.配溶液时,若加水超过容量瓶刻度线,立即吸出多余液体 |
您最近一年使用:0次
2021-04-07更新
|
346次组卷
|
4卷引用:天津市和平区2021届高三一模考试化学试题
名校
解题方法
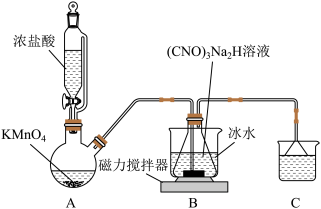
6 . DCCNa(二氯异氰尿酸钠)固体是一种高效、安全的消毒剂,20°C以上易溶于水。(CNO)3H3(氰尿酸)为三元弱酸。
I.制备DCCA(二氯异氰尿酸)装置如图。主要反应有:
碱溶(CNO)3H3+2NaOH⇌(CNO)3Na2H+2H2O△H<0
氯化(CNO)3Na2H+2Cl2⇌(CNO3)Cl2H+2NaCl△H<0
回答下列问题:
(1)装置C中的溶液是_________ ,作用为_________ 。
(2)装置A中反应的离子方程式为____________ 。
(3)装置B用冰水浴的原因是___ ,碱溶时若氢氧化钠过量,(CNO)3Na2H中可能混有的杂质是__ 。
II.制备DCCNa
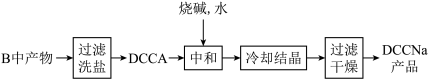
(4)步骤II中“过滤洗盐”洗去的盐是________ 。
(5)“中和”反应的化学方程式为_________ 。
(6)氯元素含量的测定:称取0.1000gDCCNa样品,加入一定量醋酸溶液溶解,样品中的氯元素全部化成HClO,再加入足量的KI溶液,用淀粉作指示剂,用0.1000mol•L-1Na2S2O3标准溶液滴定生成的碘,消耗标准液VmL。已知:I2+2 =2I-+
=2I-+ ,样品中氯元素的质量分数=
,样品中氯元素的质量分数=______ %。
(7)下列操作可能使氯元素的质量分数测定结果偏低的是________ 填字母)。
a.滴定前滴定管未排气泡,滴定后气泡消失 b.滴定后,滴定管尖嘴外还悬着一滴液体
c.锥形瓶内溶液蓝色消失后立即读数 d.读数时,滴定前平视,滴定后仰视
I.制备DCCA(二氯异氰尿酸)装置如图。主要反应有:
碱溶(CNO)3H3+2NaOH⇌(CNO)3Na2H+2H2O△H<0
氯化(CNO)3Na2H+2Cl2⇌(CNO3)Cl2H+2NaCl△H<0

回答下列问题:
(1)装置C中的溶液是
(2)装置A中反应的离子方程式为
(3)装置B用冰水浴的原因是
II.制备DCCNa

(4)步骤II中“过滤洗盐”洗去的盐是
(5)“中和”反应的化学方程式为
(6)氯元素含量的测定:称取0.1000gDCCNa样品,加入一定量醋酸溶液溶解,样品中的氯元素全部化成HClO,再加入足量的KI溶液,用淀粉作指示剂,用0.1000mol•L-1Na2S2O3标准溶液滴定生成的碘,消耗标准液VmL。已知:I2+2
 =2I-+
=2I-+ ,样品中氯元素的质量分数=
,样品中氯元素的质量分数=(7)下列操作可能使氯元素的质量分数测定结果偏低的是
a.滴定前滴定管未排气泡,滴定后气泡消失 b.滴定后,滴定管尖嘴外还悬着一滴液体
c.锥形瓶内溶液蓝色消失后立即读数 d.读数时,滴定前平视,滴定后仰视
您最近一年使用:0次
2020-07-11更新
|
690次组卷
|
6卷引用:天津市十二区县2020届高三第二次模拟考试化学试题
天津市十二区县2020届高三第二次模拟考试化学试题(已下线)解密11 化学实验(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密11 化学实验(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)考点31 物质的制备 定量分析-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点34 物质的制备与合成-备战2022年高考化学一轮复习考点帮(浙江专用)江西省吉安市泰和县第二中学2022-2023学年高一上学期期末考试化学试题
7 . 下列实验操作或分析正确的是
A.用湿润的 试纸测盐酸的 试纸测盐酸的 |
B.检验淀粉是否水解,可以向淀粉溶液中加入稀 ,加热一段时间,冷却后加入新制 ,加热一段时间,冷却后加入新制 ,煮沸,观察是否有红色沉淀生成 ,煮沸,观察是否有红色沉淀生成 |
| C.乙醇和乙酸在浓硫酸作用下,酯化制得乙酸乙酯,提纯乙酸乙酯需要经过水、氢氧化钠溶液洗涤 |
| D.用盐酸标准溶液滴定待测的氢氧化钠溶液时,水洗后的酸式滴定管未经标准液润洗,则测定结果偏高 |
您最近一年使用:0次
名校
解题方法
8 . 下列实验操作会使实验最终结果偏高的是
| A.用湿润的pH 试纸测定NaOH的pH |
| B.配制100 mL 1.00 mol·L -1 NaCl溶液,定容时俯视刻度线 |
| C.用0.0001 mol·L -1盐酸滴定20.00 mL NaOH溶液,起始读数时仰视 |
| D.测定中和热的数值时,将0.5 mol·L -1NaOH溶液倒入盐酸后,立即读数 |
您最近一年使用:0次
2020-05-12更新
|
644次组卷
|
6卷引用:天津市红桥区2020届高三第一次模拟考试化学试题
9 .  是一种工业盐,外观与食盐非常相似,毒性较强。请按要求回答下列问题:
是一种工业盐,外观与食盐非常相似,毒性较强。请按要求回答下列问题:
(1)已知: ,
, ,
, 。设计最简单的方法鉴别
。设计最简单的方法鉴别 和
和 两种固体:
两种固体: __________________________________ 。
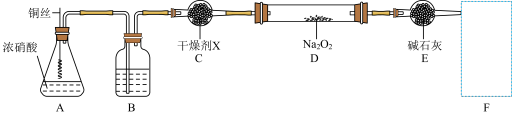
(2)利用下图装置(略去夹持仪器)制备
已知: ;酸性条件下,
;酸性条件下, 和
和 均能与
均能与 迅速反应生成
迅速反应生成 和
和 。
。
①装置A中发生反应的离子方程式为__________________________________ ;
这样安放铜丝比将铜片浸于液体中的优点是__________________________ 。
②装置B中反应的化学方程式为________________________________ 。
③干燥剂X的名称为__________ ,其作用是____________________ 。
④上图设计有缺陷,请在F方框内将装置补充完全,并填写相关试剂名称 ___________ 。
(3)测定产品的纯度。
取 制取的样品溶于水配成
制取的样品溶于水配成 溶液,取
溶液,取 溶液于锥形瓶中,用
溶液于锥形瓶中,用 酸性
酸性 溶液进行滴定,实验所得数据如下表:
溶液进行滴定,实验所得数据如下表:
①第一次滴定实验数据异常的原因可能是______ (填字母序号)。
A.酸式滴定管用蒸馏水洗净后未用标准液润洗
B.锥形瓶洗净后未干燥
C.当观察到最后一滴溶液滴入待测液中红色慢慢褪去,定为滴定终点
D.滴定终点时俯视读数
②酸性 溶液滴定
溶液滴定 溶液的离子方程式为
溶液的离子方程式为__________________ 。
③该样品中 的质量分数为
的质量分数为__________ 。
 是一种工业盐,外观与食盐非常相似,毒性较强。请按要求回答下列问题:
是一种工业盐,外观与食盐非常相似,毒性较强。请按要求回答下列问题:(1)已知:
 ,
, ,
, 。设计最简单的方法鉴别
。设计最简单的方法鉴别 和
和 两种固体:
两种固体: (2)利用下图装置(略去夹持仪器)制备

已知:
 ;酸性条件下,
;酸性条件下, 和
和 均能与
均能与 迅速反应生成
迅速反应生成 和
和 。
。①装置A中发生反应的离子方程式为
这样安放铜丝比将铜片浸于液体中的优点是
②装置B中反应的化学方程式为
③干燥剂X的名称为
④上图设计有缺陷,请在F方框内将装置
(3)测定产品的纯度。
取
 制取的样品溶于水配成
制取的样品溶于水配成 溶液,取
溶液,取 溶液于锥形瓶中,用
溶液于锥形瓶中,用 酸性
酸性 溶液进行滴定,实验所得数据如下表:
溶液进行滴定,实验所得数据如下表:| 滴定次数 | 1 | 2 | 3 | 4 |
消耗 溶液体积 溶液体积 | 20.90 | 20.12 | 20.00 | 19.88 |
①第一次滴定实验数据异常的原因可能是
A.酸式滴定管用蒸馏水洗净后未用标准液润洗
B.锥形瓶洗净后未干燥
C.当观察到最后一滴溶液滴入待测液中红色慢慢褪去,定为滴定终点
D.滴定终点时俯视读数
②酸性
 溶液滴定
溶液滴定 溶液的离子方程式为
溶液的离子方程式为③该样品中
 的质量分数为
的质量分数为
您最近一年使用:0次
名校
10 . 下列说法正确的是
A.在酸性溶液中Fe3+、NH4+、SCN—、NO 和MnO 和MnO 可以大量共存 可以大量共存 |
B.SO2通入溴水中,反应的离子方程式为SO2+Br2+2H2O═SO +2Br —+4H+ +2Br —+4H+ |
C.加入铝粉能产生H2的溶液中,可能存在大量的Na+、Ba2+、AlO 、NO 、NO |
| D.为了减小中和滴定的误差,锥形瓶必须洗净并烘干后才能使用 |
您最近一年使用:0次



