解题方法
1 . 富马酸亚铁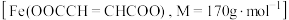 是一种治疗贫血的药物。其制备及纯度测定实验如下:
是一种治疗贫血的药物。其制备及纯度测定实验如下:
I.制备
步骤1:将 富马酸
富马酸 固体置于
固体置于 烧杯中,加水
烧杯中,加水 ,在加热搅拌下加入
,在加热搅拌下加入 溶液
溶液 ,使其
,使其 为
为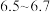 。
。
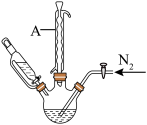
步骤2:将上述溶液转移至如图所示装置中(省略加热、搅拌和夹持装置),通 并加热一段时间后,维持温度100℃,缓慢滴加
并加热一段时间后,维持温度100℃,缓慢滴加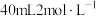 的
的 溶液,搅拌充分反应
溶液,搅拌充分反应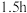 ;
; 。
。
II.纯度测定
取 样品置于
样品置于 锥形瓶中,加入煮沸过的
锥形瓶中,加入煮沸过的 硫酸溶液
硫酸溶液 ,待样品完全溶解后,加入煮沸过的蒸馏水
,待样品完全溶解后,加入煮沸过的蒸馏水 和2滴邻二氮菲指示剂(邻二氮菲遇
和2滴邻二氮菲指示剂(邻二氮菲遇 呈红色,遇
呈红色,遇 呈无色),立即用
呈无色),立即用 标准溶液滴定至终点(反应的离子方程式为
标准溶液滴定至终点(反应的离子方程式为 ),平行测定三次,消耗标准溶液的平均体积为
),平行测定三次,消耗标准溶液的平均体积为 。
。
对于上述实验,下列说法不正确的是
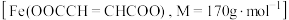 是一种治疗贫血的药物。其制备及纯度测定实验如下:
是一种治疗贫血的药物。其制备及纯度测定实验如下:I.制备
步骤1:将
 富马酸
富马酸 固体置于
固体置于 烧杯中,加水
烧杯中,加水 ,在加热搅拌下加入
,在加热搅拌下加入 溶液
溶液 ,使其
,使其 为
为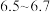 。
。步骤2:将上述溶液转移至如图所示装置中(省略加热、搅拌和夹持装置),通
 并加热一段时间后,维持温度100℃,缓慢滴加
并加热一段时间后,维持温度100℃,缓慢滴加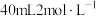 的
的 溶液,搅拌充分反应
溶液,搅拌充分反应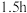 ;
;
 。
。II.纯度测定
取
 样品置于
样品置于 锥形瓶中,加入煮沸过的
锥形瓶中,加入煮沸过的 硫酸溶液
硫酸溶液 ,待样品完全溶解后,加入煮沸过的蒸馏水
,待样品完全溶解后,加入煮沸过的蒸馏水 和2滴邻二氮菲指示剂(邻二氮菲遇
和2滴邻二氮菲指示剂(邻二氮菲遇 呈红色,遇
呈红色,遇 呈无色),立即用
呈无色),立即用 标准溶液滴定至终点(反应的离子方程式为
标准溶液滴定至终点(反应的离子方程式为 ),平行测定三次,消耗标准溶液的平均体积为
),平行测定三次,消耗标准溶液的平均体积为 。
。对于上述实验,下列说法不正确的是
A.“步骤2”若不通入 会导致产品纯度降低 会导致产品纯度降低 |
| B.可以用硝酸代替硫酸进行纯度测定 |
C.加入煮沸过的蒸馏水小于 ,对实验结果无影响 ,对实验结果无影响 |
| D.滴定前仰视读数,导致产品纯度测定结果偏低 |
您最近一年使用:0次
2 . 亚硝酸钠 是工业用盐,具有着色、增色、抑菌、防腐等作用。实验室将一定量已知的高锰酸钾标准液放入锥形瓶中再加入硫酸,用亚硝酸钠滴定高锰酸钾标准液,进行样品中亚硝酸钠的含量分析。下列有关说法错误的是
是工业用盐,具有着色、增色、抑菌、防腐等作用。实验室将一定量已知的高锰酸钾标准液放入锥形瓶中再加入硫酸,用亚硝酸钠滴定高锰酸钾标准液,进行样品中亚硝酸钠的含量分析。下列有关说法错误的是
 是工业用盐,具有着色、增色、抑菌、防腐等作用。实验室将一定量已知的高锰酸钾标准液放入锥形瓶中再加入硫酸,用亚硝酸钠滴定高锰酸钾标准液,进行样品中亚硝酸钠的含量分析。下列有关说法错误的是
是工业用盐,具有着色、增色、抑菌、防腐等作用。实验室将一定量已知的高锰酸钾标准液放入锥形瓶中再加入硫酸,用亚硝酸钠滴定高锰酸钾标准液,进行样品中亚硝酸钠的含量分析。下列有关说法错误的是A.滴定前滴定管尖嘴处有气泡,滴定后无气泡会使测得的 含量偏高 含量偏高 |
B.亚硝酸根( )空间结构为V形 )空间结构为V形 |
| C.酸性高锰酸钾溶液可以鉴别食盐和亚硝酸钠 |
D.滴定过程离子反应为: |
您最近一年使用:0次
3 . 测定150.0g新鲜菠菜中草酸含量(以 计),实验方案如图。下列说法错误的是
计),实验方案如图。下列说法错误的是
 计),实验方案如图。下列说法错误的是
计),实验方案如图。下列说法错误的是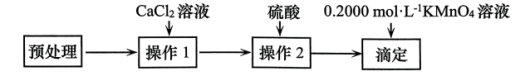
| A.“操作1”需要用到的主要玻璃仪器有3种 |
| B.“操作2”若用盐酸替代硫酸可能会导致测定结果偏高 |
| C.“滴定”至终点后,需再静置滴定管1~2分钟后读数,否则会使测定结果偏高 |
D.若滴定终点消耗30.00mL 溶液,则测得菠菜中草酸含量为9.000% 溶液,则测得菠菜中草酸含量为9.000% |
您最近一年使用:0次
解题方法
4 . 硫代硫酸钠在纺织业等领域有广泛应用。某兴趣小组用如图所示装置制备 。
。 易溶于水,难溶于乙醇,
易溶于水,难溶于乙醇, 以上会逐渐失去结晶水。
以上会逐渐失去结晶水。
(ⅱ)合成反应: ;
; ;
; 。
。
实验步骤:
Ⅰ. 制备:装置
制备:装置 制备的
制备的 经过单向阀通入装置
经过单向阀通入装置 中的混合溶液中,加热、搅拌,至溶液
中的混合溶液中,加热、搅拌,至溶液 约为7时,停止通入
约为7时,停止通入 气体,得产品混合溶液。
气体,得产品混合溶液。
Ⅱ.产品分离提纯:产品混合溶液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥,即可得 粗产品。
粗产品。
Ⅲ.产品纯度测定:取 粗产品配制成
粗产品配制成 溶液,用移液管取
溶液,用移液管取 于锥形瓶中、以淀粉溶液作指示剂,用浓度为0.0250mol/L的碘标准溶液滴定至终点,重复实验3次,平均消耗碘标准溶液
于锥形瓶中、以淀粉溶液作指示剂,用浓度为0.0250mol/L的碘标准溶液滴定至终点,重复实验3次,平均消耗碘标准溶液 ,计算
,计算 的含量(滴定反应:
的含量(滴定反应: )。请回答:
)。请回答:
(1)盛装浓硫酸的仪器名称为_______ ,步骤Ⅰ中单向阀的作用是_______ 。
(2)步骤Ⅰ中 不宜低于7的原因是
不宜低于7的原因是_______ ;装置C中生成 的总反应的化学方程式是
的总反应的化学方程式是_______ 。
(3)步骤Ⅱ中使用乙醇洗涤晶体的优点有_______ 。
(4)①步骤Ⅲ中滴定终点的现象为_______ ,该粗品中 的质量分数为
的质量分数为_______ 。
②下列操作会使测定结果偏高的是_______ (填字母)
A.滴定前滴定管尖端有气泡,终点则气泡消失
B.当滴定至溶液突然变蓝时,立即俯视读数
C.实验中用末润洗的移液管移取 溶液
溶液
 。
。
 易溶于水,难溶于乙醇,
易溶于水,难溶于乙醇,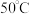 以上会逐渐失去结晶水。
以上会逐渐失去结晶水。(ⅱ)合成反应:
 ;
; ;
; 。
。实验步骤:
Ⅰ.
 制备:装置
制备:装置 制备的
制备的 经过单向阀通入装置
经过单向阀通入装置 中的混合溶液中,加热、搅拌,至溶液
中的混合溶液中,加热、搅拌,至溶液 约为7时,停止通入
约为7时,停止通入 气体,得产品混合溶液。
气体,得产品混合溶液。Ⅱ.产品分离提纯:产品混合溶液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥,即可得
 粗产品。
粗产品。Ⅲ.产品纯度测定:取
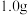 粗产品配制成
粗产品配制成 溶液,用移液管取
溶液,用移液管取 于锥形瓶中、以淀粉溶液作指示剂,用浓度为0.0250mol/L的碘标准溶液滴定至终点,重复实验3次,平均消耗碘标准溶液
于锥形瓶中、以淀粉溶液作指示剂,用浓度为0.0250mol/L的碘标准溶液滴定至终点,重复实验3次,平均消耗碘标准溶液 ,计算
,计算 的含量(滴定反应:
的含量(滴定反应: )。请回答:
)。请回答:(1)盛装浓硫酸的仪器名称为
(2)步骤Ⅰ中
 不宜低于7的原因是
不宜低于7的原因是 的总反应的化学方程式是
的总反应的化学方程式是(3)步骤Ⅱ中使用乙醇洗涤晶体的优点有
(4)①步骤Ⅲ中滴定终点的现象为
 的质量分数为
的质量分数为②下列操作会使测定结果偏高的是
A.滴定前滴定管尖端有气泡,终点则气泡消失
B.当滴定至溶液突然变蓝时,立即俯视读数
C.实验中用末润洗的移液管移取
 溶液
溶液
您最近一年使用:0次
5 . 锰废渣的硫酸浸出液含有大量 、
、 、
、 以及少量的
以及少量的 、
、 、
、 、
、 。通过沉淀—萃取法可以回收其中的锰、钴、镍,流程如图所示。
。通过沉淀—萃取法可以回收其中的锰、钴、镍,流程如图所示。 (M代表被萃取的金属)。回答下列问题:
(M代表被萃取的金属)。回答下列问题:
(1) 的作用是
的作用是___________ 。
(2)该流程中涉及的实验操作有___________(填字母标号)。
(3)加入 调pH的目的是
调pH的目的是___________ 。
(4)已知: ,
, ,向除铁后的溶液中加入
,向除铁后的溶液中加入 ,当溶液中
,当溶液中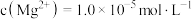 时,
时,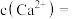
___________  。(保留1位有效数字)
。(保留1位有效数字)
(5)写出反萃取出 的离子方程式
的离子方程式___________ 。
(6)回收液中 浓度的测定:取50.00mL
浓度的测定:取50.00mL  回收液,滴入几滴紫脲酸胺(紫色)指示剂(遇
回收液,滴入几滴紫脲酸胺(紫色)指示剂(遇 显橙黄色),用浓度为0.1000
显橙黄色),用浓度为0.1000 的
的 溶液进行滴定(
溶液进行滴定( ),达到滴定终点时消耗
),达到滴定终点时消耗 溶液的体积12.50mL。
溶液的体积12.50mL。
①滴定终点的现象是___________ 。
② 物质的量浓度为
物质的量浓度为___________ 。
③若紫脲酸胺滴入过多,终点延迟,会导致所测 含量
含量___________ (填“偏高”、“偏低”或“无影响”)。
 、
、 、
、 以及少量的
以及少量的 、
、 、
、 、
、 。通过沉淀—萃取法可以回收其中的锰、钴、镍,流程如图所示。
。通过沉淀—萃取法可以回收其中的锰、钴、镍,流程如图所示。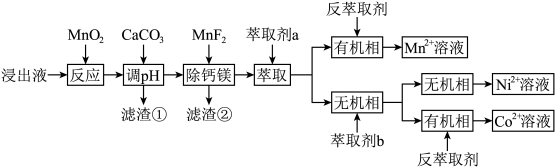
 (M代表被萃取的金属)。回答下列问题:
(M代表被萃取的金属)。回答下列问题:(1)
 的作用是
的作用是(2)该流程中涉及的实验操作有___________(填字母标号)。
| A.过滤 | B.蒸发结晶 | C.分液 | D.蒸馏 |
(3)加入
 调pH的目的是
调pH的目的是(4)已知:
 ,
, ,向除铁后的溶液中加入
,向除铁后的溶液中加入 ,当溶液中
,当溶液中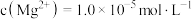 时,
时,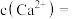
 。(保留1位有效数字)
。(保留1位有效数字)(5)写出反萃取出
 的离子方程式
的离子方程式(6)回收液中
 浓度的测定:取50.00mL
浓度的测定:取50.00mL  回收液,滴入几滴紫脲酸胺(紫色)指示剂(遇
回收液,滴入几滴紫脲酸胺(紫色)指示剂(遇 显橙黄色),用浓度为0.1000
显橙黄色),用浓度为0.1000 的
的 溶液进行滴定(
溶液进行滴定( ),达到滴定终点时消耗
),达到滴定终点时消耗 溶液的体积12.50mL。
溶液的体积12.50mL。①滴定终点的现象是
②
 物质的量浓度为
物质的量浓度为③若紫脲酸胺滴入过多,终点延迟,会导致所测
 含量
含量
您最近一年使用:0次
6 .  (硫酸四氨合铜晶体)的制备和晶体中氨含量的测定如下。已知:硫酸铜在水中的溶解度随温度的升高而增大;硫酸四氨合铜晶体受热易分解。回答下列问题:
(硫酸四氨合铜晶体)的制备和晶体中氨含量的测定如下。已知:硫酸铜在水中的溶解度随温度的升高而增大;硫酸四氨合铜晶体受热易分解。回答下列问题:
Ⅰ.硫酸铜溶液的制备
①称取4g铜粉,在仪器A中灼烧10分钟并不断搅拌,然后放置冷却。
②在蒸发皿中加入30mL3
 溶液,将仪器A中的固体慢慢放入其中,加热并不断搅拌。
溶液,将仪器A中的固体慢慢放入其中,加热并不断搅拌。
③趁热过滤,得到蓝色溶液,然后将蓝色溶液冷却到室温。
(1)仪器A的名称为_______ 。
(2)第③步中,趁热过滤的目的是_______ 。
Ⅱ.硫酸四氨合铜晶体的制备
将上述制得的硫酸铜溶液按下图所示进行操作: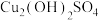 ,则反应生成该沉淀的离子方程式为
,则反应生成该沉淀的离子方程式为______________ 。
(4)析出硫酸四氨合铜晶体时采用加入95%乙醇溶液的方法,原因是______________ 。析出硫酸四氨合铜晶体时不能采用浓缩结晶的方法,原因是_______ 。
Ⅲ.氨含量的测定
精确称取m g晶体,加适量水溶解,注入如图所示的三颈烧瓶中,然后逐滴加入10% NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用 mL 0.500
mL 0.500 HCl标准溶液完全吸收。取下接收瓶,用0.500
HCl标准溶液完全吸收。取下接收瓶,用0.500 NaOH标准溶液滴定过剩的盐酸,到终点时消耗
NaOH标准溶液滴定过剩的盐酸,到终点时消耗 mL NaOH标准溶液。
mL NaOH标准溶液。_______ (填“酚酞”或“甲基橙”)溶液作指示剂。
(6)样品中氨的质量分数的表达式为_______ (用含m、 、
、 的代数式表示)。
的代数式表示)。
(7)下列实验操作会使氨含量的测定结果偏高的是_______(填标号)。
 (硫酸四氨合铜晶体)的制备和晶体中氨含量的测定如下。已知:硫酸铜在水中的溶解度随温度的升高而增大;硫酸四氨合铜晶体受热易分解。回答下列问题:
(硫酸四氨合铜晶体)的制备和晶体中氨含量的测定如下。已知:硫酸铜在水中的溶解度随温度的升高而增大;硫酸四氨合铜晶体受热易分解。回答下列问题:Ⅰ.硫酸铜溶液的制备
①称取4g铜粉,在仪器A中灼烧10分钟并不断搅拌,然后放置冷却。
②在蒸发皿中加入30mL3
 溶液,将仪器A中的固体慢慢放入其中,加热并不断搅拌。
溶液,将仪器A中的固体慢慢放入其中,加热并不断搅拌。③趁热过滤,得到蓝色溶液,然后将蓝色溶液冷却到室温。
(1)仪器A的名称为
(2)第③步中,趁热过滤的目的是
Ⅱ.硫酸四氨合铜晶体的制备
将上述制得的硫酸铜溶液按下图所示进行操作:
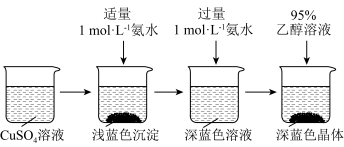
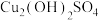 ,则反应生成该沉淀的离子方程式为
,则反应生成该沉淀的离子方程式为(4)析出硫酸四氨合铜晶体时采用加入95%乙醇溶液的方法,原因是
Ⅲ.氨含量的测定
精确称取m g晶体,加适量水溶解,注入如图所示的三颈烧瓶中,然后逐滴加入10% NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用
 mL 0.500
mL 0.500 HCl标准溶液完全吸收。取下接收瓶,用0.500
HCl标准溶液完全吸收。取下接收瓶,用0.500 NaOH标准溶液滴定过剩的盐酸,到终点时消耗
NaOH标准溶液滴定过剩的盐酸,到终点时消耗 mL NaOH标准溶液。
mL NaOH标准溶液。
(6)样品中氨的质量分数的表达式为
 、
、 的代数式表示)。
的代数式表示)。(7)下列实验操作会使氨含量的测定结果偏高的是_______(填标号)。
| A.读数时,滴定前平视,滴定后俯视 |
| B.碱式滴定管用蒸馏水洗净后未用NaOH标准溶液润洗就直接注入NaOH标准溶液进行滴定 |
| C.取下接收瓶前,未用蒸馏水冲洗插入接收瓶中的导管外壁 |
| D.将样品液中的氨全部蒸出后,未用蒸馏水冲洗导管内壁 |
您最近一年使用:0次
7 . 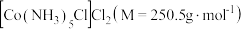 是一种易溶于热水,难溶于乙醇的紫红色晶体。
是一种易溶于热水,难溶于乙醇的紫红色晶体。
(1)制备步骤:将适量氯化铵溶于浓氨水中,边搅拌边分批次加入 研细的
研细的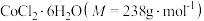 ,得到
,得到 沉淀。边搅拌边慢慢滴入足量
沉淀。边搅拌边慢慢滴入足量 溶液,得到
溶液,得到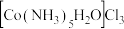 溶液。慢慢注入适量浓盐酸,得到沉淀,水浴加热,冷却至室温,得到紫红色晶体,减压过滤,洗涤,烘干,得到
溶液。慢慢注入适量浓盐酸,得到沉淀,水浴加热,冷却至室温,得到紫红色晶体,减压过滤,洗涤,烘干,得到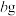 产品。
产品。
(2)钴的测定:取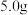 样品于锥形瓶中,加入
样品于锥形瓶中,加入 溶液并加热使钴(Ⅲ)完全沉淀,后加入
溶液并加热使钴(Ⅲ)完全沉淀,后加入 和
和 将其还原为钴(Ⅱ),再加入
将其还原为钴(Ⅱ),再加入 ,用
,用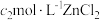 标准溶液滴定过量的
标准溶液滴定过量的 ,消耗
,消耗 溶液平均体积为
溶液平均体积为 与金属阳离子
与金属阳离子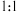 反应)。
反应)。
根据上述原理,下列说法错误的是
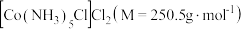 是一种易溶于热水,难溶于乙醇的紫红色晶体。
是一种易溶于热水,难溶于乙醇的紫红色晶体。(1)制备步骤:将适量氯化铵溶于浓氨水中,边搅拌边分批次加入
 研细的
研细的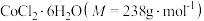 ,得到
,得到 沉淀。边搅拌边慢慢滴入足量
沉淀。边搅拌边慢慢滴入足量 溶液,得到
溶液,得到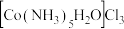 溶液。慢慢注入适量浓盐酸,得到沉淀,水浴加热,冷却至室温,得到紫红色晶体,减压过滤,洗涤,烘干,得到
溶液。慢慢注入适量浓盐酸,得到沉淀,水浴加热,冷却至室温,得到紫红色晶体,减压过滤,洗涤,烘干,得到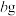 产品。
产品。(2)钴的测定:取
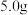 样品于锥形瓶中,加入
样品于锥形瓶中,加入 溶液并加热使钴(Ⅲ)完全沉淀,后加入
溶液并加热使钴(Ⅲ)完全沉淀,后加入 和
和 将其还原为钴(Ⅱ),再加入
将其还原为钴(Ⅱ),再加入 ,用
,用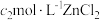 标准溶液滴定过量的
标准溶液滴定过量的 ,消耗
,消耗 溶液平均体积为
溶液平均体积为 与金属阳离子
与金属阳离子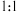 反应)。
反应)。根据上述原理,下列说法错误的是
A.若用热水洗涤紫红色晶体,将导致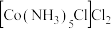 的产率偏小 的产率偏小 |
| B.还原为钴(Ⅱ)后,锥形瓶内壁残留少量沉淀,将导致钴的质量分数测量结果偏小 |
C.配制 时,定容时若仰视刻度线,将导致钴的质量分数测量结果偏小 时,定容时若仰视刻度线,将导致钴的质量分数测量结果偏小 |
| D.滴定结束后滴定管中有气泡产生,将导致钴的质量分数测量结果偏大 |
您最近一年使用:0次
8 . 利用工业废液生产 CuSCN具有经济价值和社会效益。SCN⁻的测定方法如下:
①准确称取 CuSCN 样品 m g 置于 100 mL 烧杯中,加入 30 mL 水,再加入 20.00 mL 溶液充分反应,在不断搅拌下加热至微沸,保持5min;取下,趁热用中速滤纸过滤于100 mL 容量瓶中,用蒸馏水多次洗涤沉淀,至洗出液呈中性,并检查无SCN⁻,用去离子水稀释滤液到刻度,混匀,作为含SCN⁻的待测试液。
溶液充分反应,在不断搅拌下加热至微沸,保持5min;取下,趁热用中速滤纸过滤于100 mL 容量瓶中,用蒸馏水多次洗涤沉淀,至洗出液呈中性,并检查无SCN⁻,用去离子水稀释滤液到刻度,混匀,作为含SCN⁻的待测试液。
②准确移取25.00mL SCN⁻待测试液于250mL锥形瓶中,加入8 mL硝酸酸化,摇匀后,加入 标准溶液和3~4滴指示剂溶液,充分摇匀,再用0.050 0
标准溶液和3~4滴指示剂溶液,充分摇匀,再用0.050 0 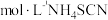 标准溶液滴定至终点,平行滴定3次,记录平均消耗NH4SCN 标准溶液的体积为`V2mL。
标准溶液滴定至终点,平行滴定3次,记录平均消耗NH4SCN 标准溶液的体积为`V2mL。
已知:CuSCN+NaOH =NaSCN+CuOH↓,2CuOH =Cu2O+H2O;Ag⁺ +SCN⁻=AgSCN↓(白色)。
根据上述实验原理,下列说法错误的是
①准确称取 CuSCN 样品 m g 置于 100 mL 烧杯中,加入 30 mL 水,再加入 20.00 mL
 溶液充分反应,在不断搅拌下加热至微沸,保持5min;取下,趁热用中速滤纸过滤于100 mL 容量瓶中,用蒸馏水多次洗涤沉淀,至洗出液呈中性,并检查无SCN⁻,用去离子水稀释滤液到刻度,混匀,作为含SCN⁻的待测试液。
溶液充分反应,在不断搅拌下加热至微沸,保持5min;取下,趁热用中速滤纸过滤于100 mL 容量瓶中,用蒸馏水多次洗涤沉淀,至洗出液呈中性,并检查无SCN⁻,用去离子水稀释滤液到刻度,混匀,作为含SCN⁻的待测试液。②准确移取25.00mL SCN⁻待测试液于250mL锥形瓶中,加入8 mL硝酸酸化,摇匀后,加入
 标准溶液和3~4滴指示剂溶液,充分摇匀,再用0.050 0
标准溶液和3~4滴指示剂溶液,充分摇匀,再用0.050 0 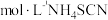 标准溶液滴定至终点,平行滴定3次,记录平均消耗NH4SCN 标准溶液的体积为`V2mL。
标准溶液滴定至终点,平行滴定3次,记录平均消耗NH4SCN 标准溶液的体积为`V2mL。已知:CuSCN+NaOH =NaSCN+CuOH↓,2CuOH =Cu2O+H2O;Ag⁺ +SCN⁻=AgSCN↓(白色)。
根据上述实验原理,下列说法错误的是
| A.用去离子水稀释滤液超过刻度线,立即吸出多余部分,将导致测定结果偏小 |
| B.用滴定管量取含SCN⁻的待测液时,没有润洗滴定管,将导致测量结果偏小 |
| C.使用 NH4SCN标准溶液滴定至终点时俯视读数,将导致测定结果偏小 |
| D.滴定过程中发现溶液出现淡粉色,立即读数,将导致测定结果偏大 |
您最近一年使用:0次
名校
解题方法
9 . 二氯异氰尿酸钠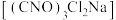 具有很强的氧化性(遇酸会生成次氯酸),是一种广普高效的杀菌剂,常温下为白色固体、溶于水,难溶于冰水。实验室常用高浓度的NaClO溶液和
具有很强的氧化性(遇酸会生成次氯酸),是一种广普高效的杀菌剂,常温下为白色固体、溶于水,难溶于冰水。实验室常用高浓度的NaClO溶液和 (氰尿酸)溶液,在10℃时反应制备二氯异氰尿酸钠,实验装置如图所示:
(氰尿酸)溶液,在10℃时反应制备二氯异氰尿酸钠,实验装置如图所示:
(1)装置B中试剂为___________ 。
(2) 的制备步骤如下:
的制备步骤如下:
①检查装置气密性后加入药品。
②关闭K1,打开K2,向A中滴加足量的浓盐酸,关闭K2,当观察到___________ 时,滴入 的吡啶溶液,写出
的吡啶溶液,写出 和NaClO发生反应的化学方程式
和NaClO发生反应的化学方程式___________ 。制备过程中要不断通入Cl2,其目的是___________ ,反应完成后需进行的操作为___________ 。
③取装置D中溶液,制得产品。操作为___________ 、过滤、冷水洗涤、低温干燥得到粗产品。
(3)粗产品中 纯度测定。取m g粗产品溶于少量水,加入过量维生素C充分反应,再加入过量
纯度测定。取m g粗产品溶于少量水,加入过量维生素C充分反应,再加入过量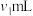
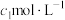 的AgNO3溶液,加入几滴稀
的AgNO3溶液,加入几滴稀 溶液,用
溶液,用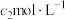 NH4SCN标准溶液滴定至终点,消耗
NH4SCN标准溶液滴定至终点,消耗 标准液。[已知:
标准液。[已知: (白色)]
(白色)]
① (摩尔质量为
(摩尔质量为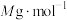 )的纯度为
)的纯度为___________ 。
②下列有关上述滴定操作的说法正确的是___________ 。
a.接近滴定终点时微微转动活塞,使溶液悬挂在尖嘴上,形成半滴,用锥形瓶内壁将其刮落
b.若盛放NH4SCN标准溶液的滴定管没有润洗,使测定结果偏大
c.锥形瓶洗涤后未干燥即加入所配待测溶液,使测定结果偏小
d.滴定前俯视读数,滴定后仰视读数,使测定结果偏小
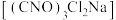 具有很强的氧化性(遇酸会生成次氯酸),是一种广普高效的杀菌剂,常温下为白色固体、溶于水,难溶于冰水。实验室常用高浓度的NaClO溶液和
具有很强的氧化性(遇酸会生成次氯酸),是一种广普高效的杀菌剂,常温下为白色固体、溶于水,难溶于冰水。实验室常用高浓度的NaClO溶液和 (氰尿酸)溶液,在10℃时反应制备二氯异氰尿酸钠,实验装置如图所示:
(氰尿酸)溶液,在10℃时反应制备二氯异氰尿酸钠,实验装置如图所示:
(1)装置B中试剂为
(2)
 的制备步骤如下:
的制备步骤如下:①检查装置气密性后加入药品。
②关闭K1,打开K2,向A中滴加足量的浓盐酸,关闭K2,当观察到
 的吡啶溶液,写出
的吡啶溶液,写出 和NaClO发生反应的化学方程式
和NaClO发生反应的化学方程式③取装置D中溶液,制得产品。操作为
(3)粗产品中
 纯度测定。取m g粗产品溶于少量水,加入过量维生素C充分反应,再加入过量
纯度测定。取m g粗产品溶于少量水,加入过量维生素C充分反应,再加入过量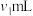
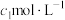 的AgNO3溶液,加入几滴稀
的AgNO3溶液,加入几滴稀 溶液,用
溶液,用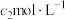 NH4SCN标准溶液滴定至终点,消耗
NH4SCN标准溶液滴定至终点,消耗 标准液。[已知:
标准液。[已知: (白色)]
(白色)]①
 (摩尔质量为
(摩尔质量为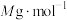 )的纯度为
)的纯度为②下列有关上述滴定操作的说法正确的是
a.接近滴定终点时微微转动活塞,使溶液悬挂在尖嘴上,形成半滴,用锥形瓶内壁将其刮落
b.若盛放NH4SCN标准溶液的滴定管没有润洗,使测定结果偏大
c.锥形瓶洗涤后未干燥即加入所配待测溶液,使测定结果偏小
d.滴定前俯视读数,滴定后仰视读数,使测定结果偏小
您最近一年使用:0次
解题方法
10 . 过氧化钙晶体(CaO2⋅8H2O,微溶于水,不溶于乙醇、乙醚)是重要的化学品,常用作杀菌剂、防腐剂、化妆品的添加剂等。实验室以石灰石(含有少量铁、硅的氧化物)为原料制备CaO2的实验流程如下:
(1)由石灰石制备纯CaCO3的过程需经过盐酸溶解、H2O2溶液氧化、调pH除铁、 溶液沉钙等步骤。
溶液沉钙等步骤。
①“调pH除铁”后,需用如图所示的热抽滤装置除去 ,相比普通过滤装置,热抽滤装置的优点是
,相比普通过滤装置,热抽滤装置的优点是___________ 。 溶液沉钙”反应的离子方程式为
溶液沉钙”反应的离子方程式为___________ 。
(2)“制备”过程所用装置如下图所示:___________ ,若用乙装置制备NH3,,写出反应的化学方程式:___________ 。
②仪器X的名称为___________ 。
③“制备” 需在冰水浴中进行,温度需控制在0℃,可采取的方法是
需在冰水浴中进行,温度需控制在0℃,可采取的方法是___________ 。生成 的离子方程式为
的离子方程式为___________ ;CaCl2与H2O2直接反应不易发生,制备时加入适量氨水有利于CaO2生成,其原因可能是___________ 。
(3)产品中CaO2含量测定。高锰酸钾滴定法原理为在酸性条件下,CaO2与稀酸反应生成H2O2,用标准酸性KMnO4溶液滴定所生成的H2O2,以确定CaO2含量。下列关于滴定分析的说法,错误的是___________(填字母)。

(1)由石灰石制备纯CaCO3的过程需经过盐酸溶解、H2O2溶液氧化、调pH除铁、
 溶液沉钙等步骤。
溶液沉钙等步骤。①“调pH除铁”后,需用如图所示的热抽滤装置除去
 ,相比普通过滤装置,热抽滤装置的优点是
,相比普通过滤装置,热抽滤装置的优点是
 溶液沉钙”反应的离子方程式为
溶液沉钙”反应的离子方程式为(2)“制备”过程所用装置如下图所示:

②仪器X的名称为
③“制备”
 需在冰水浴中进行,温度需控制在0℃,可采取的方法是
需在冰水浴中进行,温度需控制在0℃,可采取的方法是 的离子方程式为
的离子方程式为(3)产品中CaO2含量测定。高锰酸钾滴定法原理为在酸性条件下,CaO2与稀酸反应生成H2O2,用标准酸性KMnO4溶液滴定所生成的H2O2,以确定CaO2含量。下列关于滴定分析的说法,错误的是___________(填字母)。
| A.滴定时应一直观察滴定管中溶液体积的变化 |
| B.当滴入半滴酸性KMnO4溶液后,溶液颜色从无色刚好变为浅红色,且半分钟内不变色,表示已经到达滴定终点 |
| C.滴定前滴定管尖嘴内有气泡,滴定后尖嘴内无气泡,则测定结果偏小 |
| D.读取KMnO4溶液体积时,滴定前俯视读数,滴定后仰视读数,则测定结果偏大 |
您最近一年使用:0次



