1 . 二氧化氯(ClO2)是一种黄绿色气体,极易溶于水但不与水反应,在工业_上常用作水处理剂。某小组查阅文献后设计了如图所示的实验装置制备ClO2。

已知ClO2性质非常不稳定,温度过高、水溶液中ClO2的质量分数高于30%或在混合气体中的体积分数大于10%等均有可能引起爆炸。
完成下列填空:
(1)NaClO3与H2O2反应生成ClO2,根据氧化还原原理可以推测产物中还含有的另一种气体是___ 。装置A需保持温度在60~80℃之间。控制温度的目的是:___ 。
(2)B瓶的作用是___ 。
(3)若当看到装置C中导管液面上升时应进行的操作是___ 。
(4)测定装置C中ClO2的溶液的浓度:取10mLC瓶中溶液于锥形瓶中,加入足量的KI溶液和H2SO4酸化,然后加入___ 作指示剂,用0.2500mol/LNa2S2O3标准液滴定,(I2+2S2O =2I-+S4O
=2I-+S4O )。当看到
)。当看到___ 现象时,测得标准液消耗的体积为20.00mL,通过计算可知C中ClO2溶液的浓度为___ mol/L。
(5)滴定过程中以下操作使测定结果偏高的是___ 。

已知ClO2性质非常不稳定,温度过高、水溶液中ClO2的质量分数高于30%或在混合气体中的体积分数大于10%等均有可能引起爆炸。
完成下列填空:
(1)NaClO3与H2O2反应生成ClO2,根据氧化还原原理可以推测产物中还含有的另一种气体是
(2)B瓶的作用是
(3)若当看到装置C中导管液面上升时应进行的操作是
(4)测定装置C中ClO2的溶液的浓度:取10mLC瓶中溶液于锥形瓶中,加入足量的KI溶液和H2SO4酸化,然后加入
 =2I-+S4O
=2I-+S4O )。当看到
)。当看到(5)滴定过程中以下操作使测定结果偏高的是
| A.锥形瓶用待测液洗涤2-3次 | B.滴定前滴定管正常,滴定后尖嘴部分有气泡 |
| C.润洗后的滴定管未用标准液润洗 | D.滴定达终点时,俯视读数 |
您最近一年使用:0次
2021-10-24更新
|
171次组卷
|
2卷引用:上海市晋元高级中学2020-2021学年高三上学期期中考试(等级考)化学试题
2 . 二氯异氰尿酸钠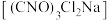 是常用的杀菌消毒剂,常温下为白色固体,难溶于冷水。某同学利用高浓度的NaClO溶液和
是常用的杀菌消毒剂,常温下为白色固体,难溶于冷水。某同学利用高浓度的NaClO溶液和 固体,在
固体,在 时反应制备二氯异氰尿酸钠,实验装置如下图所示(部分夹持装置略)。
时反应制备二氯异氰尿酸钠,实验装置如下图所示(部分夹持装置略)。
回答下列问题:
(1)仪器a的名称为_______ ;装置A中制备 的化学方程式为
的化学方程式为_______ 。
(2)待装置B_______ (填实验现象)时,再由三颈烧瓶上口加入 固体;反应过程中仍需不断通入
固体;反应过程中仍需不断通入 的理由是
的理由是_______ 。
(3)反应结束后,装置B中的浊液经过滤、_______ 、干燥得粗产品。上述装置存在一处缺陷会导致装置B中NaOH利用率降低,改进的方法是_______ 。
(4)通过下列实验测定二氯异氰尿酸钠样品中有效氯的含量。
反应原理:

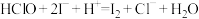
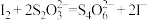
实验步骤:准确称取mg样品,用容量瓶配成250 mL溶液;取 上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,充分反应后,用
上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,充分反应后,用 标准溶液滴定至溶液呈微黄色。加入淀粉指示剂继续滴定至终点,消耗
标准溶液滴定至溶液呈微黄色。加入淀粉指示剂继续滴定至终点,消耗 溶液
溶液 。
。
①该样品的有效氯含量表达式为_______ 。(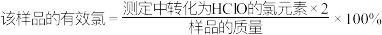 )
)
②下列操作将导致样品有效氯测定值偏低的是_______ (填标号)。
a.加入稀硫酸的量过少
b.滴定前滴定管未排气泡滴定后气泡消失
c.锥形瓶内溶液蓝色消失后立即读数
d.读数时,滴定前平视、滴定后仰视
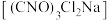 是常用的杀菌消毒剂,常温下为白色固体,难溶于冷水。某同学利用高浓度的NaClO溶液和
是常用的杀菌消毒剂,常温下为白色固体,难溶于冷水。某同学利用高浓度的NaClO溶液和 固体,在
固体,在 时反应制备二氯异氰尿酸钠,实验装置如下图所示(部分夹持装置略)。
时反应制备二氯异氰尿酸钠,实验装置如下图所示(部分夹持装置略)。

回答下列问题:
(1)仪器a的名称为
 的化学方程式为
的化学方程式为(2)待装置B
 固体;反应过程中仍需不断通入
固体;反应过程中仍需不断通入 的理由是
的理由是(3)反应结束后,装置B中的浊液经过滤、
(4)通过下列实验测定二氯异氰尿酸钠样品中有效氯的含量。
反应原理:

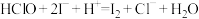
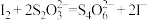
实验步骤:准确称取mg样品,用容量瓶配成250 mL溶液;取
 上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,充分反应后,用
上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,充分反应后,用 标准溶液滴定至溶液呈微黄色。加入淀粉指示剂继续滴定至终点,消耗
标准溶液滴定至溶液呈微黄色。加入淀粉指示剂继续滴定至终点,消耗 溶液
溶液 。
。①该样品的有效氯含量表达式为
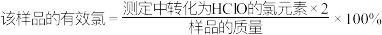 )
)②下列操作将导致样品有效氯测定值偏低的是
a.加入稀硫酸的量过少
b.滴定前滴定管未排气泡滴定后气泡消失
c.锥形瓶内溶液蓝色消失后立即读数
d.读数时,滴定前平视、滴定后仰视
您最近一年使用:0次
2020-11-24更新
|
315次组卷
|
2卷引用:山东省临沂市2021届高三上学期期中考试化学试题
3 . 亚硝酸钠是一种重要的工业用盐,某同学针对亚硝酸钠设计了如下实验:(已知:Na2O2+2NO=2NaNO2;Na2O2+2NO2=2NaNO3)
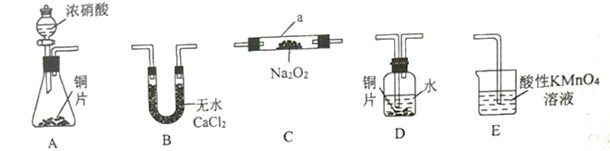
(1)该同学用以上仪器制备NaNO2,则装置的连接顺序为A→___→___→___→___→E。_________ (填序号,可重复)
(2)仪器a的名称为______________ 。
(3)NO在E中可被氧化成NO3-,写出反应的离子方程式_________________________ 。
(4)比色法测定样品中的NaNO2含量:
①在5个有编号的带刻度试管中分别加入不同量的NaNO2溶液,各加入1mL的M溶液(M遇NaNO2呈紫红色,NaNO2的浓度越大颜色越深),再加蒸馏水至总体积均为10 mL并振荡,制成标准色阶:
②称量0.10g制得的样品,溶于水配成500mL溶液,取5mL 待测液,加入1mLM溶液,再加蒸馏水至10mL 并振荡,与标准比色阶比较;
③比色的结果是: 待测液的颜色与d 组标准色阶相同,则样品中NaNO2的质量分数为_______ 。
(5)滴定法测定样品中的NaNO2含量:
①称量0.5000g制得的样品,溶于水配成500mL溶液,取25.00mL待测液于锥形瓶中,加入s mL KI 酸性溶液(足量),发生反应2NO2-+2I-+4H+=2NO↑+I2+2H2O;
②滴入2~3 滴_____ 作指示剂,用0.0100mol/LNa2S2O3溶液进行滴定,当看到______ 现象时,即为痛定终点(已知,2 Na2S2O3+ I2=Na2S4O6+2NaI);
③重复实验后,平均消耗Na2S2O3溶液的体积为20.50mL,则样品中NaNO2的质量分数为____ (保留3 位有效数字)。
④下列操作会导致测定结果偏高的是______ (填序号)。
A.滴定过程中向锥形瓶中加少量水
B.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
C.观察读数时,滴定前仰视,滴定后俯视
D.滴定时摇瓶幅度过大标准溶液滴到瓶外

(1)该同学用以上仪器制备NaNO2,则装置的连接顺序为A→___→___→___→___→E。
(2)仪器a的名称为
(3)NO在E中可被氧化成NO3-,写出反应的离子方程式
(4)比色法测定样品中的NaNO2含量:
①在5个有编号的带刻度试管中分别加入不同量的NaNO2溶液,各加入1mL的M溶液(M遇NaNO2呈紫红色,NaNO2的浓度越大颜色越深),再加蒸馏水至总体积均为10 mL并振荡,制成标准色阶:
| 试管编号 | a | b | c | d | e |
| NaNO2含量/(mg.L-1) | 0 | 20 | 40 | 60 | 80 |
③比色的结果是: 待测液的颜色与d 组标准色阶相同,则样品中NaNO2的质量分数为
(5)滴定法测定样品中的NaNO2含量:
①称量0.5000g制得的样品,溶于水配成500mL溶液,取25.00mL待测液于锥形瓶中,加入s mL KI 酸性溶液(足量),发生反应2NO2-+2I-+4H+=2NO↑+I2+2H2O;
②滴入2~3 滴
③重复实验后,平均消耗Na2S2O3溶液的体积为20.50mL,则样品中NaNO2的质量分数为
④下列操作会导致测定结果偏高的是
A.滴定过程中向锥形瓶中加少量水
B.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
C.观察读数时,滴定前仰视,滴定后俯视
D.滴定时摇瓶幅度过大标准溶液滴到瓶外
您最近一年使用:0次
名校
4 . 高锰酸钾是一种日常生活中的杀菌剂,又称“PP粉”,是一种紫黑色固体。
(1)取少量固体溶于水,得到_______ 色溶液。
(2)实验室用高锰酸钾制取氧气时有如下操作步骤:①加热,②检查装置的气密性,③装药品,将试管固定在铁架台上④用排水法收集气体,⑤从水槽中取出导气管,⑥熄灭酒精灯.其中操作顺序正确的是( )
A.②③①④⑤⑥ B.①③②⑤④⑥
C.⑤③②①④⑥ D.③①②④⑥⑤
(3)实验室加热KClO3制O2时,加入适量的KMnO4的作用是____ 。
(4)KMnO4在酸性介质中的强氧化性广泛应用于化学实验中.某同学用KMnO4测定实验室长期存放的Na2SO3固体的纯度.现准确称取6.3g Na2SO3固体样品,配成500mL溶液.取25.00mL上述溶液放入锥形瓶中,用0.01000mol/L 的酸性KMnO4溶液进行滴定.
①配平反应方程式并用单线桥标明电子转移方向和数目:________
KMnO4+ H2SO4+ Na2SO3= Na2SO4+ K2SO4+ MnSO4+ H2O.
②配制500mLNa2SO3溶液时,必须用到的实验仪器有:烧杯、玻璃棒、托盘天平、药匙、胶头滴管和________ 。
③滴定终点时现象为________ 。此时消耗标准溶液46.00mL,则样品中Na2SO3的质量分数为______ 。若滴定终点仰视读数,则Na2SO3的质量分数______ (偏大、偏小、不影响)
(5)制备KMnO4可以用电解法.用Pt作阳极,Fe作阴极,K2MnO4为电解液,阳极的电极反应式为____________________ 。
(1)取少量固体溶于水,得到
(2)实验室用高锰酸钾制取氧气时有如下操作步骤:①加热,②检查装置的气密性,③装药品,将试管固定在铁架台上④用排水法收集气体,⑤从水槽中取出导气管,⑥熄灭酒精灯.其中操作顺序正确的是
A.②③①④⑤⑥ B.①③②⑤④⑥
C.⑤③②①④⑥ D.③①②④⑥⑤
(3)实验室加热KClO3制O2时,加入适量的KMnO4的作用是
(4)KMnO4在酸性介质中的强氧化性广泛应用于化学实验中.某同学用KMnO4测定实验室长期存放的Na2SO3固体的纯度.现准确称取6.3g Na2SO3固体样品,配成500mL溶液.取25.00mL上述溶液放入锥形瓶中,用0.01000mol/L 的酸性KMnO4溶液进行滴定.
①配平反应方程式并用单线桥标明电子转移方向和数目:
KMnO4+ H2SO4+ Na2SO3= Na2SO4+ K2SO4+ MnSO4+ H2O.
②配制500mLNa2SO3溶液时,必须用到的实验仪器有:烧杯、玻璃棒、托盘天平、药匙、胶头滴管和
③滴定终点时现象为
(5)制备KMnO4可以用电解法.用Pt作阳极,Fe作阴极,K2MnO4为电解液,阳极的电极反应式为
您最近一年使用:0次
5 . 亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量。某兴趣小组进行下面实验探究,查阅资料知道:
①2NO+Na2O2=2NaNO2
②2NO2+Na2O2=2NaNO3
③酸性KMnO4溶液可将NO2﹣氧化为NO3﹣,MnO4﹣被还原成Mn2+。
Ⅰ.产品制备与检验:用图装置制备NaNO2
(1)写出装置A烧瓶中发生反应的化学方程式________________ 。
(2)B装置的作用是___________ ;盛浓硝酸的仪器名称为__________ 。
(3)有同学认为装置C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,为制备纯净的NaNO2,应在B、C装置间增加一个干燥管。在干燥管中盛放的试剂名称为____________ 。
(4)请设计实验,检验装置C中NaNO2的存在(写出操作、现象和结论)_________ 。
Ⅱ.含量的测定
称取装置C中反应后的固体4.00g溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol/L酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
(5)第一组实验数据出现异常,造成这种异常的原因可能是_________ 。
A.酸式滴定管用蒸馏水洗净后未用标准液润洗
B.锥形瓶洗净后未干燥
C.滴定结束后仰视读数
D.滴定结束后俯视读数
(6)根据表中数据,计算所得固体中亚硝酸钠的质量分数_______ 。
①2NO+Na2O2=2NaNO2
②2NO2+Na2O2=2NaNO3
③酸性KMnO4溶液可将NO2﹣氧化为NO3﹣,MnO4﹣被还原成Mn2+。
Ⅰ.产品制备与检验:用图装置制备NaNO2
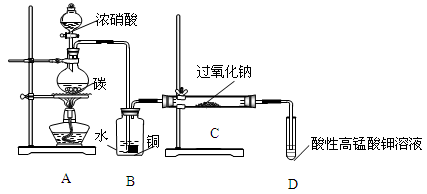
(1)写出装置A烧瓶中发生反应的化学方程式
(2)B装置的作用是
(3)有同学认为装置C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,为制备纯净的NaNO2,应在B、C装置间增加一个干燥管。在干燥管中盛放的试剂名称为
(4)请设计实验,检验装置C中NaNO2的存在(写出操作、现象和结论)
Ⅱ.含量的测定
称取装置C中反应后的固体4.00g溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol/L酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
滴定次数 | 1 | 2 | 3 | 4 |
KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
(5)第一组实验数据出现异常,造成这种异常的原因可能是
A.酸式滴定管用蒸馏水洗净后未用标准液润洗
B.锥形瓶洗净后未干燥
C.滴定结束后仰视读数
D.滴定结束后俯视读数
(6)根据表中数据,计算所得固体中亚硝酸钠的质量分数
您最近一年使用:0次
名校
6 . 苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸。
反应原理:
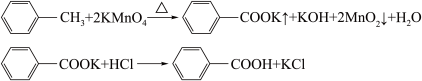
已知甲苯的熔点为-95°C,沸点为110.6°C,易挥发,密度为0.866g/cm3;苯甲酸的熔点为122.4°C,在25°C和95°C下溶解度分别为0.3g和6.9g。
【制备产品】将30.0mL甲苯和25.0mLlmol/L高锰酸钾溶液在100°C下反应30min,装置如图所示。
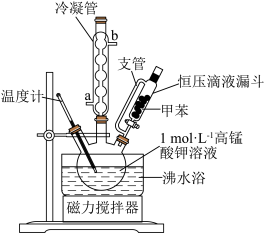
(1)图中冷凝管的进水口为___ (填“a”或“b”)。支管的作用是____ 。
(2)在本实验中,三颈烧瓶最合适的容积_____ (填字母)。
A.50mL B.100mL C.200mL D.250mL
相对于用酒精灯直接加热,用沸水浴加热的优点是_____ 。
【分离产品】该同学设计如下流程分离粗产品苯甲酸和回收甲苯
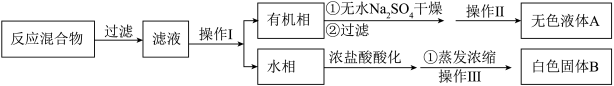
(3)操作Ⅰ的名称是____ ;含有杂志的产物经操作Ⅱ进一步提纯得无色液体甲苯,则操作Ⅱ的名称是______ 。
(4)测定白色固体的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,该同学推测白色固体是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确。
请完成表中内容。
纯度测定:称取1.220g产品,配成100ml甲醇溶液,取25.00ml溶液,用0.1000mol/L KOH标准溶液滴定,重复滴定四次,每次消耗的体积如下表所示。
(5)滴定操作中,如果对装有KOH标准溶液的滴定管读数时,滴定前仰视,滴定后俯视则测定结果______ (填“偏大”、“偏小”或“不变”)。计算样品中苯甲酸纯度为______ 。
反应原理:

已知甲苯的熔点为-95°C,沸点为110.6°C,易挥发,密度为0.866g/cm3;苯甲酸的熔点为122.4°C,在25°C和95°C下溶解度分别为0.3g和6.9g。
【制备产品】将30.0mL甲苯和25.0mLlmol/L高锰酸钾溶液在100°C下反应30min,装置如图所示。

(1)图中冷凝管的进水口为
(2)在本实验中,三颈烧瓶最合适的容积
A.50mL B.100mL C.200mL D.250mL
相对于用酒精灯直接加热,用沸水浴加热的优点是
【分离产品】该同学设计如下流程分离粗产品苯甲酸和回收甲苯

(3)操作Ⅰ的名称是
(4)测定白色固体的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,该同学推测白色固体是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确。
请完成表中内容。
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将白色固体加入水中,加热溶解, | 得到白色晶体和无色溶液 | |
| ② | 取少重滤液于试管中, | 生成白色沉淀 | 滤液含Cl- |
| ③ | 干燥白色晶体, | 白色晶体是苯甲酸 |
| 第一次 | 第二次 | 第三次 | 第四 | |
| 体积(mL) | 24.00 | 24.10 | 22.40 | 23.90 |
您最近一年使用:0次
2017-02-17更新
|
1482次组卷
|
2卷引用:2017届河南省南阳一中高三上周考五化学试卷
13-14高三上·上海杨浦·期末
7 . 工业上冶炼冰铜(mCu2O·nFeS)可得到粗铜,再以粗铜为原料制备硫酸铜晶体。
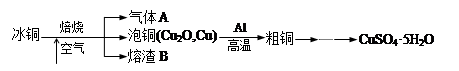
完成下列填空:
(1)气体A中的大气污染物可选用下列试剂中的_______ (填序号)吸收。
a. 浓H2SO4 b. 浓HNO3 c. NaOH溶液 d. 氨水
(2)用稀H2SO4 浸泡熔渣B,取少量所得溶液,滴加____ (填物质名称)溶液后呈红色,说明溶液中存在Fe3+,检验溶液中还存在Fe2+的方法是___ (注明试剂、现象)。
实验室可用图的装置完成泡铜冶炼粗铜的反应。
(3)泡铜冶炼粗铜的化学方程式是____________________________ 。
(4)装置中镁带的作用是____ 。泡铜和铝粉混合物表面覆盖少量白色固体a,
a是__ (填名称)。沙子能否换成水?__ (填“能”或“不能”)。
(5)用滴定法测定CuSO4·5H2O的含量。取a g试样配成100 mL溶液,取20.00mL用c mol /L 滴定剂(H2Y2–,滴定剂不与杂质反应)滴定至终点,消耗滴定剂bmL,滴定反应:Cu2++ H2Y2–=CuY2–+ 2H+。则CuSO4·5H2O质量分数的表达式是_______ 。
(6)下列操作会导致CuSO4·5H2O含量的测定结果偏高的是_____________ 。
a.滴定临近终点时,用洗瓶中的蒸馏水洗下滴定管尖嘴口的半滴标准液至锥形瓶中
b.滴定管用蒸馏水洗涤后,直接注入待测液,取20.00mL进行滴定
c.滴定前,滴定管尖端有气泡,滴定后气泡消失
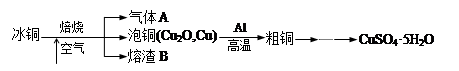
完成下列填空:
(1)气体A中的大气污染物可选用下列试剂中的
a. 浓H2SO4 b. 浓HNO3 c. NaOH溶液 d. 氨水
(2)用稀H2SO4 浸泡熔渣B,取少量所得溶液,滴加
实验室可用图的装置完成泡铜冶炼粗铜的反应。

(3)泡铜冶炼粗铜的化学方程式是
(4)装置中镁带的作用是
a是
(5)用滴定法测定CuSO4·5H2O的含量。取a g试样配成100 mL溶液,取20.00mL用c mol /L 滴定剂(H2Y2–,滴定剂不与杂质反应)滴定至终点,消耗滴定剂bmL,滴定反应:Cu2++ H2Y2–=CuY2–+ 2H+。则CuSO4·5H2O质量分数的表达式是
(6)下列操作会导致CuSO4·5H2O含量的测定结果偏高的是
a.滴定临近终点时,用洗瓶中的蒸馏水洗下滴定管尖嘴口的半滴标准液至锥形瓶中
b.滴定管用蒸馏水洗涤后,直接注入待测液,取20.00mL进行滴定
c.滴定前,滴定管尖端有气泡,滴定后气泡消失
您最近一年使用:0次
8 . 下列实验操作能达到实验目的的是( )
| A.用氨水洗涤以除去试管内壁上的银镜 |
| B.用稀硫酸洗涤并灼烧铂丝后,再进行焰色反应 |
C.如图所示装置可验证钢铁的吸氧腐蚀 |
| D.中和滴定实验时用待装液润洗锥形瓶能减小误差 |
您最近一年使用:0次
解题方法
9 . 下列实验操作能达到实验目的的是




| A.用乙醇萃取碘水中的碘 | B.用装置甲制取纯净的 |
C.用装置乙除去 中的少量 中的少量 | D.中和滴定时,用待测液润洗锥形瓶,减小实验误差 |
您最近一年使用:0次
名校
10 . 某研究性学习小组在实验室对酸碱中和反应进行探究
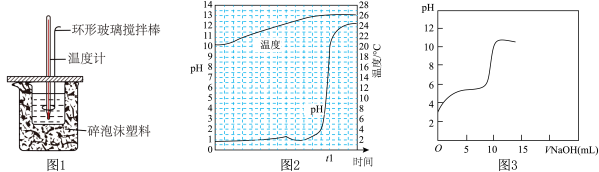
(1)中和热的测定:用50mL 0.5mol/L 的盐酸与50mL 0.55mol/L 的NaOH溶液在如图1所示装置中进行中和热测定,若用等体积等浓度的醋酸代替盐酸,测得中和热数值____ 。(填“偏大”、“偏小”或“无影响”)
(2)中和滴定:取一定量的稀盐酸,逐滴滴加NaOH溶液,边滴加边振荡。
①指示剂法:用___________ (填仪器名称)取一定体积的稀盐酸于锥形瓶中,滴加几滴甲基橙作指示剂,滴定达到终点的现象为__________ 。
②传感器法:用传感器实时获得溶液的pH、温度曲线如图2所示,当反应达到终点时,溶液的温度为____ ℃。若用等浓度的醋酸代替稀盐酸,用传感器实时获得溶液的pH如图3所示,图2与图3中溶液起始pH后者较大的原因是__________ ,图3中反应终点时溶液pH约为8,请用离子方程式表示其原因________ 。

(1)中和热的测定:用50mL 0.5mol/L 的盐酸与50mL 0.55mol/L 的NaOH溶液在如图1所示装置中进行中和热测定,若用等体积等浓度的醋酸代替盐酸,测得中和热数值
(2)中和滴定:取一定量的稀盐酸,逐滴滴加NaOH溶液,边滴加边振荡。
①指示剂法:用
②传感器法:用传感器实时获得溶液的pH、温度曲线如图2所示,当反应达到终点时,溶液的温度为
您最近一年使用:0次



