1 . Ⅰ、25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,此时溶液中C(H+)/C(NH4+)____ (填“增大”“减小”“不变”)
Ⅱ、(1)常温下,将某一元酸HA(甲、乙、丙、丁各组中的HA代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
(1)从丙组实验结果分析,该混合溶液中离子浓度是由大到小的顺序是_______________ 。
(2)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)=________ mol·L-1。
Ⅲ、某二元酸(分子式用H2B表示)在水中的电离方程是:
H2B=H++HB-
HB- H++B2-
H++B2-
则在0.1 mol·L-1的Na2B溶液中,下列粒子浓度关系式正确的是________ 。
A.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
B.c(B2-)+c(HB-)=0.1 mol·L-1
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(OH-)=c(H+)+c(HB-)
Ⅳ、NH4HSO4在分析试剂、医药、电子工业中用途广泛。现向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。
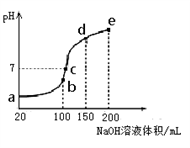
试分析图中a、b、c、d、e五个点。
(1)水的电离程度最大的是__________ (填a、b、c、d,下同)
(2)其溶液中c(OH-)的数值最接近NH3·H2O的电离常数K数值的是____________ ;
Ⅱ、(1)常温下,将某一元酸HA(甲、乙、丙、丁各组中的HA代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
| 实验编号 | HA的物质的量 浓度(mol·L-1) | NaOH的物质的 量浓度(mol·L-1) | 混合后溶液的pH |
| 甲 | 0.10 | 0.10 | pH=a |
| 乙 | 0.12 | 0.10 | pH=7 |
| 丙 | 0.20 | 0.10 | pH>7 |
| 丁 | 0.10 | 0.10 | pH=10 |
(1)从丙组实验结果分析,该混合溶液中离子浓度是由大到小的顺序是
(2)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)=
Ⅲ、某二元酸(分子式用H2B表示)在水中的电离方程是:
H2B=H++HB-
HB-
 H++B2-
H++B2-则在0.1 mol·L-1的Na2B溶液中,下列粒子浓度关系式正确的是
A.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
B.c(B2-)+c(HB-)=0.1 mol·L-1
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(OH-)=c(H+)+c(HB-)
Ⅳ、NH4HSO4在分析试剂、医药、电子工业中用途广泛。现向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。

试分析图中a、b、c、d、e五个点。
(1)水的电离程度最大的是
(2)其溶液中c(OH-)的数值最接近NH3·H2O的电离常数K数值的是
您最近一年使用:0次
解题方法
2 . 锡及其化合物在生产、生活中有着重要的用途。已知:Sn的熔点为231 ℃;Sn2+易水解、易被氧化;SnCl4极易水解、熔点为-33 ℃、沸点为114 ℃。请按要求回答下列相关问题:
(1)元素锡比同主族碳的周期数大3,锡的原子序数为________ 。
(2)用于微电子器件生产的锡粉纯度测定:
①取1.19 g试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;
②加入过量的Fe2(SO4)3;
③用0.1 000 mol/L K2Cr2O7溶液滴定(产物中Cr呈+3价),消耗20.00 mL。步骤②中加入Fe2(SO4)3的作用是__________________ ;此锡粉样品中锡的质量分数:____________ 。
(3)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如下:
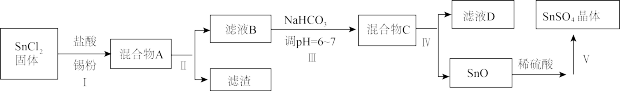
①步骤Ⅰ加入Sn粉的作用:____________________ 及调节溶液pH。
②步骤Ⅱ用到的玻璃仪器有烧杯、________________________ 。
③步骤Ⅲ生成SnO的离子方程式:__________________________ 。
④步骤Ⅳ中检验SnO是否洗涤干净的操作是___________________ ,证明已洗净。
⑤步骤Ⅴ操作依次为___________________ 、过滤、洗涤、低温干燥。
(4)SnCl4蒸气遇氨及水汽呈浓烟状,因而可制作烟幕弹,其反应的化学方程式为:_____________ 。实验室欲用下图装置制备少量SnCl4(夹持装置略),该装置存在明显缺陷,改进方法是_______________
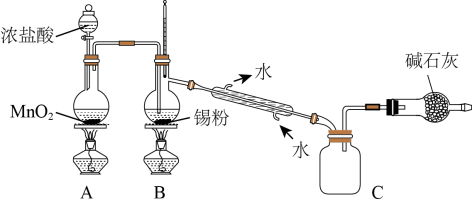
(5)利用改进后的装置进行实验,当开始装置C中收集到有SnCl4时即可熄灭B处酒精灯,反应仍可持续进行的理由是______________________ 。
(1)元素锡比同主族碳的周期数大3,锡的原子序数为
(2)用于微电子器件生产的锡粉纯度测定:
①取1.19 g试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;
②加入过量的Fe2(SO4)3;
③用0.1 000 mol/L K2Cr2O7溶液滴定(产物中Cr呈+3价),消耗20.00 mL。步骤②中加入Fe2(SO4)3的作用是
(3)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如下:
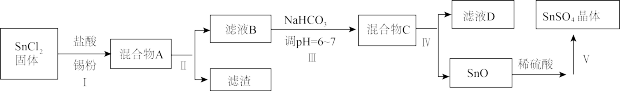
①步骤Ⅰ加入Sn粉的作用:
②步骤Ⅱ用到的玻璃仪器有烧杯、
③步骤Ⅲ生成SnO的离子方程式:
④步骤Ⅳ中检验SnO是否洗涤干净的操作是
⑤步骤Ⅴ操作依次为
(4)SnCl4蒸气遇氨及水汽呈浓烟状,因而可制作烟幕弹,其反应的化学方程式为:

(5)利用改进后的装置进行实验,当开始装置C中收集到有SnCl4时即可熄灭B处酒精灯,反应仍可持续进行的理由是
您最近一年使用:0次
2016-12-09更新
|
255次组卷
|
4卷引用:2015-2016学年湖南省衡阳八中高一下第一次月考化学试卷



