Ⅰ、25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,此时溶液中C(H+)/C(NH4+)____ (填“增大”“减小”“不变”)
Ⅱ、(1)常温下,将某一元酸HA(甲、乙、丙、丁各组中的HA代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
(1)从丙组实验结果分析,该混合溶液中离子浓度是由大到小的顺序是_______________ 。
(2)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)=________ mol·L-1。
Ⅲ、某二元酸(分子式用H2B表示)在水中的电离方程是:
H2B=H++HB-
HB- H++B2-
H++B2-
则在0.1 mol·L-1的Na2B溶液中,下列粒子浓度关系式正确的是________ 。
A.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
B.c(B2-)+c(HB-)=0.1 mol·L-1
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(OH-)=c(H+)+c(HB-)
Ⅳ、NH4HSO4在分析试剂、医药、电子工业中用途广泛。现向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。
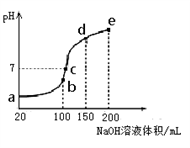
试分析图中a、b、c、d、e五个点。
(1)水的电离程度最大的是__________ (填a、b、c、d,下同)
(2)其溶液中c(OH-)的数值最接近NH3·H2O的电离常数K数值的是____________ ;
Ⅱ、(1)常温下,将某一元酸HA(甲、乙、丙、丁各组中的HA代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
| 实验编号 | HA的物质的量 浓度(mol·L-1) | NaOH的物质的 量浓度(mol·L-1) | 混合后溶液的pH |
| 甲 | 0.10 | 0.10 | pH=a |
| 乙 | 0.12 | 0.10 | pH=7 |
| 丙 | 0.20 | 0.10 | pH>7 |
| 丁 | 0.10 | 0.10 | pH=10 |
(1)从丙组实验结果分析,该混合溶液中离子浓度是由大到小的顺序是
(2)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)=
Ⅲ、某二元酸(分子式用H2B表示)在水中的电离方程是:
H2B=H++HB-
HB-
 H++B2-
H++B2-则在0.1 mol·L-1的Na2B溶液中,下列粒子浓度关系式正确的是
A.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
B.c(B2-)+c(HB-)=0.1 mol·L-1
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(OH-)=c(H+)+c(HB-)
Ⅳ、NH4HSO4在分析试剂、医药、电子工业中用途广泛。现向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。

试分析图中a、b、c、d、e五个点。
(1)水的电离程度最大的是
(2)其溶液中c(OH-)的数值最接近NH3·H2O的电离常数K数值的是
更新时间:2017-06-30 08:04:57
|
相似题推荐
解答题-实验探究题
|
较难
(0.4)
名校
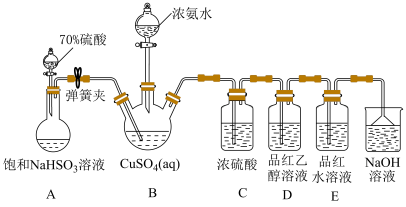
【推荐1】NH4CuSO3(亚硫酸亚铜铵)是一种白色难溶于水、难溶于酒精的化工产品。某小组设计如下实验装置制备NH4CuSO3并探究SO2的漂白性。
ⅱ.然后向三颈烧瓶中通入SO2直至不再产生白色沉淀;
ⅲ.反应完毕后,将装置B中混合物过滤、酒精洗涤、干燥,即得成品。
已知:实验中还观察到装置D中溶液无明显现象,装置E中溶液红色褪去。
请回答下列问题:
(1)检查装置A气密性的操作方法为_____ 。
(2)装置C的目的是_____ 。
(3)实验步骤ⅱ中生成白色沉淀的离子方程式为_____ 。
(4)实验步骤ⅲ中用酒精替代水洗涤的优点是_____ 。
(5)为探究装置D、E中实验现象,化学兴趣小组对装置E中品红褪色的原因猜想如下:
猜想ⅰ:甲同学认为使品红褪色的微粒主要是 ;
;
猜想ⅱ:乙同学认为使品红褪色的微粒主要是 ;。
;。
为了验证猜想ⅰ和ⅱ,进行以下实验:
将10mL品红水溶液分成两份,在两份溶液中分别加入0.1mol·L-1的_____ 溶液(填化学式,下同)和0.1mol·L-1_____ 溶液,发现前者褪色快,后者褪色慢,说明上述猜想i比ⅱ合理。
(6)测定产品中 的含量:称取0.4200g样品,加入足量的NaOH浓溶液,充分加热,生成的气体用20.00mL0.1000mol·L-1H2SO4溶液全部吸收,用0.0900mol·L-1标准NaOH溶液滴定过量的H2SO4,消耗NaOH溶液22.00mL,则样品中NH4CuSO3的质量分数是
的含量:称取0.4200g样品,加入足量的NaOH浓溶液,充分加热,生成的气体用20.00mL0.1000mol·L-1H2SO4溶液全部吸收,用0.0900mol·L-1标准NaOH溶液滴定过量的H2SO4,消耗NaOH溶液22.00mL,则样品中NH4CuSO3的质量分数是_____ %(结果保留三位有效数字)。下列操作使测得的NH4CuSO3质量分数偏大的为_____ (填字母)。
a.滴定前仰视滴定管读数,滴定后读数正确
b.NaOH标准溶液使用前敞口放置于空气中一段时间
c.滴定结束读数时,发现滴定管尖嘴处还悬有一滴标准氢氧化钠溶液
d.用H2SO4溶液吸收NH3操作缓慢,导致部分NH3外逸到空气中
ⅱ.然后向三颈烧瓶中通入SO2直至不再产生白色沉淀;
ⅲ.反应完毕后,将装置B中混合物过滤、酒精洗涤、干燥,即得成品。
已知:实验中还观察到装置D中溶液无明显现象,装置E中溶液红色褪去。
请回答下列问题:
(1)检查装置A气密性的操作方法为
(2)装置C的目的是
(3)实验步骤ⅱ中生成白色沉淀的离子方程式为
(4)实验步骤ⅲ中用酒精替代水洗涤的优点是
(5)为探究装置D、E中实验现象,化学兴趣小组对装置E中品红褪色的原因猜想如下:
猜想ⅰ:甲同学认为使品红褪色的微粒主要是
 ;
;猜想ⅱ:乙同学认为使品红褪色的微粒主要是
 ;。
;。为了验证猜想ⅰ和ⅱ,进行以下实验:
将10mL品红水溶液分成两份,在两份溶液中分别加入0.1mol·L-1的
(6)测定产品中
 的含量:称取0.4200g样品,加入足量的NaOH浓溶液,充分加热,生成的气体用20.00mL0.1000mol·L-1H2SO4溶液全部吸收,用0.0900mol·L-1标准NaOH溶液滴定过量的H2SO4,消耗NaOH溶液22.00mL,则样品中NH4CuSO3的质量分数是
的含量:称取0.4200g样品,加入足量的NaOH浓溶液,充分加热,生成的气体用20.00mL0.1000mol·L-1H2SO4溶液全部吸收,用0.0900mol·L-1标准NaOH溶液滴定过量的H2SO4,消耗NaOH溶液22.00mL,则样品中NH4CuSO3的质量分数是a.滴定前仰视滴定管读数,滴定后读数正确
b.NaOH标准溶液使用前敞口放置于空气中一段时间
c.滴定结束读数时,发现滴定管尖嘴处还悬有一滴标准氢氧化钠溶液
d.用H2SO4溶液吸收NH3操作缓慢,导致部分NH3外逸到空气中
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐2】铬是是钢铁(主要成分是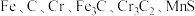 等)中可缺少的元素,提高钢的机械性和耐磨性,测定钢铁中铬含量的流程如图所示,请回答以下问题。
等)中可缺少的元素,提高钢的机械性和耐磨性,测定钢铁中铬含量的流程如图所示,请回答以下问题。

已知:①磷酸与三价铁可以生成无色稳定的络合物。
②加入浓硝酸的目的是将样品钢中的碳化物充分溶解。
③过硫酸铵具有强氧化性,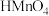 显紫红色,还原性
显紫红色,还原性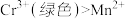 。
。
(1)不直接用浓硝酸溶解样品钢的原因是___________ ,酸浸后产生的气体1为___________ 。
(2)在酸浸时发生下列反应,请填上产物并配平:___________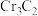 +___________
+___________ →___________
→___________ +___________C+___________,
+___________C+___________,___________
(3)加入过硫酸铵溶液时,一定要加到溶液1变成紫红色,原因是___________ 。
(4)在紫红色溶液中加入NaCl,除去 后,控制溶液的pH为3~4,使氯化钠只与高锰酸反应,请写出该反应的离子方程式
后,控制溶液的pH为3~4,使氯化钠只与高锰酸反应,请写出该反应的离子方程式___________ 。
(5)在用 滴定浅黄色溶液2时,需要加入铬钒指示剂,铬钒指示剂在氧化性试液中显紫红色,在还原性试液中显无色,则滴定终点时溶液3的颜色是
滴定浅黄色溶液2时,需要加入铬钒指示剂,铬钒指示剂在氧化性试液中显紫红色,在还原性试液中显无色,则滴定终点时溶液3的颜色是___________ 。
(6)取0.5000g样品钢于250mL锥形瓶中,加入硫酸与磷酸的混合酸30mL,滴加浓硝酸,加入0.05 过硫酸铵溶液和硝酸银,充分反应后煮沸,将多余的过硫酸铵完全分解,加入NaCl,调节pH为3~4,充分搅拌后,冷却至室温,加入3滴铬钒指示剂,用
过硫酸铵溶液和硝酸银,充分反应后煮沸,将多余的过硫酸铵完全分解,加入NaCl,调节pH为3~4,充分搅拌后,冷却至室温,加入3滴铬钒指示剂,用 滴定,滴定终点时消耗
滴定,滴定终点时消耗 的体积如下:
的体积如下:
则样品钢中Cr的质量分数为___________ %(结果保留四位有效数字)。
(7)如果滴定前,不加入NaCl,测得结果会___________ (填“偏低”“偏高”或“不影响”)。
 等)中可缺少的元素,提高钢的机械性和耐磨性,测定钢铁中铬含量的流程如图所示,请回答以下问题。
等)中可缺少的元素,提高钢的机械性和耐磨性,测定钢铁中铬含量的流程如图所示,请回答以下问题。
已知:①磷酸与三价铁可以生成无色稳定的络合物。
②加入浓硝酸的目的是将样品钢中的碳化物充分溶解。
③过硫酸铵具有强氧化性,
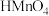 显紫红色,还原性
显紫红色,还原性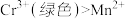 。
。(1)不直接用浓硝酸溶解样品钢的原因是
(2)在酸浸时发生下列反应,请填上产物并配平:___________
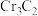 +___________
+___________ →___________
→___________ +___________C+___________,
+___________C+___________,(3)加入过硫酸铵溶液时,一定要加到溶液1变成紫红色,原因是
(4)在紫红色溶液中加入NaCl,除去
 后,控制溶液的pH为3~4,使氯化钠只与高锰酸反应,请写出该反应的离子方程式
后,控制溶液的pH为3~4,使氯化钠只与高锰酸反应,请写出该反应的离子方程式(5)在用
 滴定浅黄色溶液2时,需要加入铬钒指示剂,铬钒指示剂在氧化性试液中显紫红色,在还原性试液中显无色,则滴定终点时溶液3的颜色是
滴定浅黄色溶液2时,需要加入铬钒指示剂,铬钒指示剂在氧化性试液中显紫红色,在还原性试液中显无色,则滴定终点时溶液3的颜色是(6)取0.5000g样品钢于250mL锥形瓶中,加入硫酸与磷酸的混合酸30mL,滴加浓硝酸,加入0.05
 过硫酸铵溶液和硝酸银,充分反应后煮沸,将多余的过硫酸铵完全分解,加入NaCl,调节pH为3~4,充分搅拌后,冷却至室温,加入3滴铬钒指示剂,用
过硫酸铵溶液和硝酸银,充分反应后煮沸,将多余的过硫酸铵完全分解,加入NaCl,调节pH为3~4,充分搅拌后,冷却至室温,加入3滴铬钒指示剂,用 滴定,滴定终点时消耗
滴定,滴定终点时消耗 的体积如下:
的体积如下:| 开始读数(mL) | 结束读数(mL) | |
| 第一次 | 2.00 | 7.62 |
| 第二次 | 0.00 | 5.42 |
| 第三次 | 2.00 | 7.60 |
则样品钢中Cr的质量分数为
(7)如果滴定前,不加入NaCl,测得结果会
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐3】某学生用0.1000mol/L的盐酸来测定未知物质的量浓度的NaOH溶液,选择酚酞指示剂。请填写下列空白:
(1)实验室配置100mL 0.1000mol/L盐酸需用到的仪器有烧杯、玻璃棒、量筒、胶头滴管、______ 。
(2)该滴定实验中,左手握住酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视________ 。
(3)判断到达滴定终点的现象是当最后一滴盐酸滴入时,溶液由浅红色变为无色,且___ s内不变色。
(4)下列操作中可能使所测NaOH溶液的浓度数值偏低的是_________ 。(填字母)
A.酸式滴定管未用标准盐酸润洗
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时平视
(5)该学生根据3次实验分别记录有关数据如下表:
则本次实验中,NaOH溶液的物质的量浓度为______________ mol/L。
(1)实验室配置100mL 0.1000mol/L盐酸需用到的仪器有烧杯、玻璃棒、量筒、胶头滴管、
(2)该滴定实验中,左手握住酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视
(3)判断到达滴定终点的现象是当最后一滴盐酸滴入时,溶液由浅红色变为无色,且
(4)下列操作中可能使所测NaOH溶液的浓度数值偏低的是
A.酸式滴定管未用标准盐酸润洗
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时平视
(5)该学生根据3次实验分别记录有关数据如下表:
滴定次数 | 待测NaOH溶液的体积/mL | 0.1000mol/L盐酸的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
第一次 | 25.00 | 0.08 | 26.10 |
第二次 | 25.00 | 0.65 | 26.65 |
第三次 | 25.00 | 0.39 | 26.37 |
您最近一年使用:0次
【推荐1】Ⅰ.双极膜(BP)是一种能将水分子解离为 和
和 的特殊离子交换膜。应用双极膜制取聚合硫酸铁净水剂
的特殊离子交换膜。应用双极膜制取聚合硫酸铁净水剂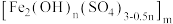 (简称PFS)的电化学装置如图所示。
(简称PFS)的电化学装置如图所示。
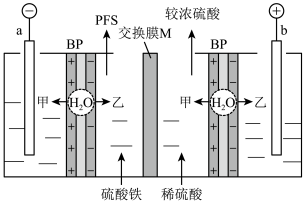
回答下列问题:
(1)图中装置的能量转化形式为_______ ,a、b均为石墨电极,b极的电极反应式为_______ 。
(2)M为_______ (填“阴离子”或“阳离子”)交换膜,图中甲是_______ (填“ ”或“
”或“ ”)
”)
(3)电流过大,会使PFS产品的纯度降低,原因可能是_______ 。
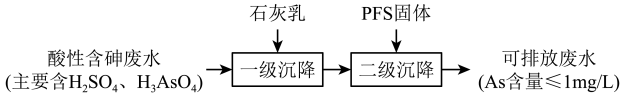
Ⅱ.某化工厂用石灰乳—PFS法处理含砷废水的工艺流程如图所示:
已知:
a.常温下,难溶物 、
、 的
的 均大于
均大于 的
的 ,
, 可溶;
可溶;
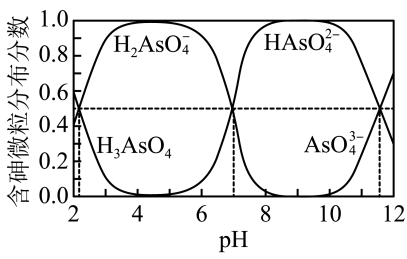
b.常温下,溶液中含砷微粒的分布分数与pH的关系如图。
回答下列问题:
(4)下列说法错误的是_______ (填序号)。
a.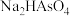 溶液的
溶液的
b. 的
的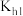 为
为
c. 溶液中,
溶液中,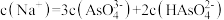
(5)“一级沉降”中,石灰乳的作用是_______ 。
(6)“二级沉降”中,溶液的pH在8~10之间,PFS形成的 胶体粒子可以通过沉淀反应进一步减少溶液中的As含量。该沉淀反应的离子方程式为
胶体粒子可以通过沉淀反应进一步减少溶液中的As含量。该沉淀反应的离子方程式为_______ 。
 和
和 的特殊离子交换膜。应用双极膜制取聚合硫酸铁净水剂
的特殊离子交换膜。应用双极膜制取聚合硫酸铁净水剂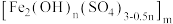 (简称PFS)的电化学装置如图所示。
(简称PFS)的电化学装置如图所示。
回答下列问题:
(1)图中装置的能量转化形式为
(2)M为
 ”或“
”或“ ”)
”)(3)电流过大,会使PFS产品的纯度降低,原因可能是
Ⅱ.某化工厂用石灰乳—PFS法处理含砷废水的工艺流程如图所示:

已知:
a.常温下,难溶物
 、
、 的
的 均大于
均大于 的
的 ,
, 可溶;
可溶;b.常温下,溶液中含砷微粒的分布分数与pH的关系如图。

回答下列问题:
(4)下列说法错误的是
a.
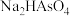 溶液的
溶液的
b.
 的
的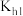 为
为
c.
 溶液中,
溶液中,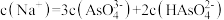
(5)“一级沉降”中,石灰乳的作用是
(6)“二级沉降”中,溶液的pH在8~10之间,PFS形成的
 胶体粒子可以通过沉淀反应进一步减少溶液中的As含量。该沉淀反应的离子方程式为
胶体粒子可以通过沉淀反应进一步减少溶液中的As含量。该沉淀反应的离子方程式为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】(一)完成下列问题
(1)在2L密闭容器中进行如下反应: ,在2s内用X表示的平均反应速率是
,在2s内用X表示的平均反应速率是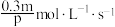 ,则2s时W增加的物质的量是_______
,则2s时W增加的物质的量是_______
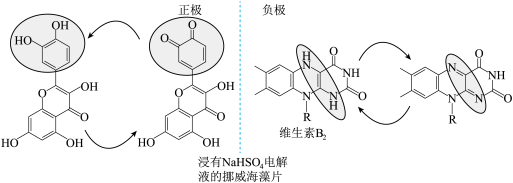
(2)科学家从天然产物中筛选物质开发出了一款完全可食用、可充电的电池。维生素 为负极,从水果皮中提取的槲皮素为正极,
为负极,从水果皮中提取的槲皮素为正极, 水溶液为电解质溶液,如图所示。电池的性能测试显示电压为0.6~0.8V,水电解所需最低电压为1.23V。下列说法错误的是_________
水溶液为电解质溶液,如图所示。电池的性能测试显示电压为0.6~0.8V,水电解所需最低电压为1.23V。下列说法错误的是_________
(3)一定温度下,在体积可变的反应器中充入足量的黄钠铁矾[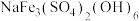 ],发生反应:
],发生反应: ,达到平衡时压强为
,达到平衡时压强为 ,保持温度不变,将体积变为原来的一半,平衡时测得压强为p。判断
,保持温度不变,将体积变为原来的一半,平衡时测得压强为p。判断 与p的关系,并说明理由
与p的关系,并说明理由___________
___________
(4)以酚酞为指示剂,用0.1000 的NaOH溶液滴定20.00mL未知浓度的二元酸
的NaOH溶液滴定20.00mL未知浓度的二元酸 溶液。溶液中,pH、分布系数
溶液。溶液中,pH、分布系数 随滴加NaOH溶液体积VNaOH的变化关系如下图所示。
随滴加NaOH溶液体积VNaOH的变化关系如下图所示。
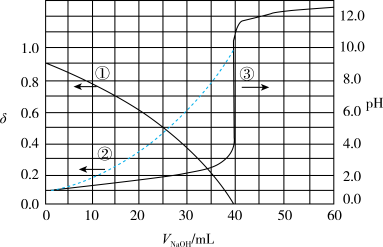
[比如 的分布系数:
的分布系数: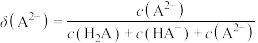 ]知:常温下
]知:常温下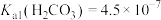 ,
,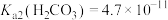 。
。
下列叙述正确的是______
(二)神舟十五号顺利发射升空,标志着我国航天事业的飞速发展。
Ⅰ.火箭推进剂的研究是航天工业中的重要课题,常见推进剂的燃料包括汽油液肼( )、液氢等,具有不同的推进效能。回答下列问题:
)、液氢等,具有不同的推进效能。回答下列问题:
(5)火箭推进剂可用 作燃料,
作燃料, 作氧化剂,反应的热化学方程式可表示为
作氧化剂,反应的热化学方程式可表示为

 。相关物质的摩尔生成焓
。相关物质的摩尔生成焓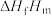 如下表所示。
如下表所示。
注:一定温度下,由元素的最稳定单质生成1mol纯物质的热效应称为该物质的摩尔生成焓,用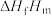 表示。如
表示。如 (l)的摩尔生成焓:
(l)的摩尔生成焓: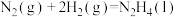
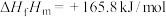
①
___________ kJ/mol。
②结合化学反应原理分析, (l)作推近剂燃料可与
(l)作推近剂燃料可与 (g)自发进行反应的原因是
(g)自发进行反应的原因是___________
___________ 。
(6)火箭推进器内氨氧燃烧的简化反应历程如下图所示,分析其反应机理。
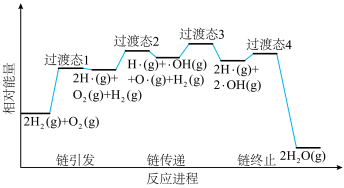
该历程分___________ 步进行,其中氢氧燃烧决速步对应的反应方程式为___________ 。
Ⅱ.利用“一碳化学”技术可有效实现工业制氢,为推进剂提供了丰富的氢燃料,该工业制氢方法主要涉及以下两个反应:
a:
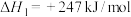
b:
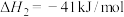
已知为反应的标准压强平衡常数,其表达方法为:在浓度平衡常数表达式中,用各组分气体平衡时的相对分压代替浓度;气体的相对分压等于其分压(单位为kPa)除以标准压力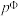 (
(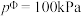 )。反应a、b的ln随
)。反应a、b的ln随 (T为温度)的变化如图所示。
(T为温度)的变化如图所示。
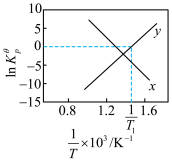
(7)①能表示反应b的曲线为___________ ,反应a的标准压强平衡常数表达式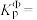
___________ 。
②维持 温度下,往恒容密闭容器中通入等量
温度下,往恒容密闭容器中通入等量 、
、 、
、 混合气体发生反应a、b,初始压强为120kPa,达平衡时体系压强为140kPa.该温度下
混合气体发生反应a、b,初始压强为120kPa,达平衡时体系压强为140kPa.该温度下 的平衡转化率为
的平衡转化率为___________ , 的平衡分压为(结果保留3位有效数字)
的平衡分压为(结果保留3位有效数字)___________ kPa。
Ⅲ.电解法在物质制备中具有巨大的研究价值,可广泛用于化工生产。
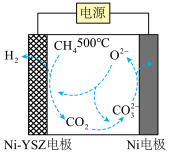
(8)我国科学家报道了一种在500℃下电解甲烷制氢的方法,反应原理如下图所示,请写出Ni电极上的电极反应式:___________ 。
(1)在2L密闭容器中进行如下反应:
 ,在2s内用X表示的平均反应速率是
,在2s内用X表示的平均反应速率是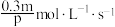 ,则2s时W增加的物质的量是_______
,则2s时W增加的物质的量是_______A.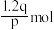 | B. | C.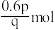 | D.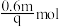 |
(2)科学家从天然产物中筛选物质开发出了一款完全可食用、可充电的电池。维生素
 为负极,从水果皮中提取的槲皮素为正极,
为负极,从水果皮中提取的槲皮素为正极, 水溶液为电解质溶液,如图所示。电池的性能测试显示电压为0.6~0.8V,水电解所需最低电压为1.23V。下列说法错误的是_________
水溶液为电解质溶液,如图所示。电池的性能测试显示电压为0.6~0.8V,水电解所需最低电压为1.23V。下列说法错误的是_________
A.放电过程中海藻片中 向维生素 向维生素 电极迁移 电极迁移 |
B.放电时负极反应: -2e- -2e-  +2H+ +2H+ |
C.充电时总反应: + + → →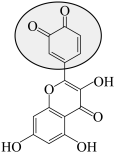 + +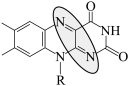 |
| D.该电池即使儿童误食也不会导致体内水电解而损害身体 |
(3)一定温度下,在体积可变的反应器中充入足量的黄钠铁矾[
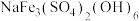 ],发生反应:
],发生反应: ,达到平衡时压强为
,达到平衡时压强为 ,保持温度不变,将体积变为原来的一半,平衡时测得压强为p。判断
,保持温度不变,将体积变为原来的一半,平衡时测得压强为p。判断 与p的关系,并说明理由
与p的关系,并说明理由(4)以酚酞为指示剂,用0.1000
 的NaOH溶液滴定20.00mL未知浓度的二元酸
的NaOH溶液滴定20.00mL未知浓度的二元酸 溶液。溶液中,pH、分布系数
溶液。溶液中,pH、分布系数 随滴加NaOH溶液体积VNaOH的变化关系如下图所示。
随滴加NaOH溶液体积VNaOH的变化关系如下图所示。
[比如
 的分布系数:
的分布系数: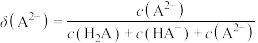 ]知:常温下
]知:常温下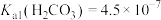 ,
,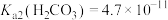 。
。下列叙述正确的是______
A.曲线①代表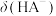 , ,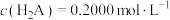 |
B. 的电离常数 的电离常数 |
C.滴定过程,pH=2时溶液中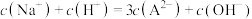 |
D.向 溶液中加入少量 溶液中加入少量 溶液,发生离子反应: 溶液,发生离子反应: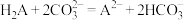 |
(二)神舟十五号顺利发射升空,标志着我国航天事业的飞速发展。
Ⅰ.火箭推进剂的研究是航天工业中的重要课题,常见推进剂的燃料包括汽油液肼(
 )、液氢等,具有不同的推进效能。回答下列问题:
)、液氢等,具有不同的推进效能。回答下列问题:(5)火箭推进剂可用
 作燃料,
作燃料, 作氧化剂,反应的热化学方程式可表示为
作氧化剂,反应的热化学方程式可表示为

 。相关物质的摩尔生成焓
。相关物质的摩尔生成焓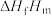 如下表所示。
如下表所示。| 物质 |  (g) (g) |  (l) (l) |  (g) (g) |
摩尔生成焓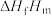 (kJ/mol) (kJ/mol) | +10.8 | +165.8 | -242.0 |
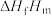 表示。如
表示。如 (l)的摩尔生成焓:
(l)的摩尔生成焓: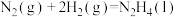
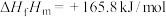
①

②结合化学反应原理分析,
 (l)作推近剂燃料可与
(l)作推近剂燃料可与 (g)自发进行反应的原因是
(g)自发进行反应的原因是(6)火箭推进器内氨氧燃烧的简化反应历程如下图所示,分析其反应机理。

该历程分
Ⅱ.利用“一碳化学”技术可有效实现工业制氢,为推进剂提供了丰富的氢燃料,该工业制氢方法主要涉及以下两个反应:
a:

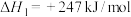
b:

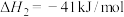
已知为反应的标准压强平衡常数,其表达方法为:在浓度平衡常数表达式中,用各组分气体平衡时的相对分压代替浓度;气体的相对分压等于其分压(单位为kPa)除以标准压力
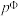 (
(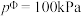 )。反应a、b的ln随
)。反应a、b的ln随 (T为温度)的变化如图所示。
(T为温度)的变化如图所示。
(7)①能表示反应b的曲线为
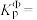
②维持
 温度下,往恒容密闭容器中通入等量
温度下,往恒容密闭容器中通入等量 、
、 、
、 混合气体发生反应a、b,初始压强为120kPa,达平衡时体系压强为140kPa.该温度下
混合气体发生反应a、b,初始压强为120kPa,达平衡时体系压强为140kPa.该温度下 的平衡转化率为
的平衡转化率为 的平衡分压为(结果保留3位有效数字)
的平衡分压为(结果保留3位有效数字)Ⅲ.电解法在物质制备中具有巨大的研究价值,可广泛用于化工生产。
(8)我国科学家报道了一种在500℃下电解甲烷制氢的方法,反应原理如下图所示,请写出Ni电极上的电极反应式:

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】回答下列问题:
(1)某二元酸(分子式用 表示)在水中的电离方程式是:
表示)在水中的电离方程式是: ;HB-
;HB- H+B2-在0.1
H+B2-在0.1 的
的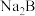 溶液中,下列粒子浓度关系式正确的是___________。
溶液中,下列粒子浓度关系式正确的是___________。
(2)亚磷酸( )是具有强还原性的二元弱酸。某温度下,0.10
)是具有强还原性的二元弱酸。某温度下,0.10 的
的 溶液中
溶液中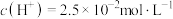 ,则第一步电离平衡常数
,则第一步电离平衡常数
___________ ( 第二步电离忽略不计,列出精确计算式);向此
第二步电离忽略不计,列出精确计算式);向此 溶液中滴加NaOH溶液至中性,所得溶液中:
溶液中滴加NaOH溶液至中性,所得溶液中:
___________ 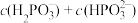 (填“>”、“<”或“=”,下同);在
(填“>”、“<”或“=”,下同);在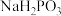 溶液中,
溶液中,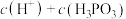
___________ 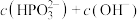 。
。
(3)25℃时,在20mL 0.1 氢氟酸中加入V mL 0.1
氢氟酸中加入V mL 0.1 NaOH溶液,测得混合溶液pH的变化曲线如图所示,下列说法正确的是___________。
NaOH溶液,测得混合溶液pH的变化曲线如图所示,下列说法正确的是___________。

(4)25℃时, 和
和 水溶液中所有含砷的物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如图-1和图-2所示:
水溶液中所有含砷的物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如图-1和图-2所示:

①以酚酞为指示剂(变色范围pH8.2∼10.0),将NaOH溶液逐滴加入到 溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为
溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为___________ ;
② 第二步电离的电离常数为
第二步电离的电离常数为 ,则
,则
___________ ( )。
)。
(1)某二元酸(分子式用
 表示)在水中的电离方程式是:
表示)在水中的电离方程式是: ;HB-
;HB- H+B2-在0.1
H+B2-在0.1 的
的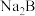 溶液中,下列粒子浓度关系式正确的是___________。
溶液中,下列粒子浓度关系式正确的是___________。A. | B.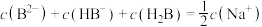 |
C. | D.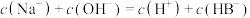 |
(2)亚磷酸(
 )是具有强还原性的二元弱酸。某温度下,0.10
)是具有强还原性的二元弱酸。某温度下,0.10 的
的 溶液中
溶液中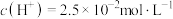 ,则第一步电离平衡常数
,则第一步电离平衡常数
 第二步电离忽略不计,列出精确计算式);向此
第二步电离忽略不计,列出精确计算式);向此 溶液中滴加NaOH溶液至中性,所得溶液中:
溶液中滴加NaOH溶液至中性,所得溶液中:
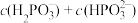 (填“>”、“<”或“=”,下同);在
(填“>”、“<”或“=”,下同);在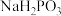 溶液中,
溶液中,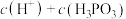
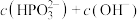 。
。(3)25℃时,在20mL 0.1
 氢氟酸中加入V mL 0.1
氢氟酸中加入V mL 0.1 NaOH溶液,测得混合溶液pH的变化曲线如图所示,下列说法正确的是___________。
NaOH溶液,测得混合溶液pH的变化曲线如图所示,下列说法正确的是___________。
A.pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的 相等 相等 |
B.①点时pH=6,此时溶液中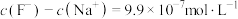 |
| C.②点时,溶液中的c(F-)=c(Na+)=0.05mol/L |
D.③点时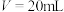 ,此时溶液中c(OH-)<c(H+)<c(F-)<c(Na+)=0.05mol/L ,此时溶液中c(OH-)<c(H+)<c(F-)<c(Na+)=0.05mol/L |
(4)25℃时,
 和
和 水溶液中所有含砷的物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如图-1和图-2所示:
水溶液中所有含砷的物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如图-1和图-2所示:
①以酚酞为指示剂(变色范围pH8.2∼10.0),将NaOH溶液逐滴加入到
 溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为
溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为②
 第二步电离的电离常数为
第二步电离的电离常数为 ,则
,则
 )。
)。
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】铵盐是比较重要的盐类物质,请回答下列问题。
(1)草酸是二元弱酸,能形成两种铵盐。
①(NH4)2C2O4溶液呈酸性,溶液中HC2O 、 C2O
、 C2O 、NH
、NH 、H2C2O4、 H+五种粒子浓度由大到小的顺序为
、H2C2O4、 H+五种粒子浓度由大到小的顺序为_______ 。
②NH4HC2O4溶液中,c(H2C2O4)-c(C2O )=
)=_______ 。
(2)氯化铵是最常见的铵盐,在工业生产中用途广泛。
①常温下,向100 mL 0.2 mol·L-1的氨水中逐滴加入0.2 mol·L-1的盐酸,所得溶液的pH、溶液中NH 和NH3·H2O的物质的量分数与加入盐酸的体积的关系如图所示。
和NH3·H2O的物质的量分数与加入盐酸的体积的关系如图所示。
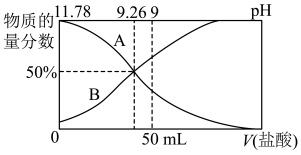
a.表示NH3·H2O物质的量分数变化的曲线是_______ (填“A”或“B”)。
b.NH3·H2O的电离常数为_______ 。
c.当加入盐酸的体积为50 mL时,溶液中c(NH )-c(NH3·H2O)=
)-c(NH3·H2O)=_______ mol·L-1(用式子表示)。
②常温下,在20 mL a mol·L-1氨水中滴加20 mL b mol·L-1盐酸恰好使溶液呈中性。常温下,NH 的水解常数Kh=
的水解常数Kh=_______ (用含a、b的代数式表示)。
(1)草酸是二元弱酸,能形成两种铵盐。
①(NH4)2C2O4溶液呈酸性,溶液中HC2O
 、 C2O
、 C2O 、NH
、NH 、H2C2O4、 H+五种粒子浓度由大到小的顺序为
、H2C2O4、 H+五种粒子浓度由大到小的顺序为②NH4HC2O4溶液中,c(H2C2O4)-c(C2O
 )=
)=(2)氯化铵是最常见的铵盐,在工业生产中用途广泛。
①常温下,向100 mL 0.2 mol·L-1的氨水中逐滴加入0.2 mol·L-1的盐酸,所得溶液的pH、溶液中NH
 和NH3·H2O的物质的量分数与加入盐酸的体积的关系如图所示。
和NH3·H2O的物质的量分数与加入盐酸的体积的关系如图所示。
a.表示NH3·H2O物质的量分数变化的曲线是
b.NH3·H2O的电离常数为
c.当加入盐酸的体积为50 mL时,溶液中c(NH
 )-c(NH3·H2O)=
)-c(NH3·H2O)=②常温下,在20 mL a mol·L-1氨水中滴加20 mL b mol·L-1盐酸恰好使溶液呈中性。常温下,NH
 的水解常数Kh=
的水解常数Kh=
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐2】我国规定:室内甲醛含量不得超过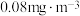 。某研究性学习小组欲利酸性
。某研究性学习小组欲利酸性 溶液测定空气中甲醛的含量,(部分装置如图),其反应原理及步骤如下:
溶液测定空气中甲醛的含量,(部分装置如图),其反应原理及步骤如下:
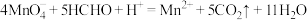

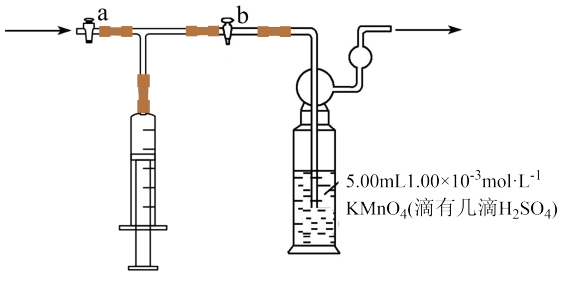
步骤:①量取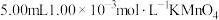 ,溶液于洗气瓶中,并滴入几滴稀
,溶液于洗气瓶中,并滴入几滴稀 ,加水
,加水 稀释备用。
稀释备用。
②取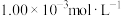 草酸标准溶液于酸式滴定管中备用。
草酸标准溶液于酸式滴定管中备用。
⑧用注射器抽取 新装修室内空气.再将注射器气体推入洗气瓶中充分反应.再重复4次。
新装修室内空气.再将注射器气体推入洗气瓶中充分反应.再重复4次。
④将洗气瓶中溶液转移到锥形瓶中(包括洗涤液),再用标准草酸溶液进行滴定,记录滴定所消耗的草酸溶液的体积。
⑤再重复实验2次(每次取高锰酸钾溶液 )。3次实验消耗草酸溶液的体积平均值为
)。3次实验消耗草酸溶液的体积平均值为 。
。
回答下列问题
(1)此实验用指示剂______ (填字母)。
a.甲基橙 b.酚酞 c.淀粉 d.无需另外添加试剂
(2)量取
 溶液应用
溶液应用_______ 滴定管。
(3)下列操作能引起室内甲醛浓度偏高的是________ 。
a.滴定终点俯视读数
b.滴定前有气泡滴定后无气泡
c.在高锰酸钾溶液中加入少量水
d.装草酸的滴定管未润洗
(4),草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,如果向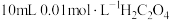 溶液中滴加
溶液中滴加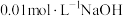 溶液
溶液
①当加入的 溶液体积为
溶液体积为 ,请你写出溶液中质子守恒关系式
,请你写出溶液中质子守恒关系式________ 。
②当加入的 溶液体积为
溶液体积为 ,请你写出溶液中离子的浓度大小关系
,请你写出溶液中离子的浓度大小关系_______ 。
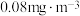 。某研究性学习小组欲利酸性
。某研究性学习小组欲利酸性 溶液测定空气中甲醛的含量,(部分装置如图),其反应原理及步骤如下:
溶液测定空气中甲醛的含量,(部分装置如图),其反应原理及步骤如下: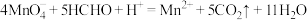


步骤:①量取
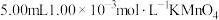 ,溶液于洗气瓶中,并滴入几滴稀
,溶液于洗气瓶中,并滴入几滴稀 ,加水
,加水 稀释备用。
稀释备用。②取
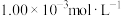 草酸标准溶液于酸式滴定管中备用。
草酸标准溶液于酸式滴定管中备用。⑧用注射器抽取
 新装修室内空气.再将注射器气体推入洗气瓶中充分反应.再重复4次。
新装修室内空气.再将注射器气体推入洗气瓶中充分反应.再重复4次。④将洗气瓶中溶液转移到锥形瓶中(包括洗涤液),再用标准草酸溶液进行滴定,记录滴定所消耗的草酸溶液的体积。
⑤再重复实验2次(每次取高锰酸钾溶液
 )。3次实验消耗草酸溶液的体积平均值为
)。3次实验消耗草酸溶液的体积平均值为 。
。回答下列问题
(1)此实验用指示剂
a.甲基橙 b.酚酞 c.淀粉 d.无需另外添加试剂
(2)量取

 溶液应用
溶液应用(3)下列操作能引起室内甲醛浓度偏高的是
a.滴定终点俯视读数
b.滴定前有气泡滴定后无气泡
c.在高锰酸钾溶液中加入少量水
d.装草酸的滴定管未润洗
(4),草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,如果向
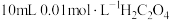 溶液中滴加
溶液中滴加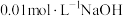 溶液
溶液①当加入的
 溶液体积为
溶液体积为 ,请你写出溶液中质子守恒关系式
,请你写出溶液中质子守恒关系式②当加入的
 溶液体积为
溶液体积为 ,请你写出溶液中离子的浓度大小关系
,请你写出溶液中离子的浓度大小关系
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】请回答下列问题:(25℃时,部分物质的电离平衡常数如表所示)
(1)相同温度下,等pH的CH3COONa溶液、Na2CO3溶液和Na2SO3溶液,三种溶液的物质的量浓度c(CH3COONa)、c(Na2CO3)、c(Na2SO3)由大到小排序为_______ 。
(2)用足量Na2CO3溶液吸收工业尾气中少量SO2气体,发生反应的离子方程式为_______ 。
(3)25℃时,向0.1mol•L-1的氨水中缓缓少量CO2气体的过程中(忽略溶液体积的变化),下列表达式的数值变小的是_______ 。
A. B.
B. C.
C.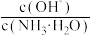 D.
D.
(4)能证明醋酸是弱酸的实验事实是_______ (填写序号)。
①相同条件下,浓度均为0.1mol•L-1的盐酸和醋酸,醋酸的导电能力更弱
②25℃时,一定浓度的CH3COOH、CH3COONa混合溶液的pH等于7
③CH3COOH溶液能与NaHCO3反应生成CO2
④0.1mol•L-1CH3COOH溶液可使紫色石蕊试液变红
(5)向冰醋酸中逐滴加水,溶液导电性随加入水的体积变化如图所示。

①a、b、c三点溶液中CH3COOH的电离程度由大到小的顺序是_______ 。
②a、c两点对应的溶液分别吸收氨气,若两溶液最终pH均为7(25℃时),则a点溶液中的c(CH3COO-)_______ c点溶液中的c( )。(填“<”、“>”或“=”)(已知CH3COONH4溶液呈中性)
)。(填“<”、“>”或“=”)(已知CH3COONH4溶液呈中性)
| 化学式 | CH3COOH | NH3·H2O | H2CO3 | H2SO3 |
| 电离平衡常数 | 1.7×10-5 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.3×10-2 K2=6.3×10-8 |
(2)用足量Na2CO3溶液吸收工业尾气中少量SO2气体,发生反应的离子方程式为
(3)25℃时,向0.1mol•L-1的氨水中缓缓少量CO2气体的过程中(忽略溶液体积的变化),下列表达式的数值变小的是
A.
 B.
B. C.
C.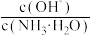 D.
D.
(4)能证明醋酸是弱酸的实验事实是
①相同条件下,浓度均为0.1mol•L-1的盐酸和醋酸,醋酸的导电能力更弱
②25℃时,一定浓度的CH3COOH、CH3COONa混合溶液的pH等于7
③CH3COOH溶液能与NaHCO3反应生成CO2
④0.1mol•L-1CH3COOH溶液可使紫色石蕊试液变红
(5)向冰醋酸中逐滴加水,溶液导电性随加入水的体积变化如图所示。

①a、b、c三点溶液中CH3COOH的电离程度由大到小的顺序是
②a、c两点对应的溶液分别吸收氨气,若两溶液最终pH均为7(25℃时),则a点溶液中的c(CH3COO-)
 )。(填“<”、“>”或“=”)(已知CH3COONH4溶液呈中性)
)。(填“<”、“>”或“=”)(已知CH3COONH4溶液呈中性)
您最近一年使用:0次



