Ⅰ.双极膜(BP)是一种能将水分子解离为 和
和 的特殊离子交换膜。应用双极膜制取聚合硫酸铁净水剂
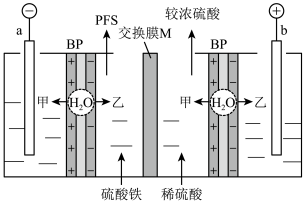
的特殊离子交换膜。应用双极膜制取聚合硫酸铁净水剂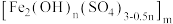 (简称PFS)的电化学装置如图所示。
(简称PFS)的电化学装置如图所示。
回答下列问题:
(1)图中装置的能量转化形式为_______ ,a、b均为石墨电极,b极的电极反应式为_______ 。
(2)M为_______ (填“阴离子”或“阳离子”)交换膜,图中甲是_______ (填“ ”或“
”或“ ”)
”)
(3)电流过大,会使PFS产品的纯度降低,原因可能是_______ 。
Ⅱ.某化工厂用石灰乳—PFS法处理含砷废水的工艺流程如图所示:
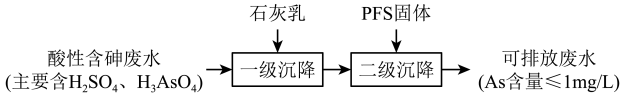
已知:
a.常温下,难溶物 、
、 的
的 均大于
均大于 的
的 ,
, 可溶;
可溶;
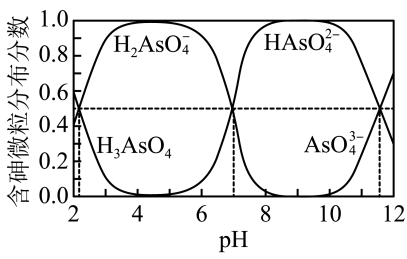
b.常温下,溶液中含砷微粒的分布分数与pH的关系如图。
回答下列问题:
(4)下列说法错误的是_______ (填序号)。
a.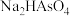 溶液的
溶液的
b. 的
的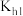 为
为
c. 溶液中,
溶液中,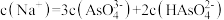
(5)“一级沉降”中,石灰乳的作用是_______ 。
(6)“二级沉降”中,溶液的pH在8~10之间,PFS形成的 胶体粒子可以通过沉淀反应进一步减少溶液中的As含量。该沉淀反应的离子方程式为
胶体粒子可以通过沉淀反应进一步减少溶液中的As含量。该沉淀反应的离子方程式为_______ 。
 和
和 的特殊离子交换膜。应用双极膜制取聚合硫酸铁净水剂
的特殊离子交换膜。应用双极膜制取聚合硫酸铁净水剂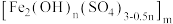 (简称PFS)的电化学装置如图所示。
(简称PFS)的电化学装置如图所示。
回答下列问题:
(1)图中装置的能量转化形式为
(2)M为
 ”或“
”或“ ”)
”)(3)电流过大,会使PFS产品的纯度降低,原因可能是
Ⅱ.某化工厂用石灰乳—PFS法处理含砷废水的工艺流程如图所示:

已知:
a.常温下,难溶物
 、
、 的
的 均大于
均大于 的
的 ,
, 可溶;
可溶;b.常温下,溶液中含砷微粒的分布分数与pH的关系如图。

回答下列问题:
(4)下列说法错误的是
a.
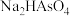 溶液的
溶液的
b.
 的
的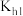 为
为
c.
 溶液中,
溶液中,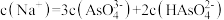
(5)“一级沉降”中,石灰乳的作用是
(6)“二级沉降”中,溶液的pH在8~10之间,PFS形成的
 胶体粒子可以通过沉淀反应进一步减少溶液中的As含量。该沉淀反应的离子方程式为
胶体粒子可以通过沉淀反应进一步减少溶液中的As含量。该沉淀反应的离子方程式为
更新时间:2022-01-17 09:58:48
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
名校
【推荐1】下表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp (25℃)。
回答下列问题(C6H5OH为苯酚):
(1)由上表分析,若①CH3COOH ② ③C6H5OH ④
③C6H5OH ④ 均可看作酸,则它们酸性由强到弱的顺序为
均可看作酸,则它们酸性由强到弱的顺序为___ (填编号);
(2)写出C6H5OH与Na3PO4反应的离子方程式:___ ;
(3)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH3COO-)______ c(  );(填“>”、“=”或“<”)
);(填“>”、“=”或“<”)
(4)25℃时,向10mL 0.01mol/L苯酚溶液中滴加VmL 0.01mol/L氨水,混合溶液中粒子浓度关系正确的是___
A.若混合液pH>7,则V≥10
B.若混合液pH<7,则c( ) >c (C6H5O-) >c (H+)>c (OH-)
) >c (C6H5O-) >c (H+)>c (OH-)
C.V=10时,混合液中水的电离程度小于10mL 0.01mol/L苯酚溶液中水的电离程度
D.V=5时,2c(NH3·H2O)+ 2 c ( )= c (C6H5O-)+ c (C6H5OH)
)= c (C6H5O-)+ c (C6H5OH)
(5)水解反应是典型的可逆反应.水解反应的化学平衡常数称为水解常数(用Kh表示),类比化学平衡常数的定义,请写出Na2CO3第一步水解反应的水解常数的表达式____ 。
(6)如下图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:______ T2(填>、=、<)
② 讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法正确的是______
A.加入Na2SO4可使溶液由a点变为b点
B.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
D.升温可使溶液由b点变为d点
③现有0.2mol的BaSO4沉淀,每次用1L饱和Na2CO3溶液(浓度为1.7mol/L)处理。若使BaSO4中的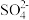 全部转化到溶液中,需要反复处理
全部转化到溶液中,需要反复处理______ 次。
[提示: BaSO4(s)+ (aq)
(aq) BaCO3(s)+
BaCO3(s)+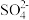 (aq) ]
(aq) ]
| 电解质 | 平衡方程式 | 平衡常数K | Ksp |
| CH3COOH | CH3COOH CH3COO-+H+ CH3COO-+H+ | 1.76×10-5 | |
| H2CO3 | H2CO3 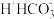  | 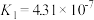 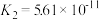 | |
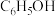 | 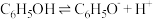 | 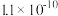 | |
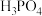 |    | 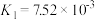 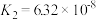 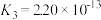 | |
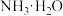 | 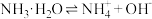 | 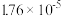 | |
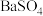 |  | 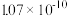 | |
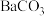 | 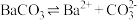 | 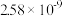 |
(1)由上表分析,若①CH3COOH ②
 ③C6H5OH ④
③C6H5OH ④ 均可看作酸,则它们酸性由强到弱的顺序为
均可看作酸,则它们酸性由强到弱的顺序为(2)写出C6H5OH与Na3PO4反应的离子方程式:
(3)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH3COO-)
 );(填“>”、“=”或“<”)
);(填“>”、“=”或“<”)(4)25℃时,向10mL 0.01mol/L苯酚溶液中滴加VmL 0.01mol/L氨水,混合溶液中粒子浓度关系正确的是
A.若混合液pH>7,则V≥10
B.若混合液pH<7,则c(
 ) >c (C6H5O-) >c (H+)>c (OH-)
) >c (C6H5O-) >c (H+)>c (OH-)C.V=10时,混合液中水的电离程度小于10mL 0.01mol/L苯酚溶液中水的电离程度
D.V=5时,2c(NH3·H2O)+ 2 c (
 )= c (C6H5O-)+ c (C6H5OH)
)= c (C6H5O-)+ c (C6H5OH)(5)水解反应是典型的可逆反应.水解反应的化学平衡常数称为水解常数(用Kh表示),类比化学平衡常数的定义,请写出Na2CO3第一步水解反应的水解常数的表达式
(6)如下图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:

② 讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法正确的是
A.加入Na2SO4可使溶液由a点变为b点
B.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
D.升温可使溶液由b点变为d点
③现有0.2mol的BaSO4沉淀,每次用1L饱和Na2CO3溶液(浓度为1.7mol/L)处理。若使BaSO4中的
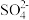 全部转化到溶液中,需要反复处理
全部转化到溶液中,需要反复处理[提示: BaSO4(s)+
 (aq)
(aq) BaCO3(s)+
BaCO3(s)+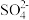 (aq) ]
(aq) ]
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】25℃时,草酸 H2C2O4的 Ka1=5.6×10⁻2, Ka2=1.5×10⁻4,草酸钙 CaC2O4的 Ksp=4.0×10⁻8。回答以下问题:
(1)用标准浓度的草酸滴定未知浓度的 KMnO4溶液,可标定 KMnO4溶液的浓度。判断到达滴定终点的现象为___________ 。
(2)H2C2O4在水中的电离方程式___________ ;
(3)25℃时, NaHC2O4 溶液的 pH___________ 7 ( 选填“ > ”“ <” 或“ = ”), 通过计算说明原因:___________ 。
(4)25℃时,H2CO3的 Ka1=4.4×10⁻7, Ka2=4.7×10⁻11,写出少量草酸和过量碳酸钠溶液反应的离子方程式___________ 。
(5)25℃时,将 1 mL 某浓度的 H2C2O4溶液加水稀释,其溶液 pH 与稀释后溶液体积的关系如图所示。

① 图中能代表 H2C2O4溶液稀释情况的是___________ (选填“A: 曲线 I”或“B: 曲线 II”);
② 稀释过程中,下列量始终增大的是___________ 。
A、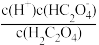 B、
B、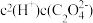 C、
C、 D、
D、
(6)25℃时,向 20 mL 0.1 mol·L-1的 NaHC2O4溶液中缓慢滴加 pH=13 的 NaOH 溶液,混合溶液的温度 T 与滴加 NaOH 溶液体积的关系如下图所示。
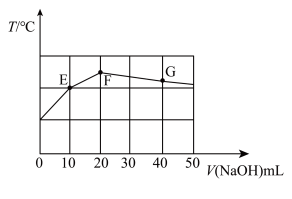
① 图中 E, F, G 三点中,水的电离程度最大的是___________ 点。
② 下列关系式中正确的是___________ 。
A.E 点存在 2c(Na+)=3c(H2C2O4)+3c(HC2O )+3c(C2O
)+3c(C2O )
)
B.F 点存在 c(H+)=c(OH-)+c(HC2O )+c(H2C2O4)
)+c(H2C2O4)
C.G 点存在 c(Na+)>c(OH-)>c(HC2O )>c(C2O
)>c(C2O )
)
(7)草酸钙结石是草酸和高钙食物在人体内形成的一种结石,计算下列反应的平衡常数: H2C2O4(aq)+Ca2+(aq)⇌CaC2O4(s)+2H+(aq),K=___________ 。(算出具体数值)
(1)用标准浓度的草酸滴定未知浓度的 KMnO4溶液,可标定 KMnO4溶液的浓度。判断到达滴定终点的现象为
(2)H2C2O4在水中的电离方程式
(3)25℃时, NaHC2O4 溶液的 pH
(4)25℃时,H2CO3的 Ka1=4.4×10⁻7, Ka2=4.7×10⁻11,写出少量草酸和过量碳酸钠溶液反应的离子方程式
(5)25℃时,将 1 mL 某浓度的 H2C2O4溶液加水稀释,其溶液 pH 与稀释后溶液体积的关系如图所示。

① 图中能代表 H2C2O4溶液稀释情况的是
② 稀释过程中,下列量始终增大的是
A、
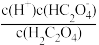 B、
B、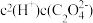 C、
C、 D、
D、
(6)25℃时,向 20 mL 0.1 mol·L-1的 NaHC2O4溶液中缓慢滴加 pH=13 的 NaOH 溶液,混合溶液的温度 T 与滴加 NaOH 溶液体积的关系如下图所示。

① 图中 E, F, G 三点中,水的电离程度最大的是
② 下列关系式中正确的是
A.E 点存在 2c(Na+)=3c(H2C2O4)+3c(HC2O
 )+3c(C2O
)+3c(C2O )
)B.F 点存在 c(H+)=c(OH-)+c(HC2O
 )+c(H2C2O4)
)+c(H2C2O4)C.G 点存在 c(Na+)>c(OH-)>c(HC2O
 )>c(C2O
)>c(C2O )
)(7)草酸钙结石是草酸和高钙食物在人体内形成的一种结石,计算下列反应的平衡常数: H2C2O4(aq)+Ca2+(aq)⇌CaC2O4(s)+2H+(aq),K=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】(1)常温下,某水溶液M中存在的离子有 、
、 、
、 、
、 、
、 ,存在的分子有
,存在的分子有 、
、 ,根据题意回答下列问题。
,根据题意回答下列问题。
①写出酸 的电离方程式:
的电离方程式:________ 。
②若溶液M由 溶液与
溶液与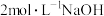 溶液等体积混合而得,则溶液M的
溶液等体积混合而得,则溶液M的
________ 7(填“ ”“
”“ ”或“
”或“ ”),溶液M中各微粒的浓度关系正确的是
”),溶液M中各微粒的浓度关系正确的是________ (填序号)。
A.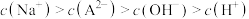
B.
C.
D.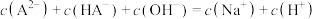
(2) 是温室气体,可用
是温室气体,可用 溶液吸收得到
溶液吸收得到 或
或 。
。
① 俗称纯碱,因
俗称纯碱,因 水解而使其水溶液呈碱性,试写出
水解而使其水溶液呈碱性,试写出 水解的离子方程式(忽略第二步水解):
水解的离子方程式(忽略第二步水解):_______________ ,其水解反应平衡常数(即水解常数)的表达式为
_______________ 。
②已知 时,
时, ,则当溶液中
,则当溶液中 时,溶液的
时,溶液的
________ 。
③ 溶液中
溶液中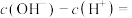
________ [用含 、
、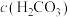 的关系式表示]。
的关系式表示]。
④向 溶液中加入明矾会产生沉淀和气体,请写出相关的离子方程式:
溶液中加入明矾会产生沉淀和气体,请写出相关的离子方程式:________________ 。
(3)实验室可用 溶液吸收
溶液吸收 ,反应为
,反应为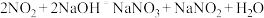 。含
。含 的水溶液与
的水溶液与 恰好完全反应得
恰好完全反应得 溶液A,溶液B为
溶液A,溶液B为 的
的 溶液,则两溶液中
溶液,则两溶液中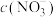 、
、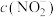 和
和 由大到小的顺序为
由大到小的顺序为________________ (已知 的电离常数
的电离常数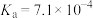 ,
, 的电离常数
的电离常数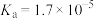 )。可使溶液A和溶液B的
)。可使溶液A和溶液B的 相等的方法是
相等的方法是________ (填序号)。
a.向溶液A中加适量水 b.向溶液A中加适量
c.向溶液B中加适量水 d.向溶液B中加适量
(4)直接排放含 的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的
的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的 。吸收液(
。吸收液( 溶液)吸收
溶液)吸收 的过程中,
的过程中, 随
随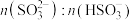 的变化关系如下表:
的变化关系如下表:
①由上表判断 溶液显
溶液显________ 性,用化学平衡原理解释:________________ 。
②当吸收液呈中性时,溶液中离子浓度关系正确的是________ (填序号)。
A.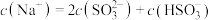
B.
C.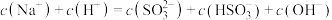
 、
、 、
、 、
、 、
、 ,存在的分子有
,存在的分子有 、
、 ,根据题意回答下列问题。
,根据题意回答下列问题。①写出酸
 的电离方程式:
的电离方程式:②若溶液M由
 溶液与
溶液与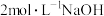 溶液等体积混合而得,则溶液M的
溶液等体积混合而得,则溶液M的
 ”“
”“ ”或“
”或“ ”),溶液M中各微粒的浓度关系正确的是
”),溶液M中各微粒的浓度关系正确的是A.
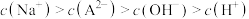
B.

C.

D.
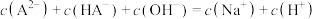
(2)
 是温室气体,可用
是温室气体,可用 溶液吸收得到
溶液吸收得到 或
或 。
。①
 俗称纯碱,因
俗称纯碱,因 水解而使其水溶液呈碱性,试写出
水解而使其水溶液呈碱性,试写出 水解的离子方程式(忽略第二步水解):
水解的离子方程式(忽略第二步水解):
②已知
 时,
时, ,则当溶液中
,则当溶液中 时,溶液的
时,溶液的
③
 溶液中
溶液中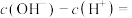
 、
、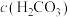 的关系式表示]。
的关系式表示]。④向
 溶液中加入明矾会产生沉淀和气体,请写出相关的离子方程式:
溶液中加入明矾会产生沉淀和气体,请写出相关的离子方程式:(3)实验室可用
 溶液吸收
溶液吸收 ,反应为
,反应为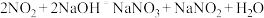 。含
。含 的水溶液与
的水溶液与 恰好完全反应得
恰好完全反应得 溶液A,溶液B为
溶液A,溶液B为 的
的 溶液,则两溶液中
溶液,则两溶液中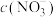 、
、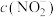 和
和 由大到小的顺序为
由大到小的顺序为 的电离常数
的电离常数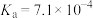 ,
, 的电离常数
的电离常数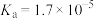 )。可使溶液A和溶液B的
)。可使溶液A和溶液B的 相等的方法是
相等的方法是a.向溶液A中加适量水 b.向溶液A中加适量

c.向溶液B中加适量水 d.向溶液B中加适量

(4)直接排放含
 的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的
的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的 。吸收液(
。吸收液( 溶液)吸收
溶液)吸收 的过程中,
的过程中, 随
随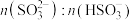 的变化关系如下表:
的变化关系如下表: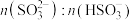 | 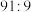 |  | 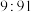 |
 | 8.2 | 7.2 | 6.2 |
①由上表判断
 溶液显
溶液显②当吸收液呈中性时,溶液中离子浓度关系正确的是
A.
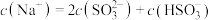
B.

C.
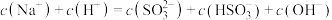
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐1】25℃时,部分物质的电离平衡常数如表所示:
(1)H2CO3的第二级电离平衡常数的表达式K2=___ 。
(2)0.1mol·L-1NH4ClO溶液中离子浓度由大到小的顺序是___ ,ClO-水解反应的平衡常数Kh=___ (保留两位有效数字)。
(3)少量SO2通入过量的Na2CO3溶液中,发生反应的离子方程式为___ 。
(4)相同温度下,等浓度的NaClO溶液、Na2CO3溶液和Na2SO3溶液,三种溶液的pH由大到小的顺序为___ 。
| NH3·H2O | 2×10-5 |
| HClO | 3×10-8 |
| H2CO3 | Ka1=4×10-7 Ka2=4×10-11 |
| H2SO3 | Ka1=1.3×10-2 Ka2=6.3×10-8 |
(1)H2CO3的第二级电离平衡常数的表达式K2=
(2)0.1mol·L-1NH4ClO溶液中离子浓度由大到小的顺序是
(3)少量SO2通入过量的Na2CO3溶液中,发生反应的离子方程式为
(4)相同温度下,等浓度的NaClO溶液、Na2CO3溶液和Na2SO3溶液,三种溶液的pH由大到小的顺序为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】回答下列问题:
(1)25℃时,亚碲酸(H2TeO3)的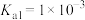 ,
,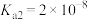 。常温下,NaHTeO3溶液的pH
。常温下,NaHTeO3溶液的pH______ (填“<”“>”或“=”)7。
(2)已知25℃时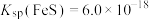 ,要使溶液中
,要使溶液中 沉淀完全[
沉淀完全[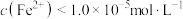 ],则需控制溶液中
],则需控制溶液中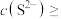
______ 。
(3)室温下,测得用氨水吸收CO2时,溶液中含碳(氮)各粒子的物质的量分数和pH的关系如图,若所得溶液pH=10,则溶液中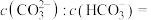
______ (已知 )。
)。

(4)工业上常用氨水吸收含碳燃料燃烧中产生的温室气体CO2,其产物之一是NH4HCO3。已知常温下碳酸的电离常数 ,
, ,
, 的电离常数
的电离常数 ,则所得的NH4HCO3溶液中
,则所得的NH4HCO3溶液中
______ (填“>”“<”或“=”) 。
。
(5)SOCl2是一种液态化合物,将其滴入水中,可观察到剧烈反应,液面上有白雾形成,并有带刺激性气味气体逸出,该气体可使品红溶液褪色。
①根据实验现象写出SOCl2和H2O反应的化学方程式:____________________ 。
②利用 制备无水AlCl3时,可用SOCl2和
制备无水AlCl3时,可用SOCl2和 混合共热,试解释原因:
混合共热,试解释原因:______ 。
(1)25℃时,亚碲酸(H2TeO3)的
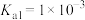 ,
,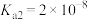 。常温下,NaHTeO3溶液的pH
。常温下,NaHTeO3溶液的pH(2)已知25℃时
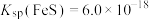 ,要使溶液中
,要使溶液中 沉淀完全[
沉淀完全[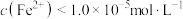 ],则需控制溶液中
],则需控制溶液中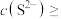
(3)室温下,测得用氨水吸收CO2时,溶液中含碳(氮)各粒子的物质的量分数和pH的关系如图,若所得溶液pH=10,则溶液中
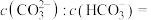
 )。
)。
(4)工业上常用氨水吸收含碳燃料燃烧中产生的温室气体CO2,其产物之一是NH4HCO3。已知常温下碳酸的电离常数
 ,
, ,
, 的电离常数
的电离常数 ,则所得的NH4HCO3溶液中
,则所得的NH4HCO3溶液中
 。
。(5)SOCl2是一种液态化合物,将其滴入水中,可观察到剧烈反应,液面上有白雾形成,并有带刺激性气味气体逸出,该气体可使品红溶液褪色。
①根据实验现象写出SOCl2和H2O反应的化学方程式:
②利用
 制备无水AlCl3时,可用SOCl2和
制备无水AlCl3时,可用SOCl2和 混合共热,试解释原因:
混合共热,试解释原因:
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】以工业生产中排放的含锰酸性废水(主要金属离子为Mn2+、Fe2+、Al3+,还含有少量Ca2+、Mg2+、Cu2+等离子)为原料,生产MnCO3的工艺流程如图:
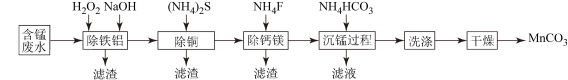
已知:25℃时,几种金属离子沉淀时的pH如下:
25℃时,Ksp(CaF2)=1.5×10-10、Ksp(MgF2)=7.5×10-11。
(1)流程中含锰废水经过前三步预处理,得到主要含有Mn2+的母液。
①除铁铝时,在搅拌条件下先加入H2O2溶液,再加入NaOH溶液调节pH。加入H2O2溶液时发生反应的离子方程式为___ ,调节溶液的pH范围是___ 。
②除钙镁步骤中,当Ca2+、Mg2+沉淀完全时,溶液中 =
=____ 。
(2)沉锰过程在pH为7.0条件下充分进行,反应温度对锰沉淀率的影响关系如图所示。

①沉锰过程发生反应的离子方程式为___ 。
②当温度超过30℃,沉锰反应的锰沉淀率随温度升高而下降的原因是___ 。
(3)沉锰后过滤得到MnCO3粗产品,依次用去离子水和无水乙醇各洗涤2~3次,再低温干燥,得到纯净的MnCO3。用无水乙醇洗涤的目的是___ 。MnCO3和磷酸在一定条件下反应可生成马日夫盐[Mn(H2PO4)2·2H2O],其用于钢铁制品,特别是大型机械设备的磷化处理,可起到防锈效果。马日夫盐溶液显___ 性(填“酸”或“碱”)(已知:H3PO4的电离常数Ka1=7.52×10-3,Ka2=6.23×10-8,Ka3=2.2×10-13)。

已知:25℃时,几种金属离子沉淀时的pH如下:
| Fe2+ | Fe3+ | Al3+ | Mn2+ | Cu2+ | Ca2+ | Mg2+ | |
| 开始沉淀时pH | 7.6 | 2.7 | 3.8 | 8.3 | 5.9 | 11.8 | 9.8 |
| 完全沉淀时pH | 9.7 | 4.0 | 4.7 | 9.8 | 6.9 | 13.8 | 11.8 |
(1)流程中含锰废水经过前三步预处理,得到主要含有Mn2+的母液。
①除铁铝时,在搅拌条件下先加入H2O2溶液,再加入NaOH溶液调节pH。加入H2O2溶液时发生反应的离子方程式为
②除钙镁步骤中,当Ca2+、Mg2+沉淀完全时,溶液中
 =
=(2)沉锰过程在pH为7.0条件下充分进行,反应温度对锰沉淀率的影响关系如图所示。

①沉锰过程发生反应的离子方程式为
②当温度超过30℃,沉锰反应的锰沉淀率随温度升高而下降的原因是
(3)沉锰后过滤得到MnCO3粗产品,依次用去离子水和无水乙醇各洗涤2~3次,再低温干燥,得到纯净的MnCO3。用无水乙醇洗涤的目的是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】碳酸锌在工业上用途广泛。利用某种浸锌渣(主要含有 )制备
)制备 的一种流程如下:
的一种流程如下: ;
;
②室温下,部分离子浓度的对数 与
与 的关系如下图所示(其中
的关系如下图所示(其中 和
和 分别代表含铝、含硅和含锌微粒):
分别代表含铝、含硅和含锌微粒):
(1)“焙烧”时,金属硫化物均转化为氧化物,生成的气体 中主要成分是
中主要成分是______ (填化学式)。
(2)“碱浸”后,浸出液中含有金属元素的离子主要是 和
和______ (填离子符号);欲使浸出液中的含锌微粒完全沉淀,应调节 的范围是
的范围是______ 。
(3)浸渣回收银的过程中有配合物 生成,在碱性条件下用
生成,在碱性条件下用 还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为
还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为______ 。
(4)“除杂”时滤渣的主要成分是______ (填化学式)。
(5)“沉锌”时发生反应的离子方程式为______ ;此过程不宜用碳酸钠代替碳酸氢铵,原因是______ 。
 )制备
)制备 的一种流程如下:
的一种流程如下: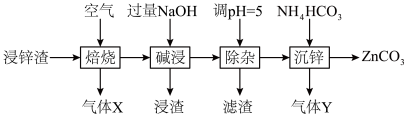
 ;
;②室温下,部分离子浓度的对数
 与
与 的关系如下图所示(其中
的关系如下图所示(其中 和
和 分别代表含铝、含硅和含锌微粒):
分别代表含铝、含硅和含锌微粒):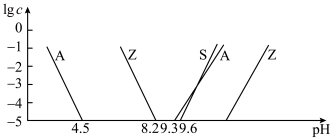
(1)“焙烧”时,金属硫化物均转化为氧化物,生成的气体
 中主要成分是
中主要成分是(2)“碱浸”后,浸出液中含有金属元素的离子主要是
 和
和 的范围是
的范围是(3)浸渣回收银的过程中有配合物
 生成,在碱性条件下用
生成,在碱性条件下用 还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为
还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为(4)“除杂”时滤渣的主要成分是
(5)“沉锌”时发生反应的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】从砷盐净化渣(成分为Cu、As、Zn、ZnO、Co和SiO2)中回收有利用价值的金属,解决了长期以来影响砷盐净化工艺推广的技术难题,具有较强的实践指导意义。其工艺流程如下:

回答下列问题:
(1)CoC2O4的名称是_______ 。
(2)在“选择浸Zn”之前,将砷盐净化渣进行球磨的目的是_______ 。
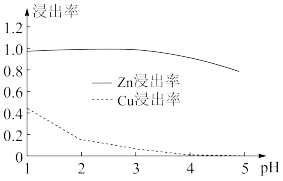
(3)其他条件不变时,Zn和Co的浸出率随pH变化如图所示,则“选择浸Zn”过程中,最好控制溶液的pH=_______ 。
(4)“氧化浸出”时,As被氧化为H3AsO4的化学方程式为_______ 。“浸渣”的主要成分为_______ (填化学式)。
(5)用NaOH溶液调节氧化浸出液至弱酸性,再加入Na3AsO4进行“沉铜”,得到难溶性的Cu5H2(AsO4)4·2H2O,则“沉铜”的离子方程式为_______ 。
(6)“碱浸”时,除回收得到Cu(OH)2外,还得到物质X,且X在该工艺流程中可循环利用,X的化学式为_______ 。

回答下列问题:
(1)CoC2O4的名称是
(2)在“选择浸Zn”之前,将砷盐净化渣进行球磨的目的是
(3)其他条件不变时,Zn和Co的浸出率随pH变化如图所示,则“选择浸Zn”过程中,最好控制溶液的pH=

(4)“氧化浸出”时,As被氧化为H3AsO4的化学方程式为
(5)用NaOH溶液调节氧化浸出液至弱酸性,再加入Na3AsO4进行“沉铜”,得到难溶性的Cu5H2(AsO4)4·2H2O,则“沉铜”的离子方程式为
(6)“碱浸”时,除回收得到Cu(OH)2外,还得到物质X,且X在该工艺流程中可循环利用,X的化学式为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐3】为实现2030年碳达峰、2060年碳中和的战略目标,重庆市沙坪坝区拆除某废弃煤电厂,设备及烟囱中存有大量的粉煤灰(主要成分为 、
、 ,还含少量
,还含少量 )和耐热镁铬砖(主要成分为MgO和
)和耐热镁铬砖(主要成分为MgO和 ),拟进行各种金属的分离并制备镁尖晶石(
),拟进行各种金属的分离并制备镁尖晶石( )。该工艺中,溶液中金属离子开始沉淀和完全沉淀以及开始溶解和完全溶解的pH如下表一所示:
)。该工艺中,溶液中金属离子开始沉淀和完全沉淀以及开始溶解和完全溶解的pH如下表一所示:
表一
已知:①元素铬(Ⅲ)在溶液中存在形式:酸性: ;碱性:
;碱性: 。
。
② 为两性物质,可溶于NaOH溶液,也可溶于氨水形成
为两性物质,可溶于NaOH溶液,也可溶于氨水形成 。
。
Ⅰ.各种金属离子的分离
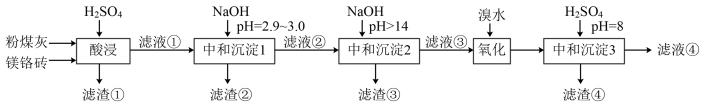
(1)“酸浸”中,滤渣①的成分是___________ 。
(2)滤液②中的金属离子为 、
、 、
、___________ 。
(3)“中和沉淀2”中, 发生转变的总离子方程式为
发生转变的总离子方程式为___________ 。
(4)“氧化”中, 转变为
转变为 的离子方程式为
的离子方程式为___________ 。下图为工厂液溴储存罐示意图,c层的颜色为___________ 。

(5)“中和沉淀3”中, 时,溶液中c(AlO
时,溶液中c(AlO )
)___________ mol/L。已知: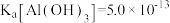 ,
,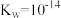 ,
, 。
。
Ⅱ.取滤液②利用“共沉淀法”制备镁尖晶石( )
)

(6)应先向沉淀反应器中加入___________ (填“A”或“B”),再滴加另一反应物。(参考表一中数据作答)
(7)①下图所示过滤操作的错误是___________ (任答一处即可)。
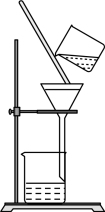
②判断流程中沉淀是否洗净所用的试剂是___________ 。高温焙烧时,用于盛放固体的仪器名称是___________ 。
 、
、 ,还含少量
,还含少量 )和耐热镁铬砖(主要成分为MgO和
)和耐热镁铬砖(主要成分为MgO和 ),拟进行各种金属的分离并制备镁尖晶石(
),拟进行各种金属的分离并制备镁尖晶石( )。该工艺中,溶液中金属离子开始沉淀和完全沉淀以及开始溶解和完全溶解的pH如下表一所示:
)。该工艺中,溶液中金属离子开始沉淀和完全沉淀以及开始溶解和完全溶解的pH如下表一所示:表一
| 金属离子 | 开始沉淀pH | 完全沉淀pH | 沉淀开始溶解 | 沉淀完全溶解 |
 | 1.5 | 2.9 | — | — |
 | 3 | 5 | 8 | 11 |
 | 10 | 12 | — | — |
 | 4 | 7 | 12 | 14 |
 ;碱性:
;碱性: 。
。②
 为两性物质,可溶于NaOH溶液,也可溶于氨水形成
为两性物质,可溶于NaOH溶液,也可溶于氨水形成 。
。Ⅰ.各种金属离子的分离

(1)“酸浸”中,滤渣①的成分是
(2)滤液②中的金属离子为
 、
、 、
、(3)“中和沉淀2”中,
 发生转变的总离子方程式为
发生转变的总离子方程式为(4)“氧化”中,
 转变为
转变为 的离子方程式为
的离子方程式为
(5)“中和沉淀3”中,
 时,溶液中c(AlO
时,溶液中c(AlO )
)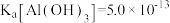 ,
,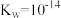 ,
, 。
。Ⅱ.取滤液②利用“共沉淀法”制备镁尖晶石(
 )
)
(6)应先向沉淀反应器中加入
(7)①下图所示过滤操作的错误是
②判断流程中沉淀是否洗净所用的试剂是

您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】碲是一种重要的战略稀缺元素,被誉为“现代工业的维生素”,是制造光电、半导体、制冷等元件不可缺少的关键材料。有色金属冶炼厂以电解精炼铜的阳极泥为原料,设计了如图新工艺提取、回收并制备高纯碲:
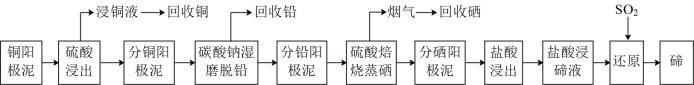
[25℃时,PbSO4和PbCO3的Ksp分别为1.6×10-5(mol·L-1)2、7.4×10-14(mol·L-1)2]
(1)写出冶炼厂电解精炼铜的阴极电极反应式:___ 。
(2)分铜阳极泥(含PbSO4)与Na2CO3混合“湿法球磨”,PbSO4可转化为PbCO3,此反应的化学方程式为___ 。若在1LPbSO4饱和溶液中加入10.6gNa2CO3固体(溶液体积变化忽略不计),则此时溶液中SO 的物质的量浓度为
的物质的量浓度为___ mol/L。
(3)分铅阳极泥经硫酸化焙烧蒸硒,产生的烟气中含SeO2与SO2,烟气在低温区用水吸收可回收硒,此过程中氧化产物和还原产物的物质的量之比为___ 。
(4)分硒阳极泥盐酸浸出液中Te4+用SO2还原可以得到单质碲,发生反应的方程式为:SO2+H2O=H2SO3,___ 。研究表明,Cl-离子浓度为0.1mol·L-1时的活化能比Cl-离子浓度为0.3mol·L-1时的活化能大,说明较高浓度Cl-可作该反应的__ 。
(5)整个工艺路线中可以循环利用的物质有(填化学式)___ 、__ 。

[25℃时,PbSO4和PbCO3的Ksp分别为1.6×10-5(mol·L-1)2、7.4×10-14(mol·L-1)2]
(1)写出冶炼厂电解精炼铜的阴极电极反应式:
(2)分铜阳极泥(含PbSO4)与Na2CO3混合“湿法球磨”,PbSO4可转化为PbCO3,此反应的化学方程式为
 的物质的量浓度为
的物质的量浓度为(3)分铅阳极泥经硫酸化焙烧蒸硒,产生的烟气中含SeO2与SO2,烟气在低温区用水吸收可回收硒,此过程中氧化产物和还原产物的物质的量之比为
(4)分硒阳极泥盐酸浸出液中Te4+用SO2还原可以得到单质碲,发生反应的方程式为:SO2+H2O=H2SO3,
(5)整个工艺路线中可以循环利用的物质有(填化学式)
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐2】工业上以软锰矿(主要成分为MnO2,另含有少量FeCO3、Al2O3、SiO2)为原料制取金属锰的工艺流程如下:
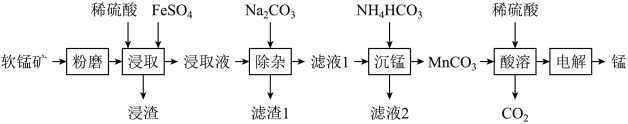
(1)软锰矿“粉磨”的目的是___________ 。
(2)“浸渣”的主要成分是___________ 。
(3)经检测“浸取液”中无Fe2+,“浸取"时MnO2发生反应的离子方程式为___________ 。
(4)在“沉锰”操作中,不能用Na2CO3代替 NH4HCO3,其原因是___________ 。
(5)将“酸溶”后的溶液作为电解液,用下图1装置电解应采用___________ 离子交换膜(填“阴”或“阳”),阳极的电极反应式为___________ 。
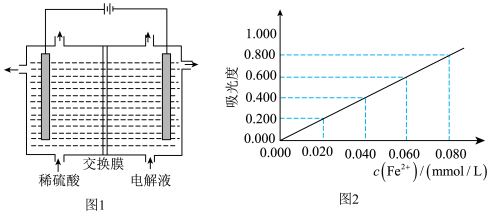
(6)为充分利用“滤渣1”,需测定滤渣中Al元素的含量,设计以下方案。
①将mg滤渣处理成amL溶液;
②取少量①中溶液用EDTA滴定测得溶液中Fe3+、Al3+的浓度之和为 b mmol/L;
③另取少量①中溶液将Fe3+用盐酸羟胺(在溶液中可完全电离出NH3OH+与Cl-)还原Fe2+,离子方程式为___________ ;
④将③所得溶液利用吸光度法测得其吸光度为0.400(吸光度与Fe2+的浓度关系如上图2所示)。该样品中Al元素的质量分数为___________ (用含字母的表达式表示)。

(1)软锰矿“粉磨”的目的是
(2)“浸渣”的主要成分是
(3)经检测“浸取液”中无Fe2+,“浸取"时MnO2发生反应的离子方程式为
(4)在“沉锰”操作中,不能用Na2CO3代替 NH4HCO3,其原因是
(5)将“酸溶”后的溶液作为电解液,用下图1装置电解应采用

(6)为充分利用“滤渣1”,需测定滤渣中Al元素的含量,设计以下方案。
①将mg滤渣处理成amL溶液;
②取少量①中溶液用EDTA滴定测得溶液中Fe3+、Al3+的浓度之和为 b mmol/L;
③另取少量①中溶液将Fe3+用盐酸羟胺(在溶液中可完全电离出NH3OH+与Cl-)还原Fe2+,离子方程式为
④将③所得溶液利用吸光度法测得其吸光度为0.400(吸光度与Fe2+的浓度关系如上图2所示)。该样品中Al元素的质量分数为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐3】2022北京冬奥会期间的交通服务用车中,氢燃料电车占了绝大多数。氢氧燃料电池中,贵金属Pt作为催化剂起到关键作用。下列是从某阳极泥中回收铂、金的工艺流程图,请仔细阅读信息后作答:
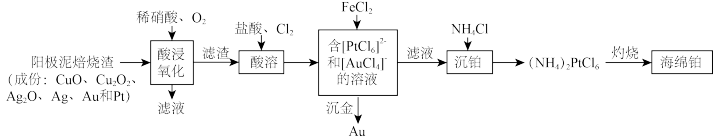
(1)“酸浸氧化”中无气体排出,此时通入氧气的目的是____ ,“滤液”中的金属阳离子有____ 。
(2)若“酸溶”得到的[PtCl6]2-和[AuCl4]-的物质的量均为1mol,则消耗的氯气至少为___________ mol。
(3)沉金过程中的离子反应方程式为___________ 。
(4)“沉铂”中,生成(NH4)2PtCl6的沉淀率随温度升高而呈升高趋势,请结合化学反应方程式解释升高温度,(NH4)2PtCl6沉淀率升高的主要原因___________ 。
(5)滤渣氯铂酸铵[(NH4)2PtCl6]表面有大量氯化铵等可溶性的盐,需要洗涤除去,洗涤沉淀的方法是___________ 。
(6)写出(NH4)2PtCl6灼烧时的化学反应方程式___________ 。

(1)“酸浸氧化”中无气体排出,此时通入氧气的目的是
(2)若“酸溶”得到的[PtCl6]2-和[AuCl4]-的物质的量均为1mol,则消耗的氯气至少为
(3)沉金过程中的离子反应方程式为
(4)“沉铂”中,生成(NH4)2PtCl6的沉淀率随温度升高而呈升高趋势,请结合化学反应方程式解释升高温度,(NH4)2PtCl6沉淀率升高的主要原因
(5)滤渣氯铂酸铵[(NH4)2PtCl6]表面有大量氯化铵等可溶性的盐,需要洗涤除去,洗涤沉淀的方法是
(6)写出(NH4)2PtCl6灼烧时的化学反应方程式
您最近一年使用:0次



