工业上以软锰矿(主要成分为MnO2,另含有少量FeCO3、Al2O3、SiO2)为原料制取金属锰的工艺流程如下:
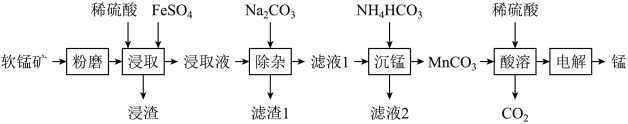
(1)软锰矿“粉磨”的目的是___________ 。
(2)“浸渣”的主要成分是___________ 。
(3)经检测“浸取液”中无Fe2+,“浸取"时MnO2发生反应的离子方程式为___________ 。
(4)在“沉锰”操作中,不能用Na2CO3代替 NH4HCO3,其原因是___________ 。
(5)将“酸溶”后的溶液作为电解液,用下图1装置电解应采用___________ 离子交换膜(填“阴”或“阳”),阳极的电极反应式为___________ 。
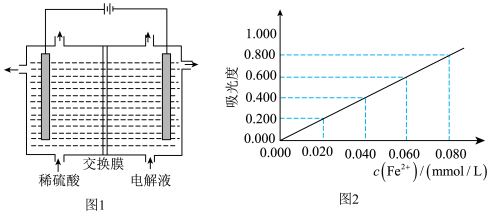
(6)为充分利用“滤渣1”,需测定滤渣中Al元素的含量,设计以下方案。
①将mg滤渣处理成amL溶液;
②取少量①中溶液用EDTA滴定测得溶液中Fe3+、Al3+的浓度之和为 b mmol/L;
③另取少量①中溶液将Fe3+用盐酸羟胺(在溶液中可完全电离出NH3OH+与Cl-)还原Fe2+,离子方程式为___________ ;
④将③所得溶液利用吸光度法测得其吸光度为0.400(吸光度与Fe2+的浓度关系如上图2所示)。该样品中Al元素的质量分数为___________ (用含字母的表达式表示)。

(1)软锰矿“粉磨”的目的是
(2)“浸渣”的主要成分是
(3)经检测“浸取液”中无Fe2+,“浸取"时MnO2发生反应的离子方程式为
(4)在“沉锰”操作中,不能用Na2CO3代替 NH4HCO3,其原因是
(5)将“酸溶”后的溶液作为电解液,用下图1装置电解应采用

(6)为充分利用“滤渣1”,需测定滤渣中Al元素的含量,设计以下方案。
①将mg滤渣处理成amL溶液;
②取少量①中溶液用EDTA滴定测得溶液中Fe3+、Al3+的浓度之和为 b mmol/L;
③另取少量①中溶液将Fe3+用盐酸羟胺(在溶液中可完全电离出NH3OH+与Cl-)还原Fe2+,离子方程式为
④将③所得溶液利用吸光度法测得其吸光度为0.400(吸光度与Fe2+的浓度关系如上图2所示)。该样品中Al元素的质量分数为
更新时间:2019-02-26 10:32:56
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】我国镍铬资源较少,镍铬是我国的国家战略资源。河南永通特种钢车间产生的镍铬废渣,镍铬含量高,一种处理该镍铬废渣的工艺流程如下:
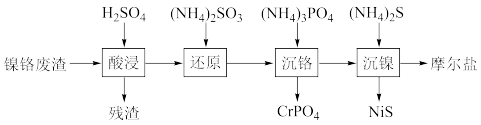
已知:①镍铬废渣中主要含SiO2、Fe2O3、FeO,次要成分为Cr2O3、NiO等;
②CrPO4、NiS、(NH4)2SO4·FeSO4·6H2O(即摩尔盐)均为重要的化工产品;
③25℃时溶度积:Ksp(NiS)=1.0×10-24,Ksp(FeS)=6.3×10-18。
回答下列问题:
(1)“酸浸”时需要采取加热措施,其目的是_______ ,产生的残渣中的物质成分是_______ (用名称表示)。
(2)写出“还原”时的离子方程式:_______ 。
(3)“沉铬”的过程中溶液pH的变化:_______ 。
(4)“沉镍”过程中没有生成FeS,若“沉镍”后的溶液中c(Ni2+)=1.0×10-6mol·L-1,则“沉镍”后的溶液中c(Fe2+)_______  ,“沉镍”选择(NH4)2S没有选择FeS,你认为最主要的原因是
,“沉镍”选择(NH4)2S没有选择FeS,你认为最主要的原因是_______ 。
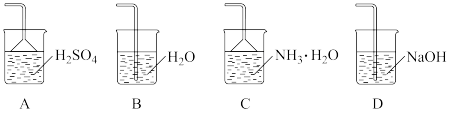
(5)“沉镍”过程中时常产生一种气体,适合吸收该气体的装置为_______ (填标号)。
(6)已知相关物质的溶解度如下表所示,则从“沉镍”后的滤液中得到摩尔盐的实验操作有_______ ,再经洗涤、干燥得到摩尔盐样品。检验摩尔盐中是否含有Fe3+的化学试剂是_______ 。
硫酸铵、水合硫酸亚铁、水合硫酸亚铁铵在水中的溶解度表/g
表中的“—”表示在该温度下,该物质不稳定,不结晶析出

已知:①镍铬废渣中主要含SiO2、Fe2O3、FeO,次要成分为Cr2O3、NiO等;
②CrPO4、NiS、(NH4)2SO4·FeSO4·6H2O(即摩尔盐)均为重要的化工产品;
③25℃时溶度积:Ksp(NiS)=1.0×10-24,Ksp(FeS)=6.3×10-18。
回答下列问题:
(1)“酸浸”时需要采取加热措施,其目的是
(2)写出“还原”时的离子方程式:
(3)“沉铬”的过程中溶液pH的变化:
(4)“沉镍”过程中没有生成FeS,若“沉镍”后的溶液中c(Ni2+)=1.0×10-6mol·L-1,则“沉镍”后的溶液中c(Fe2+)
 ,“沉镍”选择(NH4)2S没有选择FeS,你认为最主要的原因是
,“沉镍”选择(NH4)2S没有选择FeS,你认为最主要的原因是(5)“沉镍”过程中时常产生一种气体,适合吸收该气体的装置为

(6)已知相关物质的溶解度如下表所示,则从“沉镍”后的滤液中得到摩尔盐的实验操作有
硫酸铵、水合硫酸亚铁、水合硫酸亚铁铵在水中的溶解度表/g
| 10 | 20 | 30 | 40 | 50 | 60 | |
| (NH4)2SO4 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
| FeSO4·7H2O | 40.0 | 48.0 | 60.0 | 73.3 | — | — |
| (NH4)2SO4·FeSO4·6H2O | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】氧化锌在工业和生活中的运用非常广泛,以闪锌矿(主要成分为ZnS,含有少量FeS和SiO2)为原料制备活性氧化锌的工艺流程如图,请回答下列问题:

(1)矿渣中除了有淡黄色的物质,还有__ (填化学式)。
(2)加入铁粉的目的是__ ,能循环利用的无机物是__ (填化学式)。
(3)生成ZnCO3•2Zn(OH)2的离子方程式为__ 。
(4)有机萃取剂TBP能将氯化亚铁和氯化锌分离的原因是__ 。
(5)工业上常采用Fenton氧化法去除废水中的有机物,即向废水中加入H2O2,以FeCl2作催化剂,产生具有强氧化性的羟基自由基(•OH)来氧化降解水中的有机物(TOC)。
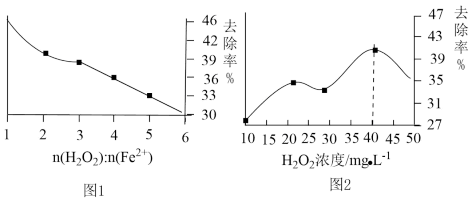
①其他条件一定时,n(H2O2):n(Fe2+)的值对TOC去除效果的影响如图1所示,当废水中TOC的去除率最大时,n(H2O2):n(Fe2+)=__ 。
②在酸性条件下,H2O2的加入量对TOC的去除效果如图2所示,当TOC的去除效果最好时,H2O2的物质的量浓度c(H2O2)=__ (保留三位有效数字)。

(1)矿渣中除了有淡黄色的物质,还有
(2)加入铁粉的目的是
(3)生成ZnCO3•2Zn(OH)2的离子方程式为
(4)有机萃取剂TBP能将氯化亚铁和氯化锌分离的原因是
(5)工业上常采用Fenton氧化法去除废水中的有机物,即向废水中加入H2O2,以FeCl2作催化剂,产生具有强氧化性的羟基自由基(•OH)来氧化降解水中的有机物(TOC)。

①其他条件一定时,n(H2O2):n(Fe2+)的值对TOC去除效果的影响如图1所示,当废水中TOC的去除率最大时,n(H2O2):n(Fe2+)=
②在酸性条件下,H2O2的加入量对TOC的去除效果如图2所示,当TOC的去除效果最好时,H2O2的物质的量浓度c(H2O2)=
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐3】磁性材料A由两种元素组成,取2.960gA在足量的空气中充分煅烧,得到2.400g红棕色固体B和无色刺激性气体D。固体B溶于盐酸形成棕黄色溶液C,再加入KSCN溶液变为血红色。气体D溶于水得到无色酸性溶液E,向E中加足量碘的碘化钾溶液(红棕色)得到溶液F,同时溶液酸性增强。请回答下列问题:
(1)A的组成元素为_________ (用元素符号表示)。
(2)溶液C也可用于处理污水,用离子方程式表示污水处理原理____________ 。
(3)已知化合物A能与稀硫酸反应,反应后得到浅绿色溶液,同时生成一种淡黄色不溶物和一种臭鸡蛋气味气体,写出该反应的化学方程式_________________ 。
(4)结合离子方程式解释E中加足量碘的碘化钾溶液后溶液酸性增强的原因_____________ 。
(1)A的组成元素为
(2)溶液C也可用于处理污水,用离子方程式表示污水处理原理
(3)已知化合物A能与稀硫酸反应,反应后得到浅绿色溶液,同时生成一种淡黄色不溶物和一种臭鸡蛋气味气体,写出该反应的化学方程式
(4)结合离子方程式解释E中加足量碘的碘化钾溶液后溶液酸性增强的原因
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】纳米铜是一种性能优质的超导材料,以辉铜矿(主要成分为Cu2S)为原料制备纳米铜粉的工艺流程如图所示。

资料:肼(N2H4)无色油状液体,溶于水生成水合肼N2H4·H2O(水合肼有强还原性,生成无污染物质,易挥发)
(1)①上述流程中可以加快反应速率的措施有______ 。
A.过滤和萃取 B.升高温度 C.增大压强 D.研磨矿石
②用FeCl3溶液浸取辉铜矿中铜元素的反应为:Cu2S+4FeCl3=2CuCl2+4FeCl2+S。浸取时,在有氧的环境下可维持Fe3+较高浓度,有关反应的离子方程式为_______ 。
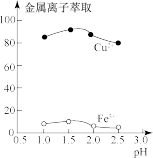
(2)“萃取”时,两种金属离子萃取率与pH的关系如图所示。当pH>1.7时,pH越大,金属离子萃取率越低,其中Fe3+萃取率降低的原因是______ 。
(3)“反萃取”得到的CuSO4溶液制备纳米铜粉时,Cu2+的还原率随pH和温度的变化如下表所示:
①该反应的离子方程式为_______ 。
②超过70℃时Cu2+的还原率降低的原因是______ 。
③以辉铜矿为原料制备纳米铜粉的工艺条件选择70℃、pH=10的理由是______ 。
(4)“水相1”中加入适量氨水,静置,再经过滤、_____ 、干燥、______ 等操作可得到Fe2O3。
(5)假设制得纳米铜的质量为akg,则最少投入肼的物质的量是______ 。

资料:肼(N2H4)无色油状液体,溶于水生成水合肼N2H4·H2O(水合肼有强还原性,生成无污染物质,易挥发)
(1)①上述流程中可以加快反应速率的措施有
A.过滤和萃取 B.升高温度 C.增大压强 D.研磨矿石
②用FeCl3溶液浸取辉铜矿中铜元素的反应为:Cu2S+4FeCl3=2CuCl2+4FeCl2+S。浸取时,在有氧的环境下可维持Fe3+较高浓度,有关反应的离子方程式为
(2)“萃取”时,两种金属离子萃取率与pH的关系如图所示。当pH>1.7时,pH越大,金属离子萃取率越低,其中Fe3+萃取率降低的原因是

(3)“反萃取”得到的CuSO4溶液制备纳米铜粉时,Cu2+的还原率随pH和温度的变化如下表所示:
| pH | 6 | 7 | 8 | 9 | 10 | 11 | 12 | |
| Cu2+还原率(%) | 34 | 60 | 90 | 92 | 95 | 92 | 90 | |
| 产物形态 | 砖红色Cu2O | 铜粉 | 紫黑色纳米铜 | |||||
| 温度 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | |
| Cu2+还原率(%) | 25 | 45 | 70 | 80 | 95 | 90 | 85 | |
| 产物形态 | 砖红色Cu2O | 铜粉 | 紫黑色纳米铜 | |||||
①该反应的离子方程式为
②超过70℃时Cu2+的还原率降低的原因是
③以辉铜矿为原料制备纳米铜粉的工艺条件选择70℃、pH=10的理由是
(4)“水相1”中加入适量氨水,静置,再经过滤、
(5)假设制得纳米铜的质量为akg,则最少投入肼的物质的量是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐2】硫酸亚铁是重要的化工原料
Ⅰ.
(1)由 溶液制备硫酸亚铁晶体的方法是
溶液制备硫酸亚铁晶体的方法是___________ 。检验晶体中 是否完全变质,将晶体溶于水,加
是否完全变质,将晶体溶于水,加___________ (填试剂)。
(2) 溶液与过量的
溶液与过量的 溶液混合,可以得到含
溶液混合,可以得到含 的浊液,离子方程式是
的浊液,离子方程式是___________ 。
Ⅱ.氧化铁黄(FeOOH)是一种黄色颜料,具有非常好的耐光性和耐碱性,是氧化铁的一水合物。以 为原料制备FeOOH的流程如下:
为原料制备FeOOH的流程如下:
(3)若在实验室完成上述制备,不需要使用的仪器是___________ 。 时段,pH快速下降的原因是反应生成了FeOOH和
时段,pH快速下降的原因是反应生成了FeOOH和 ,该反应的化学方程式为
,该反应的化学方程式为___________ 。
② 时段,经历的反应为
时段,经历的反应为 ,该过程pH继续平缓下降的原因可能是
,该过程pH继续平缓下降的原因可能是___________ 。
(5)判断流程中产品洗涤干净的方法是___________ 。
(6)氧化铁黄(FeOOH)纯度可以通过产品的耗酸量确定,如下图所示。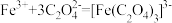 ,
,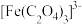 不与稀碱液反应。
不与稀碱液反应。
①在溶液c中滴加NaOH标准溶液,使用的指示剂为___________ 。
②若实验时加入了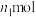 的
的 ,消耗
,消耗 ,设氧化铁黄的摩尔质量为
,设氧化铁黄的摩尔质量为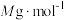 ,则氧化铁黄样品纯度为
,则氧化铁黄样品纯度为___________ (用含w、 、
、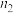 、M的代数式表示)。
、M的代数式表示)。
③测定时,若滴入 不足量,会使实验结果
不足量,会使实验结果___________ (选填“偏大”“偏小”或“无影响”)。
Ⅰ.
(1)由
 溶液制备硫酸亚铁晶体的方法是
溶液制备硫酸亚铁晶体的方法是 是否完全变质,将晶体溶于水,加
是否完全变质,将晶体溶于水,加(2)
 溶液与过量的
溶液与过量的 溶液混合,可以得到含
溶液混合,可以得到含 的浊液,离子方程式是
的浊液,离子方程式是Ⅱ.氧化铁黄(FeOOH)是一种黄色颜料,具有非常好的耐光性和耐碱性,是氧化铁的一水合物。以
 为原料制备FeOOH的流程如下:
为原料制备FeOOH的流程如下: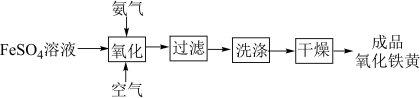
(3)若在实验室完成上述制备,不需要使用的仪器是
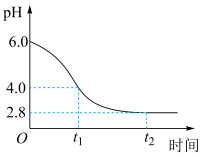
 时段,pH快速下降的原因是反应生成了FeOOH和
时段,pH快速下降的原因是反应生成了FeOOH和 ,该反应的化学方程式为
,该反应的化学方程式为②
 时段,经历的反应为
时段,经历的反应为 ,该过程pH继续平缓下降的原因可能是
,该过程pH继续平缓下降的原因可能是(5)判断流程中产品洗涤干净的方法是
(6)氧化铁黄(FeOOH)纯度可以通过产品的耗酸量确定,如下图所示。
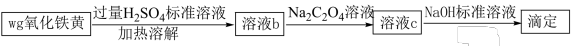
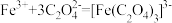 ,
,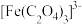 不与稀碱液反应。
不与稀碱液反应。①在溶液c中滴加NaOH标准溶液,使用的指示剂为
②若实验时加入了
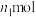 的
的 ,消耗
,消耗 ,设氧化铁黄的摩尔质量为
,设氧化铁黄的摩尔质量为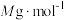 ,则氧化铁黄样品纯度为
,则氧化铁黄样品纯度为 、
、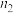 、M的代数式表示)。
、M的代数式表示)。③测定时,若滴入
 不足量,会使实验结果
不足量,会使实验结果
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐3】从钒铬锰铁矿渣(主要成分为 、
、 、
、 、
、 )中提
)中提 的一种工艺流程如下:
的一种工艺流程如下:
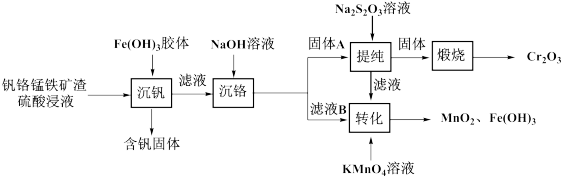
已知: 开始沉淀的
开始沉淀的 为6.3;
为6.3; 较大时,二价锰
较大时,二价锰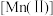 在空气中易被氧化。
在空气中易被氧化。
回答下列问题:
(1) 的电子式为
的电子式为___________ 。
(2)常温下,各种形态五价钒粒子总浓度的对数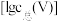 与
与 关系如图一、已知钒铬锰铁矿渣中
关系如图一、已知钒铬锰铁矿渣中 ,“沉钒”过程控制
,“沉钒”过程控制 ,则与胶体共沉降的五价钒粒子的存在形态为
,则与胶体共沉降的五价钒粒子的存在形态为___________ 。(填化学式)

(3)某温度下, Cr(Ⅲ)、Mn(Ⅱ)的沉淀率与 关系如图二、“沉铬”过程最佳
关系如图二、“沉铬”过程最佳 为
为___________ 。此时,滤液B中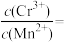
___________ 。 [已知:该温度下,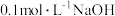 溶液的
溶液的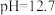 ,
, ,
,
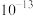 ]
]
(4)“提纯”过程中 的作用为
的作用为___________ 。
(5)“转化”过程中:
①除去 的离子方程式为___________
的离子方程式为___________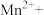 ___________
___________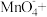 _____
_____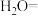 ______
______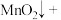 ___________
___________ (配平该方程式)
(配平该方程式) ____ 。
②写出除去 的离子方程式
的离子方程式____ (产物之一为 )。
)。
 、
、 、
、 、
、 )中提
)中提 的一种工艺流程如下:
的一种工艺流程如下:
已知:
 开始沉淀的
开始沉淀的 为6.3;
为6.3; 较大时,二价锰
较大时,二价锰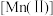 在空气中易被氧化。
在空气中易被氧化。回答下列问题:
(1)
 的电子式为
的电子式为(2)常温下,各种形态五价钒粒子总浓度的对数
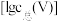 与
与 关系如图一、已知钒铬锰铁矿渣中
关系如图一、已知钒铬锰铁矿渣中 ,“沉钒”过程控制
,“沉钒”过程控制 ,则与胶体共沉降的五价钒粒子的存在形态为
,则与胶体共沉降的五价钒粒子的存在形态为
(3)某温度下, Cr(Ⅲ)、Mn(Ⅱ)的沉淀率与
 关系如图二、“沉铬”过程最佳
关系如图二、“沉铬”过程最佳 为
为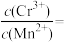
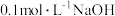 溶液的
溶液的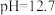 ,
, ,
,
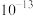 ]
](4)“提纯”过程中
 的作用为
的作用为(5)“转化”过程中:
①除去
 的离子方程式为___________
的离子方程式为___________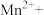 ___________
___________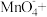 _____
_____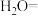 ______
______ ___________
___________ (配平该方程式)
(配平该方程式) ②写出除去
 的离子方程式
的离子方程式 )。
)。
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】稀土在电子、激光、核工业、超导等诸多高科技领域有广泛的应用。钪(Sc)是一种稀土金属,利用钛尾矿回收金属钪和草酸的工艺流程如图1所示。回答下列问题:

已知:①xNH4Cl·yScF3·zH2O是“沉钪”过程中ScF3与氯化物形成的复盐沉淀,在强酸中部分溶解。
②“脱水除铵”是复盐沉淀的热分解过程。
③25℃时,部分物质的相关信息如表所示:
(1)“焙烧”过程生成Sc2O3的化学方程式为___________ 。
(2)含钪元素的微粒与lgc(F-)、pH的关系如下图所示,用氨水调节溶液的pH值,控制pH的范围是3.5<pH<___________ 。
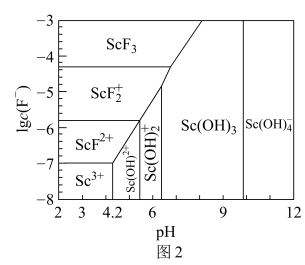
(3)“脱水除铵”过程中固体质量与温度的关系如下图所示,其中在380-400℃过程中会有白烟冒出,保温至无烟气产生,即得到 ScF3,由图3中数据可得x:z=___________ 。
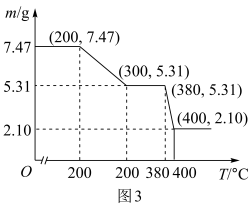
(4)传统制备ScF3的方法是先得到ScF3·6H2O沉淀,再高温脱水得ScF3,但通常含有ScOF杂质,原因是___________ 。(用化学方程式表示)。流程中“沉钪”后“脱水除铵”可制得纯度很高的ScF3,其原因是___________ 。
(5)将1.8mol PbSO4加到1L含有0.12mol/L H2C2O4的废水中。发生的离子反应为PbSO4(s)+H2C2O4(aq) PbC2O4(s)+2H+(aq)+ SO
PbC2O4(s)+2H+(aq)+ SO (aq),该反应的平衡常数K=
(aq),该反应的平衡常数K=___________ 。滤饼经浓硫酸处理后的“沉淀”是___________ (化学式)。

已知:①xNH4Cl·yScF3·zH2O是“沉钪”过程中ScF3与氯化物形成的复盐沉淀,在强酸中部分溶解。
②“脱水除铵”是复盐沉淀的热分解过程。
③25℃时,部分物质的相关信息如表所示:
| Ksp(PbSO4) | Ksp(PbC2O4) | Ka1(H2C2O4) | Ka2(H2C2O4) |
| 2.0×10-8 | 5.0×10-10 | 6.0×10-2 | 6.25×10-5 |
(2)含钪元素的微粒与lgc(F-)、pH的关系如下图所示,用氨水调节溶液的pH值,控制pH的范围是3.5<pH<

(3)“脱水除铵”过程中固体质量与温度的关系如下图所示,其中在380-400℃过程中会有白烟冒出,保温至无烟气产生,即得到 ScF3,由图3中数据可得x:z=

(4)传统制备ScF3的方法是先得到ScF3·6H2O沉淀,再高温脱水得ScF3,但通常含有ScOF杂质,原因是
(5)将1.8mol PbSO4加到1L含有0.12mol/L H2C2O4的废水中。发生的离子反应为PbSO4(s)+H2C2O4(aq)
 PbC2O4(s)+2H+(aq)+ SO
PbC2O4(s)+2H+(aq)+ SO (aq),该反应的平衡常数K=
(aq),该反应的平衡常数K=
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐2】K3[Fe(C2O4)3](三草酸合铁酸钾)为亮绿色晶体,易溶于热水,在工业上具有一定的应用价值。
请回答下列问题:
(1)三草酸合铁酸钾在一定条件下能分解产生CO2和CO两种气体。某化学小组设计了如图所示的装置(夹持装置等略去),来验证这两种气体产物。
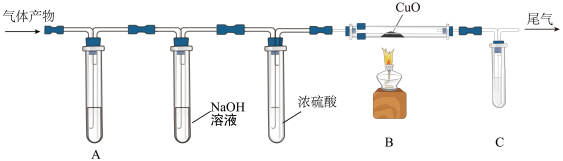
则A、C装置中的试剂均为___________ ;NaOH溶液的作用是___________ ;B装置硬质玻璃管中反应的化学方程式为___________ ;实验前需先通入N2排除装置内的空气,其原因是___________ 。
(2)实验室制备三草酸合铁酸钾的操作如下:称取5g(NH4)2Fe(SO4)2·6H2O固体置于烧杯中,加入15mL水和几滴稀硫酸,搅拌充分溶解。再加入25mL饱和H2C2O4溶液,加热至沸,生成黄色沉淀FeC2O4·2H2O。静置,倾去上层清液,将沉淀洗涤干净,向其中加入过量饱和K2C2O4溶液,水浴加热至40℃,边搅拌边缓慢滴加H2O2溶液,沉淀逐渐变为红褐色。将混合物继续煮沸,加入饱和H2C2O4溶液,红褐色沉淀溶解,趁热过滤。待滤液冷却后,析出亮绿色晶体,过滤、洗涤、干燥,可得到产品。则加入稀硫酸的作用是___________ ;滴加H2O2溶液生成K3[Fe(C2O4)3]和红褐色沉淀的化学方程式为___________ ;红褐色沉淀溶解得到K3[Fe(C2O4)3]的化学方程式为___________ ;滴加H2O2溶液时混合物的温度不宜过高的原因是___________ ;过滤操作中需用到的玻璃仪器有___________ (写出2种即可)。
请回答下列问题:
(1)三草酸合铁酸钾在一定条件下能分解产生CO2和CO两种气体。某化学小组设计了如图所示的装置(夹持装置等略去),来验证这两种气体产物。

则A、C装置中的试剂均为
(2)实验室制备三草酸合铁酸钾的操作如下:称取5g(NH4)2Fe(SO4)2·6H2O固体置于烧杯中,加入15mL水和几滴稀硫酸,搅拌充分溶解。再加入25mL饱和H2C2O4溶液,加热至沸,生成黄色沉淀FeC2O4·2H2O。静置,倾去上层清液,将沉淀洗涤干净,向其中加入过量饱和K2C2O4溶液,水浴加热至40℃,边搅拌边缓慢滴加H2O2溶液,沉淀逐渐变为红褐色。将混合物继续煮沸,加入饱和H2C2O4溶液,红褐色沉淀溶解,趁热过滤。待滤液冷却后,析出亮绿色晶体,过滤、洗涤、干燥,可得到产品。则加入稀硫酸的作用是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】工业上利用氟碳铈矿(主要成分CeCO3F)提取CeCl3的一种工艺流程如下:
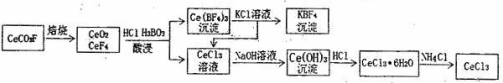
请回答下列问题:
(1)CeCO3F中,Ce元素的化合价为_______ 。
(2)酸浸过程中用稀硫酸和H2O2替换HCl不会造成环境污染。写出稀硫酸、H2O2与CeO2反应的离子方程式:____________ 。
(3)向Ce(BF4)3为中加入KCl溶液的目的是_________ 。
(4)若溶液中的Ce3+沉淀完全,此时溶液的pH为_______ (已知Ksp[Ce(OH)3]=1×10-20)
(5)加热CeCl3·6H2O和NH4Cl的固体混合物可得到无水CeCl3,其中NH4Cl的作用是________ 。
(6)准确称取0.7500g CeCl3样品置于锥形瓶中,加入适量过硫酸铵[(NH4)2S2O8]溶液将Ce3+氧取化为Ce4+,然后用0.1000mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗25.00mL标准溶液.(已知:Fe2++Ce4+= Ce3++Fe3+)
①已知:过二硫酸的结构式为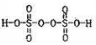 ,其中S元素的化合价为:
,其中S元素的化合价为:______ 。 过硫酸铵[(NH4)2S2O8]溶液将Ce3+氧化为Ce4+的离子方程式为:_____________ 。
②该样品中CeCl3的质量分数为____________ 。
③若使用久置的(NH4)2Fe(SO4)2标准溶液进行滴定,测得该CeCl3样品的质量分数将______ (填“偏大”、“偏小”或“无影响”)

请回答下列问题:
(1)CeCO3F中,Ce元素的化合价为
(2)酸浸过程中用稀硫酸和H2O2替换HCl不会造成环境污染。写出稀硫酸、H2O2与CeO2反应的离子方程式:
(3)向Ce(BF4)3为中加入KCl溶液的目的是
(4)若溶液中的Ce3+沉淀完全,此时溶液的pH为
(5)加热CeCl3·6H2O和NH4Cl的固体混合物可得到无水CeCl3,其中NH4Cl的作用是
(6)准确称取0.7500g CeCl3样品置于锥形瓶中,加入适量过硫酸铵[(NH4)2S2O8]溶液将Ce3+氧取化为Ce4+,然后用0.1000mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗25.00mL标准溶液.(已知:Fe2++Ce4+= Ce3++Fe3+)
①已知:过二硫酸的结构式为
 ,其中S元素的化合价为:
,其中S元素的化合价为:②该样品中CeCl3的质量分数为
③若使用久置的(NH4)2Fe(SO4)2标准溶液进行滴定,测得该CeCl3样品的质量分数将
您最近一年使用:0次
【推荐1】铋主要用于制造合金,铋合金具有凝固时不收缩的特性,用于铸造印刷铅字和高精度铸型。湿法提铋新工艺以氧化铋渣(主要成分为Bi2O3,含有PbO、Ag2O、CuO)为原料提取Bi的工艺流程如下:
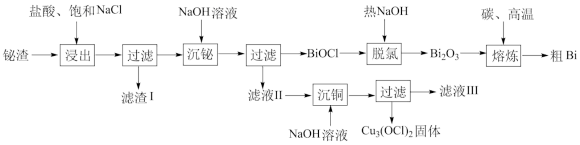
已知:Ⅰ.BiCl3可水解生成不溶于水的BiOCl
Ⅱ.25℃时,Ksp[Cu(OH)2]=1.2×10-20;Ksp(PbCl2)=1.17×10-5。
回答下列问题:
(1)“浸出”时,若c(HCl)=1mol/L时,铋的浸出率和Cl-浓度的关系如图所示,其中NaCl的作用是___________ ;若升高温度,反应相同的时间,铋的浸出率先升高后降低,则浸出率下降的主要原因可能是HCl挥发和___________ 。

(2)“滤渣Ⅰ”的成分为___________ (填化学式)。
(3)“脱氯”的化学方程式为___________ 。
(4)“沉铜”时向“滤液Ⅱ”中加入NaOH溶液,可促进Cu2+水解生成Cu3(OCl)2沉淀,请写出“沉铜”的离子方程式___________ 。若“滤液Ⅱ”中c(Cu2+)为0.01mol·L-1,常温下加入等体积的NaOH溶液使pH恰好为6时,出现Cu(OH)2沉淀,此时Cu2+的去除率为___________ (忽略溶液体积变化)。
(5)可循环利用的物质是___________ 。
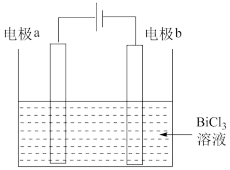
(6)粗铋可通过电解法进行精炼,其原理如图所示,其中电极a的材料是___________ ,电极b上发生的电极反应为___________ 。

已知:Ⅰ.BiCl3可水解生成不溶于水的BiOCl
Ⅱ.25℃时,Ksp[Cu(OH)2]=1.2×10-20;Ksp(PbCl2)=1.17×10-5。
回答下列问题:
(1)“浸出”时,若c(HCl)=1mol/L时,铋的浸出率和Cl-浓度的关系如图所示,其中NaCl的作用是

(2)“滤渣Ⅰ”的成分为
(3)“脱氯”的化学方程式为
(4)“沉铜”时向“滤液Ⅱ”中加入NaOH溶液,可促进Cu2+水解生成Cu3(OCl)2沉淀,请写出“沉铜”的离子方程式
(5)可循环利用的物质是
(6)粗铋可通过电解法进行精炼,其原理如图所示,其中电极a的材料是

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐2】高纯二氧化碳主要用于医学研究及临床诊断及电子工业;含碳的有机物醇、醛在生产生活中有广泛运用。
I.(1)工业上用CO2和H2在一定条件下反应可合成二甲醚,已知:
2CO2(g)+6H2(g)=2CH3OH(g)+2H2O(g) △H1=-107.4kJ/mol
2CH3OH(g)=CH3OCH3(g)+H2O(g) △H2=-23.4kJ/mol
则2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) △H3=
CH3OCH3(g)+3H2O(g) △H3=________ kJ/mol
(2)在一定条件下将CO2和H2充入一固定容积的密闭容器中,在两种不同温度下发生反应:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g),测得CH3OCH3(g)的物质的量随时间的变化如图所示。
CH3OCH3(g)+3H2O(g),测得CH3OCH3(g)的物质的量随时间的变化如图所示。

①曲线I、Ⅱ对应的平衡常数大小关系为KI_______ KⅡ(填“>”“=”或“<”)。
②一定温度下,下列能判断该反应达到化学平衡状态的是________ (填序号)。
a.混合气体密度不变
b.二甲醚和水蒸气的反应速率之比保持不变
c.v正(H2)=2v逆(H2O)
d.2个C=O断裂的同时有3个H-O断裂
(3)合成气CO和H2在一定条件下能发生如下反应:CO(g)+2H2(g) CH3OH(g) △H。在某压强下,合成甲醇的反应在不同温度、不同投料比时,CO的转化率如图所示。
CH3OH(g) △H。在某压强下,合成甲醇的反应在不同温度、不同投料比时,CO的转化率如图所示。
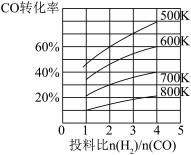
①600K温度下,将1molCO和4molH2充入2L的密闭容器中,5min后反应达到平衡状态,则0~5min内的平均反应速率v(H2)=___________ 。
②若投料比保持不变,升高温度,该反应平衡向_______ 方向移动(填“正反应”或“逆反应”)。
③上述合成甲醇的过程中提高CO的转化率可采取的措施有______ 。(列举一种即可)。
Ⅱ.用隔膜电解法处理高浓度乙醛废水的原理为:
使用惰性电极电解,乙醛分别在阴、阳极转化为乙醇和乙酸,总反应为:2CH3CHO+H2O CH3CH2OH+CH3COOH。实验室中,以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程。
CH3CH2OH+CH3COOH。实验室中,以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程。
①电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体,阳极产生气体的电极反应为:______ 。
②在实际工艺处理过程中,阴极区乙醛的去除率可达80%。若在两极区分别注入1m3乙醛含量为400mg/L的废水,可得到乙醇________ kg(计算结果保留2位小数)。
I.(1)工业上用CO2和H2在一定条件下反应可合成二甲醚,已知:
2CO2(g)+6H2(g)=2CH3OH(g)+2H2O(g) △H1=-107.4kJ/mol
2CH3OH(g)=CH3OCH3(g)+H2O(g) △H2=-23.4kJ/mol
则2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g) △H3=
CH3OCH3(g)+3H2O(g) △H3=(2)在一定条件下将CO2和H2充入一固定容积的密闭容器中,在两种不同温度下发生反应:2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g),测得CH3OCH3(g)的物质的量随时间的变化如图所示。
CH3OCH3(g)+3H2O(g),测得CH3OCH3(g)的物质的量随时间的变化如图所示。
①曲线I、Ⅱ对应的平衡常数大小关系为KI
②一定温度下,下列能判断该反应达到化学平衡状态的是
a.混合气体密度不变
b.二甲醚和水蒸气的反应速率之比保持不变
c.v正(H2)=2v逆(H2O)
d.2个C=O断裂的同时有3个H-O断裂
(3)合成气CO和H2在一定条件下能发生如下反应:CO(g)+2H2(g)
 CH3OH(g) △H。在某压强下,合成甲醇的反应在不同温度、不同投料比时,CO的转化率如图所示。
CH3OH(g) △H。在某压强下,合成甲醇的反应在不同温度、不同投料比时,CO的转化率如图所示。
①600K温度下,将1molCO和4molH2充入2L的密闭容器中,5min后反应达到平衡状态,则0~5min内的平均反应速率v(H2)=
②若投料比保持不变,升高温度,该反应平衡向
③上述合成甲醇的过程中提高CO的转化率可采取的措施有
Ⅱ.用隔膜电解法处理高浓度乙醛废水的原理为:
使用惰性电极电解,乙醛分别在阴、阳极转化为乙醇和乙酸,总反应为:2CH3CHO+H2O
 CH3CH2OH+CH3COOH。实验室中,以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程。
CH3CH2OH+CH3COOH。实验室中,以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程。①电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体,阳极产生气体的电极反应为:
②在实际工艺处理过程中,阴极区乙醛的去除率可达80%。若在两极区分别注入1m3乙醛含量为400mg/L的废水,可得到乙醇
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的NaCl溶液、AgNO3溶液、x溶液,a、b、c、d电极均为石墨电极 接通电源,经过一段时间后,乙中c电极质量增加
接通电源,经过一段时间后,乙中c电极质量增加 据此回答问题:
据此回答问题:
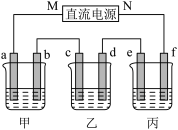
(1)电源的M端为_____________ 极;
(2)电极d上发生的电极反应式为__________ ; 乙池溶液PH__________ 填(“增大”、“减小”或“不变”)
(3)甲池中的总反应式为___________________________________ ;
(4)当电路中有0.04mol电子通过时,a、b、c、d电极上产生的气体或固体的物质的量之比是____________ ;
(5)若利用丙池实现铁上镀铜,则“e-f-x” 溶液是
溶液是__________________________ ;(要求e、f、x用具体物质回答,下同),若利用丙池实现电解精炼铜,则f电极材料是_______________________
(6) 实验测得, 1g甲醇(CH3OH)液体在氧气中充分燃烧生成二氧化碳气体和液态水时释放出22.68kJ的热量,则表示甲醇燃烧热的热化学方程式为:_____________________________________________________
(7)亚硝酸氯 结构式为
结构式为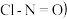 是有机合成中的重要试剂,可由
是有机合成中的重要试剂,可由 和
和 在通常反应条件下制得,反应方程式为
在通常反应条件下制得,反应方程式为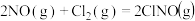 。已知几种化学键的键能数据如下表所示:
。已知几种化学键的键能数据如下表所示:
当 与NO反应生成ClNO的过程中转移了4mol电子,理论上放出的热量为
与NO反应生成ClNO的过程中转移了4mol电子,理论上放出的热量为______ kJ。(用数字和字母表示)
 接通电源,经过一段时间后,乙中c电极质量增加
接通电源,经过一段时间后,乙中c电极质量增加 据此回答问题:
据此回答问题: 
(1)电源的M端为
(2)电极d上发生的电极反应式为
(3)甲池中的总反应式为
(4)当电路中有0.04mol电子通过时,a、b、c、d电极上产生的气体或固体的物质的量之比是
(5)若利用丙池实现铁上镀铜,则“e-f-x”
 溶液是
溶液是(6) 实验测得, 1g甲醇(CH3OH)液体在氧气中充分燃烧生成二氧化碳气体和液态水时释放出22.68kJ的热量,则表示甲醇燃烧热的热化学方程式为:
(7)亚硝酸氯
 结构式为
结构式为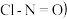 是有机合成中的重要试剂,可由
是有机合成中的重要试剂,可由 和
和 在通常反应条件下制得,反应方程式为
在通常反应条件下制得,反应方程式为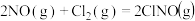 。已知几种化学键的键能数据如下表所示:
。已知几种化学键的键能数据如下表所示:| 化学键 | 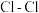 | 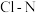 |  | 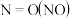 |
键能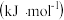 | 243 | a | 607 | 630 |
 与NO反应生成ClNO的过程中转移了4mol电子,理论上放出的热量为
与NO反应生成ClNO的过程中转移了4mol电子,理论上放出的热量为
您最近一年使用:0次



