解题方法
1 . 某学生用0.2000mol∙L-1氢氧化钠标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
A.移取20.00mL待测盐酸注入洁净的锥形瓶中,加入2~3滴酚酞试液;
B.用氢氧化钠标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液;
D.取氢氧化钠标准溶液注入碱式滴定管至“0”刻度以上2~3mL;
E.调节液面至“0”或“0”刻度以下,记下读数;
F.把锥形瓶放在滴定管下面,用氢氧化钠标准溶液滴定至终点并记下滴定管的读数。
请回答下列问题:
(1)正确操作步骤的顺序是_______ (填序号)。
(2)下列操作中,可能使所测盐酸浓度数值偏低的是_______ (填编号)。
A.碱式滴定管未用标准NaOH溶液润洗就直接注入标准NaOH溶液
B.滴定前盛放盐酸溶液的锥形瓶用蒸馏水洗净后没有干燥
C.滴定过程中振摇时有液滴溅出
D.读取NaOH溶液体积时,开始时仰视读数,滴定结束时俯视读数
E.碱式滴定管在滴定前有气泡,滴定后气泡消失
(3)判断到达滴定终点的实验现象是_______
(4)用标准的0.2000mol/LNaOH溶液滴定未知浓度的盐酸溶液,滴定结果如下表所示:
则该盐酸的物质的量浓度为_______ mol/L。
A.移取20.00mL待测盐酸注入洁净的锥形瓶中,加入2~3滴酚酞试液;
B.用氢氧化钠标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液;
D.取氢氧化钠标准溶液注入碱式滴定管至“0”刻度以上2~3mL;
E.调节液面至“0”或“0”刻度以下,记下读数;
F.把锥形瓶放在滴定管下面,用氢氧化钠标准溶液滴定至终点并记下滴定管的读数。
请回答下列问题:
(1)正确操作步骤的顺序是
(2)下列操作中,可能使所测盐酸浓度数值偏低的是
A.碱式滴定管未用标准NaOH溶液润洗就直接注入标准NaOH溶液
B.滴定前盛放盐酸溶液的锥形瓶用蒸馏水洗净后没有干燥
C.滴定过程中振摇时有液滴溅出
D.读取NaOH溶液体积时,开始时仰视读数,滴定结束时俯视读数
E.碱式滴定管在滴定前有气泡,滴定后气泡消失
(3)判断到达滴定终点的实验现象是
(4)用标准的0.2000mol/LNaOH溶液滴定未知浓度的盐酸溶液,滴定结果如下表所示:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 20.00mL | 0.02 | 25.01 |
| 2 | 20.00mL | 0.70 | 25.71 |
| 3 | 20.00mL | 0.50 | 24.20 |
您最近半年使用:0次
名校
解题方法
2 . 为完成下列相关实验,所选玻璃仪器和试剂均准确、完整的是(不考虑试剂存放容器)
| 实验目的 | 玻璃仪器 | 试剂 | |
| A | 配制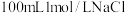 溶液 溶液 |  容量瓶、烧杯、量筒、玻璃棒 容量瓶、烧杯、量筒、玻璃棒 | 蒸馏水、 固体 固体 |
| B | 制备 胶体 胶体 | 烧杯、酒精灯、胶头滴管 | 蒸馏水、饱和 溶液 溶液 |
| C | 测定 待测液测定 待测液测定 待测液 待测液 | 烧杯、锥形瓶、胶头滴管、酸式滴定管 | 待测 溶液、盐酸标准液、紫色石蕊试液 溶液、盐酸标准液、紫色石蕊试液 |
| D | 实验室制氯气 | 分液漏斗、圆底烧瓶、导气管、洗气瓶(多个)、集气瓶 |  浓盐酸、掖、浓硫酸溶液、浓硫酸 浓盐酸、掖、浓硫酸溶液、浓硫酸 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
解题方法
3 . 电解二氧化锰具有高能量密度、长寿命、低自放电率等优点,被广泛应用于移动电源、电动汽车、无人机等领域。工业上利用碳酸锰矿(含碳酸亚铁及其它重金属化合物)通过一系列过程制备电解二氧化锰的原理如下:
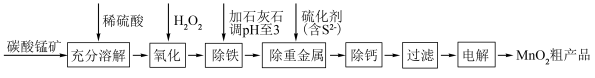
已知:在生产时对应温度下,有关物质的溶度积常数如下:
回答下列问题:
(1)为了加快碳酸锰矿的溶解,可采取的措施有___________ (答出一种即可)。
(2)氧化过程的目的是___________ 。
(3)从平衡移动的角度分析石灰石除铁的原理是___________ (结合方程式回答)。
(4)电解是在酸性环境下进行,生成二氧化锰的电极反应式为___________ 。
(5)电解时 的浓度和酸度会影响最后产品的质量。实验室可以用酸性高锰酸钾溶液通过滴定的方式测定过滤后溶液中
的浓度和酸度会影响最后产品的质量。实验室可以用酸性高锰酸钾溶液通过滴定的方式测定过滤后溶液中 的浓度,其原理为:
的浓度,其原理为: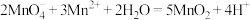
某同学进行了如下操作:取过滤后的溶液 ,稀释至
,稀释至 ,取
,取 稀释后的溶液于锥形瓶中,用浓度为
稀释后的溶液于锥形瓶中,用浓度为 溶液进行滴定,滴定终点时,用去的
溶液进行滴定,滴定终点时,用去的 溶液体积平均值为
溶液体积平均值为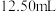 。
。
①滴定终点时的现象是___________
②经计算,此次实验测得的原过滤后溶液中 的浓度为
的浓度为___________ ;
③滴定终点后读数时发现滴定管尖嘴处有一个气泡,若其它环节无误,则此次实验测得的 浓度
浓度___________ (填“偏大”“偏小”或“不受影响”)。

已知:在生产时对应温度下,有关物质的溶度积常数如下:
| 物质 |  |  |
 |  | 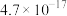 |
(1)为了加快碳酸锰矿的溶解,可采取的措施有
(2)氧化过程的目的是
(3)从平衡移动的角度分析石灰石除铁的原理是
(4)电解是在酸性环境下进行,生成二氧化锰的电极反应式为
(5)电解时
 的浓度和酸度会影响最后产品的质量。实验室可以用酸性高锰酸钾溶液通过滴定的方式测定过滤后溶液中
的浓度和酸度会影响最后产品的质量。实验室可以用酸性高锰酸钾溶液通过滴定的方式测定过滤后溶液中 的浓度,其原理为:
的浓度,其原理为: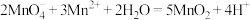
某同学进行了如下操作:取过滤后的溶液
 ,稀释至
,稀释至 ,取
,取 稀释后的溶液于锥形瓶中,用浓度为
稀释后的溶液于锥形瓶中,用浓度为 溶液进行滴定,滴定终点时,用去的
溶液进行滴定,滴定终点时,用去的 溶液体积平均值为
溶液体积平均值为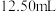 。
。①滴定终点时的现象是
②经计算,此次实验测得的原过滤后溶液中
 的浓度为
的浓度为③滴定终点后读数时发现滴定管尖嘴处有一个气泡,若其它环节无误,则此次实验测得的
 浓度
浓度
您最近半年使用:0次
名校
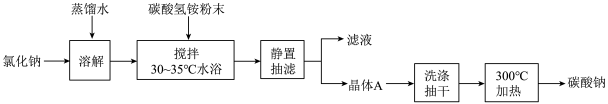
4 . 碳酸钠俗称纯碱,是一种重要的化工原料。以碳酸氢铵和氯化钠为原料制备碳酸钠,并测定产品中少量碳酸氢钠的含量,过程如下:
步骤Ⅰ. 的制备
的制备
步骤Ⅱ.产品中NaHCO3含量测定
①称取产品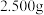 ,用蒸馏水溶解,定容于
,用蒸馏水溶解,定容于 容量瓶中;
容量瓶中;
②移取 上述溶液于锥形瓶,加入2滴指示剂M,用
上述溶液于锥形瓶,加入2滴指示剂M,用 盐酸标准溶液滴定,溶液由红色变至近无色(第一滴定终点),消耗盐酸
盐酸标准溶液滴定,溶液由红色变至近无色(第一滴定终点),消耗盐酸 ;
;
③在上述锥形瓶中再加入2滴指示剂N,继续用 盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸
盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸 ;
;
④平行测定三次, 平均值为
平均值为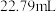 ,
, 平均值为
平均值为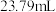 。
。
已知:(ⅰ)当温度超过35℃时, 开始分解。
开始分解。
(ⅱ)相关盐在不同温度下溶解度表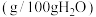
回答下列问题:
(1)步骤Ⅰ中晶体A的化学式为_______ ,晶体A能够析出的原因是_______ 。
(2)步骤Ⅰ中“300℃加热”发生的化学反应方程式是_______ 。
(3)指示剂N为_______ ,描述第二滴定终点前后颜色变化_______ 。
(4)产品中 的质量分数为
的质量分数为_______ (保留三位有效数字)。
(5)第一滴定终点时,某同学仰视读数,其他操作均正确,则 质量分数的计算结果
质量分数的计算结果_______ (填“偏大”“偏小”或“无影响”)。
步骤Ⅰ.
 的制备
的制备
步骤Ⅱ.产品中NaHCO3含量测定
①称取产品
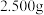 ,用蒸馏水溶解,定容于
,用蒸馏水溶解,定容于 容量瓶中;
容量瓶中;②移取
 上述溶液于锥形瓶,加入2滴指示剂M,用
上述溶液于锥形瓶,加入2滴指示剂M,用 盐酸标准溶液滴定,溶液由红色变至近无色(第一滴定终点),消耗盐酸
盐酸标准溶液滴定,溶液由红色变至近无色(第一滴定终点),消耗盐酸 ;
;③在上述锥形瓶中再加入2滴指示剂N,继续用
 盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸
盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸 ;
;④平行测定三次,
 平均值为
平均值为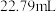 ,
, 平均值为
平均值为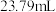 。
。已知:(ⅰ)当温度超过35℃时,
 开始分解。
开始分解。(ⅱ)相关盐在不同温度下溶解度表
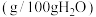
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
 | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
 | 11.9 | 15.8 | 21.0 | 27.0 | - | - | - |
 | 6.9 | 8.2 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 |
 | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 |
(1)步骤Ⅰ中晶体A的化学式为
(2)步骤Ⅰ中“300℃加热”发生的化学反应方程式是
(3)指示剂N为
(4)产品中
 的质量分数为
的质量分数为(5)第一滴定终点时,某同学仰视读数,其他操作均正确,则
 质量分数的计算结果
质量分数的计算结果
您最近半年使用:0次
名校
解题方法
5 . 常温下,向20mL0.1mol/L一元碱MOH溶液中滴加等浓度的一元酸HX溶液,滴定过程中溶液pH值的变化曲线如下图所示,已知4<m<6,下列说法不正确的是

| A.该滴定过程中应选用酚酞作指示剂 | B.一元酸HX的Ka=5×10-5 |
| C.溶液中水的电离程度:b>c>a | D.c点溶液中:c(M+)>c(X-)>c(H+)>c(OH-) |
您最近半年使用:0次
2024-01-15更新
|
321次组卷
|
3卷引用:湖南省常德市第一中学2023-2024学年高二上学期期末考试化学试题
湖南省常德市第一中学2023-2024学年高二上学期期末考试化学试题2024届陕西省宝鸡市高考模拟监测(一) 理科综合试题(已下线)专题07 水溶液中的离子反应与平衡-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)
名校
解题方法
6 . 磺酰氯( )是一种重要的有机合成试剂,也是锂电池正极活性物质。实验室可利用
)是一种重要的有机合成试剂,也是锂电池正极活性物质。实验室可利用 与
与 在活性炭作用下制取少量的
在活性炭作用下制取少量的 ,装置如下图所示(部分夹持装置已省略)。
,装置如下图所示(部分夹持装置已省略)。
已知:① 的熔点为
的熔点为 ,沸点为69.1℃,常温较稳定,100℃以上易分解。
,沸点为69.1℃,常温较稳定,100℃以上易分解。
②
 。
。
③ 遇水发生剧烈反应,并产生大量白雾。
遇水发生剧烈反应,并产生大量白雾。
回答下列问题:
(1)装置丙中发生反应的化学方程式为___________ 。
(2)仪器D的名称为___________ ,装置乙中盛放的试剂为___________ 。
(3)装置丙中橡胶管的作用是___________ ,仪器F的作用是___________ 。
(4)上述仪器的正确连接顺序是e→___________ →g,h←___________ ←f(填仪器接口字母编号,仪器可重复使用)。
(5)装置丁中应采取的控制温度的方式为___________ ,反应过程中控制其进气速率的方法是___________ 。
(6)测定市售磺酰氯的质量分数(杂质不参与反应),实验步骤如下:
取市售磺酰氯 ,溶于过量的
,溶于过量的

 标准溶液摇匀、静置2min后,将溶液转移至
标准溶液摇匀、静置2min后,将溶液转移至 容量瓶定容,取
容量瓶定容,取 溶液于
溶液于 锥形瓶中,再加入1~2滴酚酞试液,最后用
锥形瓶中,再加入1~2滴酚酞试液,最后用
 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 标准溶液的体积为
标准溶液的体积为 。请回答下列问题:
。请回答下列问题:
①滴定终点的判断方法是___________ 。
②该市售磺酰氯中 的质量分数表达式为
的质量分数表达式为___________ (用含有m、V的代数式表示,要求化简)。
 )是一种重要的有机合成试剂,也是锂电池正极活性物质。实验室可利用
)是一种重要的有机合成试剂,也是锂电池正极活性物质。实验室可利用 与
与 在活性炭作用下制取少量的
在活性炭作用下制取少量的 ,装置如下图所示(部分夹持装置已省略)。
,装置如下图所示(部分夹持装置已省略)。
已知:①
 的熔点为
的熔点为 ,沸点为69.1℃,常温较稳定,100℃以上易分解。
,沸点为69.1℃,常温较稳定,100℃以上易分解。②
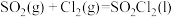
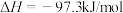 。
。③
 遇水发生剧烈反应,并产生大量白雾。
遇水发生剧烈反应,并产生大量白雾。回答下列问题:
(1)装置丙中发生反应的化学方程式为
(2)仪器D的名称为
(3)装置丙中橡胶管的作用是
(4)上述仪器的正确连接顺序是e→
(5)装置丁中应采取的控制温度的方式为
(6)测定市售磺酰氯的质量分数(杂质不参与反应),实验步骤如下:
取市售磺酰氯
 ,溶于过量的
,溶于过量的

 标准溶液摇匀、静置2min后,将溶液转移至
标准溶液摇匀、静置2min后,将溶液转移至 容量瓶定容,取
容量瓶定容,取 溶液于
溶液于 锥形瓶中,再加入1~2滴酚酞试液,最后用
锥形瓶中,再加入1~2滴酚酞试液,最后用
 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 标准溶液的体积为
标准溶液的体积为 。请回答下列问题:
。请回答下列问题:①滴定终点的判断方法是
②该市售磺酰氯中
 的质量分数表达式为
的质量分数表达式为
您最近半年使用:0次
名校
解题方法
7 . 室温下,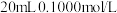 MOH用
MOH用 的盐酸滴定的曲线如图,下列说法正确的是
的盐酸滴定的曲线如图,下列说法正确的是
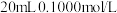 MOH用
MOH用 的盐酸滴定的曲线如图,下列说法正确的是
的盐酸滴定的曲线如图,下列说法正确的是
| A.该中和滴定最好选用酚酞作指示剂 |
| B.MOH为强碱 |
| C.当滴入盐酸达20 mL时,溶液中:c(H+)=c(MOH)+c(OH−) |
| D.当滴入盐酸达10 mL时, 存在关系:c(MOH)>c(Cl−)>c(M+)>c(OH−) |
您最近半年使用:0次
解题方法
8 . 次磷酸钠(NaH2PO2)是一种白色粉末,微溶于无水乙醇,不溶于乙醚,具有强还原性,酸性条件下易被氧化生成H3PO4.实验室使用白磷、熟石灰和碳酸钠溶液模拟工业制备两步法合成次磷酸钠晶体。
I.制备次磷酸钙[Ca(H2PO2)2]溶液:
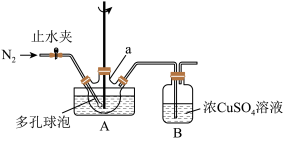
(1)实验前,经检验装置的气密性良好。其中仪器a的名称是_____ ;
(2)将一定量的白磷和过量的熟石灰依次投入仪器a中,加水调成稀浆状,搅拌下加热升温到90℃,至无PH3,气体放出时停止反应。则a中发生反应的化学方程式是_____ ;
II.制备次磷酸钠(NaH2PO2)溶液:
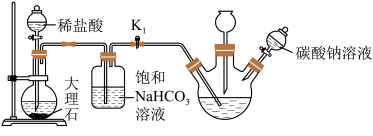
(3)过滤除去未反应的固体物质,然后通入二氧化碳,其目的是使溶解在滤液中的氢氧化钙转化成碳酸钙沉淀而除去,再向次磷酸钙溶液中加入碳酸钠溶液,判断次磷酸钙完全反应的方法是_____ ;
III.制备次磷酸钠晶体:
(4)过滤除去碳酸钙后将滤液蒸发浓缩,该操作需在_____ 条件下进行,再经过冷却结晶,制得次磷酸钠晶体。
IV.测定次磷酸钠纯度:
(5)测量步骤:称取8.8g样品溶于水配成25mL溶液置于锥形瓶中,再加盐酸25mL,准确加入c1mol∙L-1碘标准溶液V1mL,盖好瓶塞,放在暗处30min。打开瓶塞,用少量蒸馏水洗瓶颈及瓶塞后,以淀粉溶液作指示剂,用c2mol∙L-1硫代硫酸钠标准溶液进行滴定,消耗硫代硫酸钠溶液的体积为V2mL(已知I2+2Na2S2O3=Na2S4O6+2NaI)。
①判断达到滴定终点的现象是_____ ;
②晶体中NaH2PO2的质量分数是_____ (列出表达式)。
I.制备次磷酸钙[Ca(H2PO2)2]溶液:

(1)实验前,经检验装置的气密性良好。其中仪器a的名称是
(2)将一定量的白磷和过量的熟石灰依次投入仪器a中,加水调成稀浆状,搅拌下加热升温到90℃,至无PH3,气体放出时停止反应。则a中发生反应的化学方程式是
II.制备次磷酸钠(NaH2PO2)溶液:

(3)过滤除去未反应的固体物质,然后通入二氧化碳,其目的是使溶解在滤液中的氢氧化钙转化成碳酸钙沉淀而除去,再向次磷酸钙溶液中加入碳酸钠溶液,判断次磷酸钙完全反应的方法是
III.制备次磷酸钠晶体:
(4)过滤除去碳酸钙后将滤液蒸发浓缩,该操作需在
IV.测定次磷酸钠纯度:
(5)测量步骤:称取8.8g样品溶于水配成25mL溶液置于锥形瓶中,再加盐酸25mL,准确加入c1mol∙L-1碘标准溶液V1mL,盖好瓶塞,放在暗处30min。打开瓶塞,用少量蒸馏水洗瓶颈及瓶塞后,以淀粉溶液作指示剂,用c2mol∙L-1硫代硫酸钠标准溶液进行滴定,消耗硫代硫酸钠溶液的体积为V2mL(已知I2+2Na2S2O3=Na2S4O6+2NaI)。
①判断达到滴定终点的现象是
②晶体中NaH2PO2的质量分数是
您最近半年使用:0次
名校
9 . 已知常温时CH3COOH的电离平衡常数为Ka,该温度下向20mL0.1 mol/L CH3COOH溶液中逐滴加入0.1 mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法不正确 的是
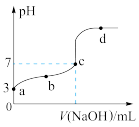

| A.d点表示的溶液中c(OH-)>c(H+) |
| B.该滴定实验可以用紫色石蕊试液做指示剂 |
| C.由图可知0.1 mol/L CH3COOH溶液pH=3 |
D.b、c点表示的溶液中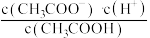 的值相等 的值相等 |
您最近半年使用:0次
2023-11-21更新
|
139次组卷
|
2卷引用:湖南省邵东市第三中学2023-2024学年高二上学期第三次月考化学试题
名校
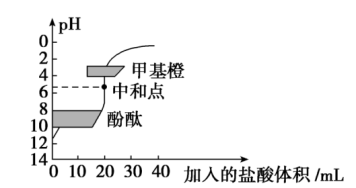
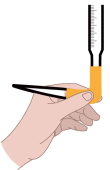
10 . 用0.1000mol/LNaOH溶液滴定20.00mL的稀醋酸,测定稀醋酸的浓度。下列说法错误的是

| A.润洗滴定管的方法:从滴定管上口加入3~5mL所要盛装的酸或碱,倾斜着转动滴定管,使液体润湿全部滴定管内壁,然后将液体从滴定管上口放入预置的烧杯中 |
| B.赶出碱式滴定管乳胶管中气泡的方法如图所示 |
| C.该滴定实验可选用酚酞作指示剂 |
| D.当加入半滴NaOH溶液后,溶液变色,立即读数,可能导致测定结果偏小 |
您最近半年使用:0次
2023-11-09更新
|
293次组卷
|
2卷引用:湖南省长沙市长郡中学2023-2024学年高二上学期期中考试化学试题



