名校
解题方法
1 . 电位滴定法是靠电极电位的突跃来指示滴定终点。在滴定过程中,计算机对数据自动采集、处理,并利用滴定反应化学计量点前后电位突变的特性,自动寻找滴定终点。室温时,用 的NaOH标准溶液滴定同浓度的
的NaOH标准溶液滴定同浓度的 溶液,计算机呈现的滴定曲线如图所示(稀溶液中不考虑氨水的分解导致氨的逸出)。已知
溶液,计算机呈现的滴定曲线如图所示(稀溶液中不考虑氨水的分解导致氨的逸出)。已知 。下列说法错误的是
。下列说法错误的是

 的NaOH标准溶液滴定同浓度的
的NaOH标准溶液滴定同浓度的 溶液,计算机呈现的滴定曲线如图所示(稀溶液中不考虑氨水的分解导致氨的逸出)。已知
溶液,计算机呈现的滴定曲线如图所示(稀溶液中不考虑氨水的分解导致氨的逸出)。已知 。下列说法错误的是
。下列说法错误的是
A.a点溶液中 |
B.b点溶液中 |
C.常温时,c点溶液中 |
D.b、d点水的电离程度: |
您最近一年使用:0次
2023-03-08更新
|
498次组卷
|
5卷引用:湖南省邵阳市2023届高三下学期第二次联考(二模)化学试题
湖南省邵阳市2023届高三下学期第二次联考(二模)化学试题湖南省邵阳市邵东市2022-2023学年高三下学期3月月考化学试题山东省曹县第一中学2022-2023学年高三下学期2月月考化学试题(已下线)山东省青岛市2023届高三下学期一模化学试题变式题(不定项选择题)(已下线)专题8 新概念应用
名校
解题方法
2 . I.某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂(指示剂加在待测液中)。请填写下列空白:
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视_______ ,直到_______ ,停止滴定。
(2)下列操作中可能使所测NaOH溶液的浓度偏高的是_______(填字母)。
(3)用0.1000mol/LNaOH溶液分别滴定0.1000mol/L的盐酸和醋酸溶液各25.00mL。滴定过程中溶液pH随滴入的NaOH溶液体积变化的两条滴定曲线如图所示:

滴定醋酸的曲线是_______ (填“I”或“II”),V1_______ V2。(填“>”“<”或“=”)
II.氧化还原滴定实验同中和滴定类似。人体缺乏维生素C(C6H8O6)易得坏血病。维生素C易被空气氧化。在新鲜的水果、蔬菜、乳制品中都富含维生素C,新鲜橙汁中维生素C的含量在500mg•L-1左右。某课外活动小组测定了某品牌的软包装橙子中维生素C的含量。下面是测定实验分析报告
i.测定目的:测定××牌软包装橙汁维生素的含量,是否为纯天然
ii.测定原理:C6H8O6+I2=C6H6O6+2H++2I-
iii.实验过程:
①移取20.00mL饮料样品于250mL锥形瓶中,加入50mL蒸馏水,2mL指示剂
②在滴定管中装入7.50×10-3mol·L-1标准碘溶液,滴定至终点,读取并记录相关数据
③重复测定3次,数据记录如下表
(4)回答下列问题:
①实验选择选用_______ 作指示剂
②计算该饮料样品中维生素C含量为_______ mg•L-1.该饮料_______ (填“是”或“不是”)鲜榨橙汁。(已知维生素C的摩尔质量为176g/mol)
③滴定时不能剧烈摇动锥形瓶原因是_______ 。
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视
(2)下列操作中可能使所测NaOH溶液的浓度偏高的是_______(填字母)。
| A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸 |
| B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| C.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| D.读取盐酸溶液体积时,开始仰视读数,滴定结束时俯视读数 |

滴定醋酸的曲线是
II.氧化还原滴定实验同中和滴定类似。人体缺乏维生素C(C6H8O6)易得坏血病。维生素C易被空气氧化。在新鲜的水果、蔬菜、乳制品中都富含维生素C,新鲜橙汁中维生素C的含量在500mg•L-1左右。某课外活动小组测定了某品牌的软包装橙子中维生素C的含量。下面是测定实验分析报告
i.测定目的:测定××牌软包装橙汁维生素的含量,是否为纯天然
ii.测定原理:C6H8O6+I2=C6H6O6+2H++2I-
iii.实验过程:
①移取20.00mL饮料样品于250mL锥形瓶中,加入50mL蒸馏水,2mL指示剂
②在滴定管中装入7.50×10-3mol·L-1标准碘溶液,滴定至终点,读取并记录相关数据
③重复测定3次,数据记录如下表
| 第一次 | 第二次 | 第三次 | |
| 滴定前读数/mL | 0.00 | 0.44 | 1.33 |
| 滴定后读数/mL | 15.01 | 15.44 | 15.32 |
①实验选择选用
②计算该饮料样品中维生素C含量为
③滴定时不能剧烈摇动锥形瓶原因是
您最近一年使用:0次
2023-02-02更新
|
152次组卷
|
3卷引用:湖南省株洲市第一中学2021届高三下学期第三次模拟检测化学试题
3 . 25℃时,用 气体调节
气体调节 氨水的
氨水的 ,溶液中微粒浓度的对数值(
,溶液中微粒浓度的对数值(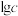 )、反应物的物质的量之比[
)、反应物的物质的量之比[ ]与
]与 的关系如图所示。若忽略通入气体后溶液体积的变化,下列有关说法正确的是
的关系如图所示。若忽略通入气体后溶液体积的变化,下列有关说法正确的是

 气体调节
气体调节 氨水的
氨水的 ,溶液中微粒浓度的对数值(
,溶液中微粒浓度的对数值(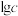 )、反应物的物质的量之比[
)、反应物的物质的量之比[ ]与
]与 的关系如图所示。若忽略通入气体后溶液体积的变化,下列有关说法正确的是
的关系如图所示。若忽略通入气体后溶液体积的变化,下列有关说法正确的是
A.25℃时, 的电离平衡常数为 的电离平衡常数为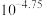 |
B. 所示溶液中: 所示溶液中: |
C. 所示溶液中: 所示溶液中: |
D. 所示溶液中: 所示溶液中: |
您最近一年使用:0次
名校
4 . 常温下,用0.10mol/L的NaOH溶液滴定0.10mol/L的HA溶液,滴定曲线如图a所示,混合溶液的pH与离子浓度变化的关系如图b所示。下列叙述错误的是


| A.Ka(HA)的数量级约为10-5 |
B.N点,c(Na+)-c(A-)=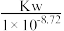 |
| C.P→Q过程中,水的电离程度逐渐减小 |
| D.当滴定至溶液呈中性时,c(A-)>c(HA) |
您最近一年使用:0次
名校
解题方法
5 . 实验小组用双指示剂法准确测定 样品(杂质为
样品(杂质为 )的纯度。步骤如下:
)的纯度。步骤如下:
①称取m g样品,配制成100mL溶液;
②取出25mL溶液置于锥形瓶中,加入2滴酚酞溶液,用浓度为 的盐酸滴定至溶液恰好褪色(溶质为
的盐酸滴定至溶液恰好褪色(溶质为 和
和 ),消耗盐酸体积为
),消耗盐酸体积为 ;
;
③滴入2滴甲基橙溶液,继续滴定至终点,消耗盐酸体积为 。
。
下列说法正确的是
 样品(杂质为
样品(杂质为 )的纯度。步骤如下:
)的纯度。步骤如下:①称取m g样品,配制成100mL溶液;
②取出25mL溶液置于锥形瓶中,加入2滴酚酞溶液,用浓度为
 的盐酸滴定至溶液恰好褪色(溶质为
的盐酸滴定至溶液恰好褪色(溶质为 和
和 ),消耗盐酸体积为
),消耗盐酸体积为 ;
;③滴入2滴甲基橙溶液,继续滴定至终点,消耗盐酸体积为
 。
。下列说法正确的是
| A.①中配制溶液时,需在容量瓶中加入100mL水 |
B.②中溶液恰好褪色时: |
C. 样品纯度为 样品纯度为 |
| D.配制溶液时放置时间过长,会导致最终测定结果偏高 |
您最近一年使用:0次
2022-04-01更新
|
1415次组卷
|
15卷引用:湖南省武冈市第一中学2021-2022学年高三下学期第三次模拟考试化学试题
湖南省武冈市第一中学2021-2022学年高三下学期第三次模拟考试化学试题北京市海淀区2022届高三一模化学试题湖南省长沙市第一中学2022-2023学年高三上学期月考卷(五)化学试题(已下线)第05讲 物质的量浓度及溶液配制 (练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)微专题45 定量测量类综合实验-备战2023年高考化学一轮复习考点微专题山东聊城第二中学2022-2023学年高三上学期期中考试化学试题(已下线)北京市海淀区2022届高三一模(选择题11-14)辽宁省本溪市高级中学2022-2023学年高三上学期期中测试化学试题(已下线)2023年高考山东卷化学真题变式题(选择题6-10)(已下线)第2讲 物质的浓度及溶液配制天津市南开中学2023-2024学年高三上学期统练5化学试题北京市第一○一中学2023-2024学年高二上学期12月统练四化学试题北京市第一○一中学2023-2024学年高二上学期12月统练四化学试题吉林省通化市梅河口市第五中学2023-2024学年高二上学期1月期末化学试题辽宁省葫芦岛市第一高级中学2023-2024学年高二上学期化学期末复习提升卷
名校
6 . 常温下用0.10 mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.10mol·L-1CH3COOH(Ka=1.75×10-5)溶液和HCN(Ka=4.9×10-10)溶液所得滴定曲线如图。下列说法正确的是


| A.曲线I和曲线II分别代表的是CH3COOH和HCN |
| B.点③和点④所示溶液中由水电离出的c(H+): ③>④ |
C.点①和点②所示溶液中: |
D.在点②和③之间(不包括端点)存在关系: (A-代表溶液中的酸根离子) (A-代表溶液中的酸根离子) |
您最近一年使用:0次
2021-09-07更新
|
588次组卷
|
5卷引用:2021年湖南省高考化学试卷变式题1-10
名校
7 . 常温下,用0.1mol·L-1NaOH溶液滴定40mL0.1mol·L-1H2SO3溶液,所得滴定曲线如图所示(忽略混合时溶液体积的变化)。下列叙述错误的是


| A.可求出Ka1(H2SO3)、Ka2(H2SO3)的值 |
| B.滴定中两次反应终点可依次用甲基橙、酚酞作指示剂 |
C.图中Y点对应的溶液中3c(SO )=c(Na+)+c(H+)-c(OH-) )=c(Na+)+c(H+)-c(OH-) |
D.图中Z点对应的溶液中:c(Na+)>c(SO )>c(HSO )>c(HSO )>c(OH-) )>c(OH-) |
您最近一年使用:0次
2021-06-12更新
|
626次组卷
|
6卷引用:湖南省怀化市第三中学2022届高三下学期第三次模拟预测化学试题
湖南省怀化市第三中学2022届高三下学期第三次模拟预测化学试题(已下线)【一飞冲天】8.宝坻一中三模(已下线)第八章能力提升检测卷(精练)-2022年高考化学一轮复习讲练测宁夏银川一中2021-2022学年高二上学期期中考试化学试题(已下线)专题26 盐类的水解(限时精炼)-2022年高三毕业班化学常考点归纳与变式演练(已下线)第31练 水的电离和溶液的pH-2023年高考化学一轮复习小题多维练(全国通用)
名校
解题方法
8 . ROH是一种一元碱,25℃时,在20.0mL0.1mol·L-1ROH溶液中滴加0.1mol·L-1盐酸VmL,混合溶液的pH与lg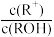 的关系如图所示。下列说法不正确的是
的关系如图所示。下列说法不正确的是

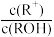 的关系如图所示。下列说法不正确的是
的关系如图所示。下列说法不正确的是
| A.a点时,V=10.0 |
| B.b点时,x=3.75 |
| C.b点溶液中,c(ROH)>c(R+) |
| D.c点溶液中,c(Cl-)>c(R+)>c(H+)>c(OH-) |
您最近一年使用:0次
解题方法
9 . 常温时,采用甲基橙和酚酞双指示剂,用盐酸滴定 溶液﹐溶液中
溶液﹐溶液中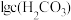 、
、 、
、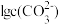 、
、 、
、 随溶液pH的变化及滴定曲线如图所示:
随溶液pH的变化及滴定曲线如图所示:

下列说法不正确的是
 溶液﹐溶液中
溶液﹐溶液中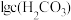 、
、 、
、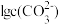 、
、 、
、 随溶液pH的变化及滴定曲线如图所示:
随溶液pH的变化及滴定曲线如图所示:
下列说法不正确的是
| A.整个滴定过程中可先用酚酞再用甲基橙作指示剂 |
| B.n点的pH为m点和q点pH的平均值 |
C.r点溶液中: |
| D.r点到k点对应的变化过程中,溶液中水的电离程度先减小后增大 |
您最近一年使用:0次
2021-05-20更新
|
563次组卷
|
2卷引用:湖南省永州市省重点中学2021届高三5月联考化学试题
名校
解题方法
10 . 电位滴定是利用溶液电位突变指示终点的滴定法。常温下,用cmol·L−1HCl标准溶液测定VmL某生活用品中Na2CO3的含量(假设其它物质均不反应,且不含碳、钠元素),得到滴定过程中溶液电位与V(HCl)的关系如图所示。已知:两个滴定终点时消耗盐酸的体积差可计算出Na2CO3的量。
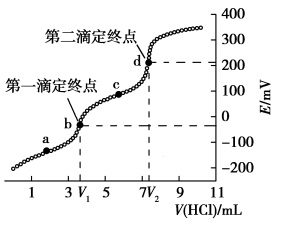
下列说法正确的是

下列说法正确的是
A.a至c点对应溶液中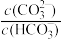 逐渐增大 逐渐增大 |
| B.水的电离程度:a>b>d>c |
C.a溶液中存在:c(Na+)+c(H+)=c( )+2c( )+2c( )+c(OH−) )+c(OH−) |
| D.VmL生活用品中含有Na2CO3的质量为0.106c(V2−V1)g |
您最近一年使用:0次
2021-05-14更新
|
1902次组卷
|
15卷引用:2021年湖南省高考化学试卷变式题1-10
2021年湖南省高考化学试卷变式题1-10湖南师范大学附属中学2021-2022学年高三下学期高考模拟(一)化学试题(已下线)化学-学科网2021年高三5月大联考(新课标Ⅰ卷)(已下线)化学-学科网2021年高三5月大联考(新课标Ⅲ卷)(已下线)2021年高考化学押题预测卷(广东卷)(03)(已下线)化学-学科网2021年高三5月大联考(新课标Ⅱ卷)辽宁省东北育才学校高中部高三2021-2022下学期开学初第六次模拟考试化学试题福建省龙岩第一中学2022届高三毕业班模拟训练(二)化学试题湖南省岳阳县第一中学2022届高三下学期5月月考化学试题江西省南昌市八一中学2022届高三下学期第三次模拟考试理科综合化学试题(已下线)专题19 沉淀溶解平衡的图像问题分析-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)辽宁省沈阳市第五中学2021-2022学年高三下学期3月月考化学试题(已下线)押新高考卷13题 水溶液中的离子平衡-备战2022年高考化学临考题号押题(新高考通版)辽宁省沈阳市第二中学2022-2023学年高三上学期12月阶段测试化学试题巩固训练10



