名校
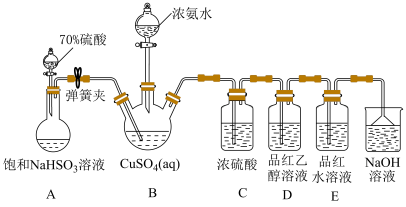
1 . NH4CuSO3(亚硫酸亚铜铵)是一种白色难溶于水、难溶于酒精的化工产品。某小组设计如下实验装置制备NH4CuSO3并探究SO2的漂白性。
ⅱ.然后向三颈烧瓶中通入SO2直至不再产生白色沉淀;
ⅲ.反应完毕后,将装置B中混合物过滤、酒精洗涤、干燥,即得成品。
已知:实验中还观察到装置D中溶液无明显现象,装置E中溶液红色褪去。
请回答下列问题:
(1)检查装置A气密性的操作方法为_____ 。
(2)装置C的目的是_____ 。
(3)实验步骤ⅱ中生成白色沉淀的离子方程式为_____ 。
(4)实验步骤ⅲ中用酒精替代水洗涤的优点是_____ 。
(5)为探究装置D、E中实验现象,化学兴趣小组对装置E中品红褪色的原因猜想如下:
猜想ⅰ:甲同学认为使品红褪色的微粒主要是 ;
;
猜想ⅱ:乙同学认为使品红褪色的微粒主要是 ;。
;。
为了验证猜想ⅰ和ⅱ,进行以下实验:
将10mL品红水溶液分成两份,在两份溶液中分别加入0.1mol·L-1的_____ 溶液(填化学式,下同)和0.1mol·L-1_____ 溶液,发现前者褪色快,后者褪色慢,说明上述猜想i比ⅱ合理。
(6)测定产品中 的含量:称取0.4200g样品,加入足量的NaOH浓溶液,充分加热,生成的气体用20.00mL0.1000mol·L-1H2SO4溶液全部吸收,用0.0900mol·L-1标准NaOH溶液滴定过量的H2SO4,消耗NaOH溶液22.00mL,则样品中NH4CuSO3的质量分数是
的含量:称取0.4200g样品,加入足量的NaOH浓溶液,充分加热,生成的气体用20.00mL0.1000mol·L-1H2SO4溶液全部吸收,用0.0900mol·L-1标准NaOH溶液滴定过量的H2SO4,消耗NaOH溶液22.00mL,则样品中NH4CuSO3的质量分数是_____ %(结果保留三位有效数字)。下列操作使测得的NH4CuSO3质量分数偏大的为_____ (填字母)。
a.滴定前仰视滴定管读数,滴定后读数正确
b.NaOH标准溶液使用前敞口放置于空气中一段时间
c.滴定结束读数时,发现滴定管尖嘴处还悬有一滴标准氢氧化钠溶液
d.用H2SO4溶液吸收NH3操作缓慢,导致部分NH3外逸到空气中
ⅱ.然后向三颈烧瓶中通入SO2直至不再产生白色沉淀;
ⅲ.反应完毕后,将装置B中混合物过滤、酒精洗涤、干燥,即得成品。
已知:实验中还观察到装置D中溶液无明显现象,装置E中溶液红色褪去。
请回答下列问题:
(1)检查装置A气密性的操作方法为
(2)装置C的目的是
(3)实验步骤ⅱ中生成白色沉淀的离子方程式为
(4)实验步骤ⅲ中用酒精替代水洗涤的优点是
(5)为探究装置D、E中实验现象,化学兴趣小组对装置E中品红褪色的原因猜想如下:
猜想ⅰ:甲同学认为使品红褪色的微粒主要是
 ;
;猜想ⅱ:乙同学认为使品红褪色的微粒主要是
 ;。
;。为了验证猜想ⅰ和ⅱ,进行以下实验:
将10mL品红水溶液分成两份,在两份溶液中分别加入0.1mol·L-1的
(6)测定产品中
 的含量:称取0.4200g样品,加入足量的NaOH浓溶液,充分加热,生成的气体用20.00mL0.1000mol·L-1H2SO4溶液全部吸收,用0.0900mol·L-1标准NaOH溶液滴定过量的H2SO4,消耗NaOH溶液22.00mL,则样品中NH4CuSO3的质量分数是
的含量:称取0.4200g样品,加入足量的NaOH浓溶液,充分加热,生成的气体用20.00mL0.1000mol·L-1H2SO4溶液全部吸收,用0.0900mol·L-1标准NaOH溶液滴定过量的H2SO4,消耗NaOH溶液22.00mL,则样品中NH4CuSO3的质量分数是a.滴定前仰视滴定管读数,滴定后读数正确
b.NaOH标准溶液使用前敞口放置于空气中一段时间
c.滴定结束读数时,发现滴定管尖嘴处还悬有一滴标准氢氧化钠溶液
d.用H2SO4溶液吸收NH3操作缓慢,导致部分NH3外逸到空气中
您最近一年使用:0次
解题方法
2 . 下列实验基本操作错误的是
| A.测定未知NaOH溶液浓度时,酸式滴定管需用标准酸液润洗2~3次 |
| B.硫酸铜结晶水含量测定时,需用小火缓慢加热,防止晶体飞溅 |
| C.滴定时,左手控制活塞,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管中的液面 |
| D.配制0.1 mol·L-1 H2SO4溶液时,将浓H2SO4沿杯壁倒入加有水的烧杯中稀释 |
您最近一年使用:0次
3 . 室温下,用标准液0.01mol·L-1NaOH溶液滴定20.00ml0.01mol·L-1H2C2O4(二元弱酸)溶液,在滴定过程中有关说法正确的是
A.当标准液滴到10.00mL时,溶液中存在[Na+]=[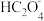 ] ] |
| B.滴定终点时,水电离的氢离子浓度为10-7mol·L-1 |
| C.pH=2的H2C2O4溶液中水电离的[H+]大于0.01mol·L-1NaOH溶液中水电离的[H+] |
D.滴定过程中始终存在[Na+]+[H+]=[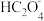 ]+2[ ]+2[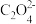 ]+[OH-] ]+[OH-] |
您最近一年使用:0次
2023-04-12更新
|
240次组卷
|
3卷引用:上海市嘉定区2022~2023学年高三下学期二模考试化学试题
名校
4 . 硫代硫酸钠(Na2S2O3)是常见的分析试剂,临床上用于氰化物解毒。实验室制备Na2S2O3溶液的装置如图(部分装置省略,C中Na2SO3过量):

完成下列填空:
(1)Na2S2O3解毒氰化物原理:S2O +CN-→SCN-+SO
+CN-→SCN-+SO 。为检验该转化生成了SCN-,取反应后的少量溶液,先加入足量的盐酸,再加入
。为检验该转化生成了SCN-,取反应后的少量溶液,先加入足量的盐酸,再加入__ ,观察到的现象是__ 。
(2)装置A制取SO2的反应,体现了70%浓硫酸的__ 性,装置B的作用是__ 。
(3)装置C中的反应分两步。第二步反应为S+Na2SO3→Na2S2O3,写出第一步反应的化学方程式__ 。当观察到装置C中溶液__ ,说明反应已完全。
样品中Na2S2O3·5H2O(M=248g·mol-1)的含量可用K2Cr2O7标准溶液测定(杂质不参与反应),步骤如下:
①取0.0100mol·L-1的K2Cr2O7溶液20.00mL,用硫酸酸化后,加入过量KI;
②用0.400g样品配制的溶液滴定步骤①所得溶液至淡黄绿色,再加入淀粉溶液,继续滴定至终点时,恰好将样品溶液消耗完全。
步骤①、②中发生的反应分别为:Cr2O +6I-+14H+→2Cr3++3I2+7H2O,I2+2S2O
+6I-+14H+→2Cr3++3I2+7H2O,I2+2S2O →2I-+S4O
→2I-+S4O 。
。
(4)判断步骤②的滴定终点__ 。
(5)样品中Na2S2O3·5H2O的质量分数为__ ;若样品中含Na2SO3杂质,则所测Na2S2O3·5H2O的含量__ (选填“偏高”或“偏低”)。

完成下列填空:
(1)Na2S2O3解毒氰化物原理:S2O
 +CN-→SCN-+SO
+CN-→SCN-+SO 。为检验该转化生成了SCN-,取反应后的少量溶液,先加入足量的盐酸,再加入
。为检验该转化生成了SCN-,取反应后的少量溶液,先加入足量的盐酸,再加入(2)装置A制取SO2的反应,体现了70%浓硫酸的
(3)装置C中的反应分两步。第二步反应为S+Na2SO3→Na2S2O3,写出第一步反应的化学方程式
样品中Na2S2O3·5H2O(M=248g·mol-1)的含量可用K2Cr2O7标准溶液测定(杂质不参与反应),步骤如下:
①取0.0100mol·L-1的K2Cr2O7溶液20.00mL,用硫酸酸化后,加入过量KI;
②用0.400g样品配制的溶液滴定步骤①所得溶液至淡黄绿色,再加入淀粉溶液,继续滴定至终点时,恰好将样品溶液消耗完全。
步骤①、②中发生的反应分别为:Cr2O
 +6I-+14H+→2Cr3++3I2+7H2O,I2+2S2O
+6I-+14H+→2Cr3++3I2+7H2O,I2+2S2O →2I-+S4O
→2I-+S4O 。
。(4)判断步骤②的滴定终点
(5)样品中Na2S2O3·5H2O的质量分数为
您最近一年使用:0次
2021-12-27更新
|
645次组卷
|
5卷引用:上海市金山区2022届高三一模化学试题
上海市金山区2022届高三一模化学试题辽宁省抚顺市第一中学2021-2022学年(2023届)高三一轮6月份模拟检测化学试题(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)浙江省温州市普通高中2023届高三下学期第二次适应性考试化学试题变式题(实验探究题)
名校
5 . “绿色化学”是化工生产中的重要理念。下图为利用尿素工厂废气以及磷肥工厂废渣(液)联合生产硫酸铵的工艺流程。
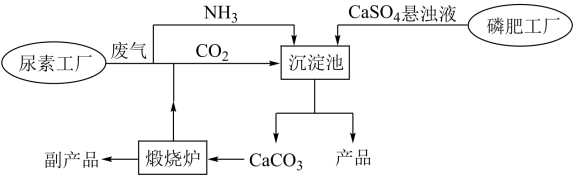
完成下列填空:
(1)沉淀池中发生反应的化学方程式为___________ 。已知硫酸铵溶解度变化趋势与氯化钠相似,则从沉淀池中获得产品的操作包含___________ 、___________ 、洗涤、烘干等。
(2)流程中体现“绿色化学”理念的设计有___________ 、___________ 等。
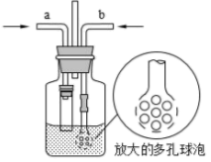
(3)为在实验室模拟沉淀池中的反应,设计了如图所示的装置,导管a下端连接粗管的目的是___________ ;导管b下端使用多孔球泡的目的是___________ 。
可用甲醛法测定所得 样品中氮的质量分数。其反应原理可以表示为:
样品中氮的质量分数。其反应原理可以表示为:
 [已知:
[已知: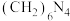 不与NaOH反应]
不与NaOH反应]
实验过程:称取样品1.500g,溶解配制成250mL溶液,取25.00mL样品溶液于锥形瓶中,加入过量的甲醛溶液,摇匀、静置5min后,加入1~2滴甲基橙试液,用NaOH标准溶液滴定至终点。
(4)终点的判断依据是___________ 。
(5)已知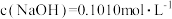 ,消耗氢氧化钠溶液20.00mL,则所得硫酸铵样品中氮的质量分数为
,消耗氢氧化钠溶液20.00mL,则所得硫酸铵样品中氮的质量分数为___________ 。(保留4位小数),实验测得硫酸铵样品中氮的质量分数略高,原因可能是___________ 。
a.甲醛被氧化 b.没有进行平行实验
c.氢氧化钠溶液久置变质 d.锥形瓶没有用待测液润洗

完成下列填空:
(1)沉淀池中发生反应的化学方程式为
(2)流程中体现“绿色化学”理念的设计有
(3)为在实验室模拟沉淀池中的反应,设计了如图所示的装置,导管a下端连接粗管的目的是

可用甲醛法测定所得
 样品中氮的质量分数。其反应原理可以表示为:
样品中氮的质量分数。其反应原理可以表示为: [已知:
[已知: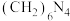 不与NaOH反应]
不与NaOH反应]实验过程:称取样品1.500g,溶解配制成250mL溶液,取25.00mL样品溶液于锥形瓶中,加入过量的甲醛溶液,摇匀、静置5min后,加入1~2滴甲基橙试液,用NaOH标准溶液滴定至终点。
(4)终点的判断依据是
(5)已知
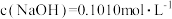 ,消耗氢氧化钠溶液20.00mL,则所得硫酸铵样品中氮的质量分数为
,消耗氢氧化钠溶液20.00mL,则所得硫酸铵样品中氮的质量分数为a.甲醛被氧化 b.没有进行平行实验
c.氢氧化钠溶液久置变质 d.锥形瓶没有用待测液润洗
您最近一年使用:0次
2021-04-20更新
|
349次组卷
|
4卷引用:上海市浦东新区2021届高三二模化学试题
上海市浦东新区2021届高三二模化学试题(已下线)化学-2022年高考押题预测卷02(上海卷)(含考试版、全解全析、参考答案、答题卡)上海市宝山区行知中学-2021-2022学年高三下学期3月月考化学试题(已下线)押全国卷理综第27题 工业流程-备战2021年高考化学临考题号押题(课标全国卷)
解题方法
6 . 有关酸碱滴定实验,下列说法的正确的是
| A.滴定管和锥形瓶都需要使用蒸馏水和待装液润洗 |
| B.滴定前,必须将滴定管中液体的液面调至0刻度 |
| C.滴定至终点时,溶液一定呈中性 |
| D.测定待测液的浓度,至少需要完成两组平行实验,取消耗标准液的平均值 |
您最近一年使用:0次
解题方法
7 . 实验室可用二氧化锰和浓盐酸共热制取氯气。为了证明得到的氯气中含氯化氢,并测定氯化氢的含量进行了下列实验。请回答:
(1)向饱和NaCl溶液中滴入少量浓盐酸,会有白色晶体析出,该晶体的化学式是_____ 。
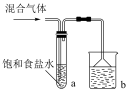
(2)按如图装置,将所得气体通入后,试管内白色晶体析出,能否证明氯气中含有HCl,说明理由_____ 。b装置的作用是_____ 。
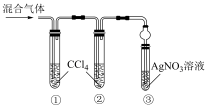
(3)已知氯气易溶于CCl4,按图中装置实验试管③中有白色沉淀,能够证明含HCl,说明理由_____ 。用浓盐酸与二氧化锰加热经干燥得到1.12L(标况下)气体,除去Cl2后,用水全部吸收并定容至100mL,再通过滴定测HCl气体含量。
(4)定容所需要仪器有烧杯、玻璃棒、________ 和_____ 。
(5)取定容后溶液20.00mL,加入2滴酚酞试液,用0.0250mol/L标准NaOH溶液滴定,当______ 即为滴定终点,消耗NaOH溶液19.20mL,则得到的气体中氯化氢的体积含量是______ 。
(1)向饱和NaCl溶液中滴入少量浓盐酸,会有白色晶体析出,该晶体的化学式是
(2)按如图装置,将所得气体通入后,试管内白色晶体析出,能否证明氯气中含有HCl,说明理由

(3)已知氯气易溶于CCl4,按图中装置实验试管③中有白色沉淀,能够证明含HCl,说明理由

(4)定容所需要仪器有烧杯、玻璃棒、
(5)取定容后溶液20.00mL,加入2滴酚酞试液,用0.0250mol/L标准NaOH溶液滴定,当
您最近一年使用:0次
2011·上海·零模
名校
解题方法
8 . 二甲酸钾是一种白色晶体,商品名为弗米(Formil),是一种能替代抗生素的促生长剂,化学式为KH(HCOO)2,具有吸湿性,易溶于水。
二甲酸钾的生产工艺流程如下:
(1)以甲酸和碳酸钾为原料生产二甲酸钾,实验测得反应条件对产品回收率的影响如下:

表1 反应温度对产品回收率的影响
表2 反应物料比对产品回收率的影响
备注:表2中反应物料比为甲酸和无水碳酸钾的物质的量之比。
①写出甲酸和碳酸钾生产二甲酸钾的化学方程式:______________________ 。
②实际生产二甲酸钾时应选择的最佳反应条件是反应温度应控制在____ ℃~____ ℃,反应物料比应选择______ 。由表1可知反应温度过高,反应回收率反而会降低,其原因可能是________________
③蒸发结晶后需进行的操作步骤是_________ 、_________ 。
(2)测定某弗米产品纯度的实验方法如下:称取该弗米产品2.5g,将其全部溶解在水中,配制成250mL未知浓度的溶液,取出25.00mL于锥形瓶中,再滴加2~3滴指示剂,用0.10mol·L-1的NaOH溶液滴定至终点,消耗NaOH溶液的体积为18.50mL。
①加入的指示剂是___________ (选填“甲基橙”、“石蕊”或“酚酞”),用NaOH溶液滴定至终点的现象是_______________________________________ 。
②上述弗米产品中二甲酸钾的质量分数为_________ 。
二甲酸钾的生产工艺流程如下:
(1)以甲酸和碳酸钾为原料生产二甲酸钾,实验测得反应条件对产品回收率的影响如下:

表1 反应温度对产品回收率的影响
| 反应温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 产品回收率(%) | 75.6 | 78.4 | 80.6 | 82.6 | 83.1 | 82.1 | 73.7 |
| 反应物料比 | 2∶1 | 3∶1 | 4∶1 | 5∶1 | 6∶1 | 7∶1 |
| 产品回收率(%) | 0 | 38.4 | 82.6 | 83.6 | 84.5 | 84.8 |
①写出甲酸和碳酸钾生产二甲酸钾的化学方程式:
②实际生产二甲酸钾时应选择的最佳反应条件是反应温度应控制在
③蒸发结晶后需进行的操作步骤是
(2)测定某弗米产品纯度的实验方法如下:称取该弗米产品2.5g,将其全部溶解在水中,配制成250mL未知浓度的溶液,取出25.00mL于锥形瓶中,再滴加2~3滴指示剂,用0.10mol·L-1的NaOH溶液滴定至终点,消耗NaOH溶液的体积为18.50mL。
①加入的指示剂是
②上述弗米产品中二甲酸钾的质量分数为
您最近一年使用:0次
2012·上海闵行·三模
解题方法
9 . 如图中曲线a和b是在一定温度下盐酸与氢氧化钠溶液相互滴定的滴定曲线,下列叙述正确的是( )


| A.盐酸的物质的量浓度均为1mol/L |
| B.P点时反应恰好完全,溶液呈中性 |
| C.曲线a是盐酸滴定氢氧化钠的滴定曲线 |
| D.酚酞可以用作本实验的指示剂 |
您最近一年使用:0次
2012·上海徐汇·二模
10 . ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行下列实验:准确量取ClO2溶液10 mL,稀释成100 mL试样;量取V1 mL试样加入到锥形瓶中,调节试样的pH ≤ 2.0,加入足量的KI晶体,静置片刻;加入淀粉指示剂,用c mol/L Na2S2O3溶液滴定至终点,反应原理:2 Na2S2O3 + I2 → Na2S4O6 + 2 NaI,消耗Na2S2O3溶液V2 mL。
(1)滴定过程中至少须进行两次平行测定的原因是_____________ 。
(2)到达滴定终点时指示剂的颜色变化为________________ 。
(3)原ClO2溶液的浓度为____________ g / L(用含字母的代数式表示)。
(1)滴定过程中至少须进行两次平行测定的原因是
(2)到达滴定终点时指示剂的颜色变化为
(3)原ClO2溶液的浓度为
您最近一年使用:0次



