名校
解题方法
1 . 常温下,向20mL0.1mol/L一元碱MOH溶液中滴加等浓度的一元酸HX溶液,滴定过程中溶液pH值的变化曲线如下图所示,已知4<m<6,下列说法不正确的是

| A.该滴定过程中应选用酚酞作指示剂 | B.一元酸HX的Ka=5×10-5 |
| C.溶液中水的电离程度:b>c>a | D.c点溶液中:c(M+)>c(X-)>c(H+)>c(OH-) |
您最近一年使用:0次
2024-01-15更新
|
340次组卷
|
4卷引用:2024届陕西省宝鸡市高考模拟监测(一) 理科综合试题
2024届陕西省宝鸡市高考模拟监测(一) 理科综合试题(已下线)专题07 水溶液中的离子反应与平衡-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)湖南省常德市第一中学2023-2024学年高二上学期期末考试化学试题广东省梅州市大埔县虎山中学2023-2024学年高二下学期4月期中考试化学试题
名校
2 . 常温下,向 溶液中逐滴加入
溶液中逐滴加入 的NaOH溶液,滴入NaOH溶液的体积与溶液pH的变化关系如图所示。下列说法正确的是
的NaOH溶液,滴入NaOH溶液的体积与溶液pH的变化关系如图所示。下列说法正确的是

 溶液中逐滴加入
溶液中逐滴加入 的NaOH溶液,滴入NaOH溶液的体积与溶液pH的变化关系如图所示。下列说法正确的是
的NaOH溶液,滴入NaOH溶液的体积与溶液pH的变化关系如图所示。下列说法正确的是
A.a点的 | B.b点时, |
C.c点时, | D.c点时,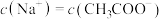 |
您最近一年使用:0次
2023-06-19更新
|
340次组卷
|
4卷引用:陕西省镇安中学2023届高三下学期模拟考试理综试题
陕西省镇安中学2023届高三下学期模拟考试理综试题(已下线)考点3 盐类水解(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)选择题11-16山东省德州市实验中学2023-2024学年高二上学期期中考试 化学试题
名校
解题方法
3 . 化学上常用 表示溶液中的
表示溶液中的 。
。 时,用
时,用 的
的 溶液滴定
溶液滴定 的
的 溶液(
溶液( ),滴定过程中
),滴定过程中 与所加
与所加 溶液的体积(
溶液的体积( )的关系如图所示(忽略体积变化),下列说法错误的是
)的关系如图所示(忽略体积变化),下列说法错误的是

 表示溶液中的
表示溶液中的 。
。 时,用
时,用 的
的 溶液滴定
溶液滴定 的
的 溶液(
溶液( ),滴定过程中
),滴定过程中 与所加
与所加 溶液的体积(
溶液的体积( )的关系如图所示(忽略体积变化),下列说法错误的是
)的关系如图所示(忽略体积变化),下列说法错误的是
A. 点溶液的 点溶液的 ,从 ,从 点到 点到 点的过程中,水的电离程度先变大再变小 点的过程中,水的电离程度先变大再变小 |
B. 点溶液中存在: 点溶液中存在: |
C. 点加入 点加入 溶液的体积小于 溶液的体积小于 ,溶质为 ,溶质为 和 和 |
D. 点加入 点加入 溶液的体积小于 溶液的体积小于 |
您最近一年使用:0次
2022-11-23更新
|
594次组卷
|
3卷引用:陕西省宝鸡市陈仓区2023届高三下学期一模化学试题
陕西省宝鸡市陈仓区2023届高三下学期一模化学试题(已下线)化学(云南,安徽,黑龙江,山西,吉林五省通用A卷)-学易金卷:2023年高考第一次模拟考试卷上海市复旦大学附属中学2022-2023学年高三上学期期中等级性考试化学试题
4 . 重铬酸铵[(NH4)2Cr2O7 ]可用作媒染剂和有机合成催化剂,具有强氧化性。实验室将NH3通入重铬酸(H2Cr2O7)溶液中制备[(NH4)2Cr2O7 ],的装置如图所示(夹持装置略)。回答下列问题:
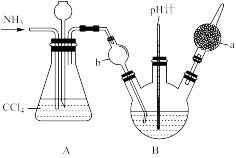
已知: (橙色)+ H2O
(橙色)+ H2O 2
2 (黄色)+2H+。
(黄色)+2H+。
(1)仪器a的名称是_______ , b处的作用为_______ ;实验时控制三颈烧瓶内溶液pH约为4,pH不宜过大的原因是_______ ;A 装置的作用为_______ 。
(2)在试管中加入少量(NH4)2Cr2O7固体,加水溶解,再滴加足量KOH浓溶液,振荡,微热,观察到的主要现象是_______ 。
(3)实验室常用甲醛法测定含(NH4)2Cr2O7的产品中(NH4)2Cr2O7的质量分数,其反应原理为2Ba2+ + +H2O=2BaCrO4 +2H+、4
+H2O=2BaCrO4 +2H+、4 +6HCHO=(CH2)6N4H+ +6H2O+ 3H+,然后用NaOH标准溶液滴定反应生成的酸。实验步骤:
+6HCHO=(CH2)6N4H+ +6H2O+ 3H+,然后用NaOH标准溶液滴定反应生成的酸。实验步骤:
Ⅰ.称取样品12. 00 g,配成250 mL溶液。
Ⅱ.量取25.00mL样品溶液,用氯化钡溶液使 完全沉淀后,加入足量的20%中性甲醛溶液,摇匀,静置5 min。
完全沉淀后,加入足量的20%中性甲醛溶液,摇匀,静置5 min。
Ⅲ.以酚酞作指示剂,用1. 00 mol·L-1的NaOH标准溶液滴定,记录数据。
Ⅳ.重复步骤Ⅱ、Ⅲ2~3次,处理数据。
①滴定终点的颜色变化为_______ 。
②用_______ (填“酸式”或“碱式”)滴定 管量取25.00 mL样品溶液于 250 mL锥形瓶中。
③与NaOH反应时,1 mol(CH2)6N4H+与1 mol H+相当,步骤III中(CH2)6N4H+与NaOH发生反应的离子方程式是_______ 。
④若实验平均消耗NaOH溶液的体积为16.00mL,则所得产物中(NH4)2Cr2O7 (摩尔质量为252 g·mol-1)的质量分数为_______ %。
⑤若滴定终点时仰视读数,则测定的质量分数将_______ (填“偏大”、“偏小”或“不变”)。
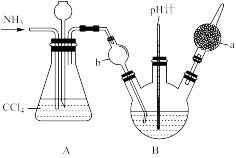
已知:
 (橙色)+ H2O
(橙色)+ H2O 2
2 (黄色)+2H+。
(黄色)+2H+。(1)仪器a的名称是
(2)在试管中加入少量(NH4)2Cr2O7固体,加水溶解,再滴加足量KOH浓溶液,振荡,微热,观察到的主要现象是
(3)实验室常用甲醛法测定含(NH4)2Cr2O7的产品中(NH4)2Cr2O7的质量分数,其反应原理为2Ba2+ +
 +H2O=2BaCrO4 +2H+、4
+H2O=2BaCrO4 +2H+、4 +6HCHO=(CH2)6N4H+ +6H2O+ 3H+,然后用NaOH标准溶液滴定反应生成的酸。实验步骤:
+6HCHO=(CH2)6N4H+ +6H2O+ 3H+,然后用NaOH标准溶液滴定反应生成的酸。实验步骤: Ⅰ.称取样品12. 00 g,配成250 mL溶液。
Ⅱ.量取25.00mL样品溶液,用氯化钡溶液使
 完全沉淀后,加入足量的20%中性甲醛溶液,摇匀,静置5 min。
完全沉淀后,加入足量的20%中性甲醛溶液,摇匀,静置5 min。Ⅲ.以酚酞作指示剂,用1. 00 mol·L-1的NaOH标准溶液滴定,记录数据。
Ⅳ.重复步骤Ⅱ、Ⅲ2~3次,处理数据。
①滴定终点的颜色变化为
②用
③与NaOH反应时,1 mol(CH2)6N4H+与1 mol H+相当,步骤III中(CH2)6N4H+与NaOH发生反应的离子方程式是
④若实验平均消耗NaOH溶液的体积为16.00mL,则所得产物中(NH4)2Cr2O7 (摩尔质量为252 g·mol-1)的质量分数为
⑤若滴定终点时仰视读数,则测定的质量分数将
您最近一年使用:0次
解题方法
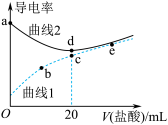
5 . 常温下,用一定浓度的盐酸滴定某浓度的氨水。滴定终点附近溶液的pH和导电能力的变化如图所示(利用溶液导电能力的变化可判断滴定终点,溶液总体积变化忽略不计)。下列说法错误的是( )
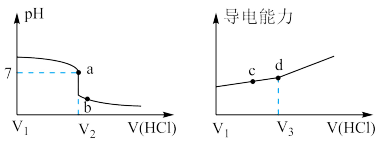

A.a点对应的溶液中: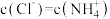 |
B.a→b过程中, 不断增大 不断增大 |
C.c→d溶液导电性增强的主要原因是 和 和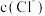 增大 增大 |
D.根据溶液pH和导电能力的变化可判断: |
您最近一年使用:0次
名校
6 . 已知:四甲基氢氧化铵[(CH3)4NOH ]是强碱,甲胺 (CH3NH2・H2O)为弱碱。常温下,在体积均为20 mL、浓度均为0.1 mol/L的四甲基氢氧化铵溶液和甲胺溶液中,分别滴加浓度为0.1 mol/L的盐酸,溶液的导电率与盐酸体积的关系如图所示。下列说法正确的是

| A.pH的相对大小: c>d |
| B.在b、c、e三点中,水的电离程度最大的点是e |
| C.b 点溶液:c(H+)+c(CH3NH3+) = c(OH-) |
| D.c 点溶液:c(Cl-)>c(CH3NH3+) >c(H+) >c(OH-) |
您最近一年使用:0次
2019-04-25更新
|
795次组卷
|
2卷引用:【全国百强校】陕西省宝鸡中学2019届高三下学期第三次模拟考试理科综合化学试题
名校
7 . 五水硫代硫酸钠(化学式为Na2S2O3• 5H2O)不溶于乙醇,易溶于水,可用于鞣制皮革、矿石提银、水产养殖、医疗解毒等,工业上常用Na2S、Na2CO3为原料制备,其生产流程如下图所示,回答下列问题。

(1)五水硫代硫酸钠中硫元素的化合价为__________ 。常温下,Na2S溶液的pH_______ 7(选填“>”、“<”或“=”)。
(2)溶解原料的蒸馏水需加热煮沸一段时间后待用,其目的是____________ 。
(3)Na2S和Na2CO3按物质的量比2:1投料后加热,将SO2缓缓通入溶液中,即可获得Na2S2O3,反应的化学方程式为___________________________ 。
(4)上述制备实验一般须控制在碱性环境下进行,若在酸性条件下产品会发黄,用离子方程式表示其可能的原因___________________________ 。
(5)充分反应后趁热过滤,将滤液水浴加热浓缩,冷却析出后用乙醇洗涤表面,即可获得纯净的无色透明晶体。趁热过滤和用乙醇洗涤的目的是___________________________ 。
(6)为测定产品中Na2S2O3• 5H2O的纯度,准确称取样品质量,用适量的蒸馏水溶解,加入指示剂用已知浓度的碘的标准溶液滴定。
反应原理为:2S2O32-+I2= S4O62-+2I-
①加入的指示剂为______________________ (填名称)。
②滴定至终点时,溶液颜色的变化______________________ 。
③该实验中,滴加标准碘液的操作正确的是________________________________ (填图中对应操作的字母编号)。

④下列操作可使产品纯度检测值偏高的是___________ (选填编号)。
a.装标准液的滴定管水洗后未润洗
b.滴定过程中出现漏液
c.滴定结束时俯视读数

(1)五水硫代硫酸钠中硫元素的化合价为
(2)溶解原料的蒸馏水需加热煮沸一段时间后待用,其目的是
(3)Na2S和Na2CO3按物质的量比2:1投料后加热,将SO2缓缓通入溶液中,即可获得Na2S2O3,反应的化学方程式为
(4)上述制备实验一般须控制在碱性环境下进行,若在酸性条件下产品会发黄,用离子方程式表示其可能的原因
(5)充分反应后趁热过滤,将滤液水浴加热浓缩,冷却析出后用乙醇洗涤表面,即可获得纯净的无色透明晶体。趁热过滤和用乙醇洗涤的目的是
(6)为测定产品中Na2S2O3• 5H2O的纯度,准确称取样品质量,用适量的蒸馏水溶解,加入指示剂用已知浓度的碘的标准溶液滴定。
反应原理为:2S2O32-+I2= S4O62-+2I-
①加入的指示剂为
②滴定至终点时,溶液颜色的变化
③该实验中,滴加标准碘液的操作正确的是

④下列操作可使产品纯度检测值偏高的是
a.装标准液的滴定管水洗后未润洗
b.滴定过程中出现漏液
c.滴定结束时俯视读数
您最近一年使用:0次
2019-03-12更新
|
413次组卷
|
2卷引用:【全国百强校】陕西省宝鸡中学2019届高三第一次模拟考试理科综合化学试题
真题
名校
8 . 室温下,用0.l00mol/L NaOH溶液分别滴定20.00 mL 0.100 mol/L的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是
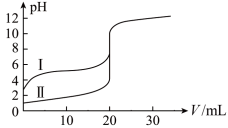

| A.II表示的是滴定醋酸的曲线 |
| B.pH=7时,滴定醋酸消耗的V(NaOH)小于20 mL |
| C.V(NaOH)=" 20.00" mL时,两份溶液中c(Cl-)= C(CH3COO-) |
| D.V(NaOH) ="10.00" mL时,醋酸溶液中c(Na+)> C(CH3COO-)> c(H+)> c(OH-) |
您最近一年使用:0次
2019-01-30更新
|
4228次组卷
|
50卷引用:陕西省西安市长安区第一中学2018届高三上学期第五次质量检测化学试题
陕西省西安市长安区第一中学2018届高三上学期第五次质量检测化学试题2017届江西省赣中南五校高三上学期第一次模拟考试化学试卷湖北省武昌区2017届高三5月调研考试理综化学试题【全国百强校】陕西省西安市长安区第一中学2018-2019学年高二(理)上学期期末考试化学试题【区级联考】湖北省武汉市武昌区2019届高三下学期五月调研考试理科综合化学试题陕西省延安市吴起高级中学2020-2021学年高二上学期第一次月考化学试题陕西省西安市长安区第一中学2017-2018学年高二上学期第四次教学质量检测化学试题2014年全国普通高等学校招生统一考试理科综合能力测试化学(海南卷)(已下线)2014-2015学年吉林省延边二中高二上学期期中理科化学卷2015届安徽省芜湖一中高三上学期期末理综化学试卷2014-2015学年河北省正定中学高二下第三次月考化学试卷2015-2016学年甘肃省天水一中高二上学期第一次段中考试化学试卷2015-2016学年山西省怀仁一中高二上11月月考化学试卷2015-2016学年山西省曲沃中学高二上学期12月月考化学试卷2015-2016学年重庆市杨家坪中学高二上学期第三次月考化学试卷2015-2016学年四川省广安市邻水等高二下学期期末联考化学试卷2016-2017学年安徽省六安一中高二上阶段测二化学卷2017届四川省眉山中学高三2月月考理科综合化学试卷安徽省黄山市2016-2017学年高二上学期期末质量检测化学试题浙江省温州中学2017-2018学年高二上学期期中考试化学试题安徽省淮南市第二中学2017-2018学年高二上学期第二次月考化学试题吉林省辽源市田家炳高级中学等五校2018届高三上学期期末联考化学试题广西陆川中学2017-2018学年高三化学上学期期末考试题江西省抚州市临川区第一中学2018届高三上学期期末考试理综-化学试题福建省莆田第一中学2017-2018学年高二下学期期初考试化学试题内蒙古自治区翁牛特旗乌丹第一中学2018-2019学年高二上学期期中考试化学试题【全国百强校】福建省仙游第一中学2018-2019学年高二下学期第一次月考化学试题(已下线)专题10 水溶液中的离子平衡——2019年高考真题和模拟题化学分项汇编广西桂林十八中2020届高三上学期8月第一次月考化学试题河南省鹤壁市浚县二中2019-2020学年高二上学期第二次月考化学试题苏教版选修四化学反应原理专题3第三单元 盐类的水解 同步检测试卷【全国百强校】广西壮族自治区玉林高级中学2020届高三上学期第一次月考(8月)理综化学试题山西运城市运康中学校2019-2020学年高三12月月考化学试题广东省广州市天河中学2019-2020学年高二上学期能力性考试(11月月考)化学试题2020年春季人教版高中化学选修4第三章《水溶液中的离子平衡》测试卷2020届高三化学二轮冲刺新题专练—混合溶液中微粒浓度大小的比较夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——酸碱中和滴定专题2.3 水溶液中的离子平衡(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升云南省昆明市东川区明月中学2018-2019学年高二下学期期中考试化学试题四川省凉山州2018-2019学年高二下学期期期末考试化学试题安徽省池州市第一中学2020-2021学年高二12月月考化学试题宁夏海原县第一中学2021届高三上学期期末考试化学试题甘肃省天水市第一中学2020-2021学年高二下学期开学考试化学试题湖北省恩施利川市第五中学2019-2020学年高二上学期期中考试化学试题黑龙江省鹤岗市第一中学2021-2022学年高二上学期期中考试化学试题浙江省诸暨市2017-2018学年高一下学期期末考试化学试题 北京市日坛中学2021-2022学年高二上学期期中考试化学试题北京市日坛中学2022-2023学年高二上学期期中考试化学试题北京市第二中学2023-2024学年高二上学期第二学段 段考化学试题重庆市璧山来凤中学2023-2024学年高二上学期12月月考化学试题
9 . 硫代硫酸钠晶体(Na2S2O3·5H2O,M=248 g·mol−1)可用作定影剂、还原剂。回答下列问题:
(1)已知:Ksp(BaSO4)=1.1×10−10,Ksp(BaS2O3)=4.1×10−5。市售硫代硫酸钠中常含有硫酸根杂质,选用下列试剂设计实验方案进行检验:
试剂:稀盐酸、稀H2SO4、BaCl2溶液、Na2CO3溶液、H2O2溶液
(2)利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
①溶液配制:称取1.2000 g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在__________ 中溶解,完全溶解后,全部转移至100 mL的_________ 中,加蒸馏水至____________ 。
②滴定:取0.00950 mol·L−1的K2Cr2O7标准溶液20.00 mL,硫酸酸化后加入过量KI,发生反应: Cr2O +6I−+14H+=3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O
+6I−+14H+=3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O =S4O
=S4O +2I−。加入淀粉溶液作为指示剂,继续滴定,当溶液
+2I−。加入淀粉溶液作为指示剂,继续滴定,当溶液__________ ,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为_________ %(保留1位小数)。
(1)已知:Ksp(BaSO4)=1.1×10−10,Ksp(BaS2O3)=4.1×10−5。市售硫代硫酸钠中常含有硫酸根杂质,选用下列试剂设计实验方案进行检验:
试剂:稀盐酸、稀H2SO4、BaCl2溶液、Na2CO3溶液、H2O2溶液
| 实验步骤 | 现象 |
| ①取少量样品,加入除氧蒸馏水 | ②固体完全溶解得无色澄清溶液 |
| ③ | ④ |
| ⑤静置, | ⑥ |
(2)利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
①溶液配制:称取1.2000 g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在
②滴定:取0.00950 mol·L−1的K2Cr2O7标准溶液20.00 mL,硫酸酸化后加入过量KI,发生反应: Cr2O
 +6I−+14H+=3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O
+6I−+14H+=3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O =S4O
=S4O +2I−。加入淀粉溶液作为指示剂,继续滴定,当溶液
+2I−。加入淀粉溶液作为指示剂,继续滴定,当溶液
您最近一年使用:0次
2018-06-09更新
|
10556次组卷
|
16卷引用:陕西省宝鸡中学2019届高三入学调研考化学试题
陕西省宝鸡中学2019届高三入学调研考化学试题【市级联考】广东省化州市2019年高三上学期第二次模拟考试理科综合化学试题2018年全国普通高等学校招生统一考试化学(新课标III卷)(已下线)2018年高考题及模拟题汇编 专题16 化学实验综合题安徽省淮北地区2019届高三上学期入学摸底考试化学试题云南省玉溪市元江一中2019届高三第一次月考化学试题(已下线)2019高考热点题型和提分秘籍 第四章 常见的非金属及其化合物 第3讲 硫及其化合物 (教学案)【全国百强校】广西河池市高级中学2018-2019学年高二下学期第一次月考理综-化学试题(已下线)《2019年高考总复习巅峰冲刺》专题10 化学实验基础应试策略西藏拉萨中学2019-2020学年高二上学期第三次月考理综化学试题四川省雅安中学2020-2021学年高二下学期期中考试理综化学试题(已下线)考点31 物质的制备 定量分析-备战2022年高考化学一轮复习考点帮(全国通用)广东省深圳市第七高级中学2022届高三上学期9月月考化学试题广西容县高级中学2021-2022学年高二下学期开学考试理科综合化学试题 鲁科版(2019)选择性必修1 第3章 物质在水溶液中的行为 第4节 离子反应(已下线)专题17化学实验综合题-五年(2018~2022)高考真题汇编(全国卷)
2018高三·全国·专题练习
10 . 常温下,用0.1 mol·L−1盐酸滴定10.0 mL浓度为0.1 mol·L−1Na2A溶液,所得滴定曲线如图所示。下列说法错误的是


| A.Ka2(H2A)的数量级为10−9 |
| B.当V=5时:c(A2−)+c(HA−)+c(H2A)=2c(Cl−) |
| C.NaHA溶液中:c(Na+)>c(HA−)>c(A2−)>c(H2A) |
| D.c点溶液中:c(Na+)>c(Cl−)>c(H+)=c(OH−) |
您最近一年使用:0次
2018-04-24更新
|
305次组卷
|
3卷引用:陕西省榆林市 2020届高考3月线上模拟考试化学试题



